茅莓提取物体内抗乙型肝炎病毒的实验研究
柳勤译,陈晓武,杨小乔,许鸣
(广东省第二人民医院消化内科,广东 广州 510317)
乙型肝炎是一种全球性分布的病毒传染病,其感染面广,传染性强,易慢性化。我国每年约有40万人死于与慢性乙型肝炎(chronic hepatitis B,HBV)相关的疾病,抗病毒治疗是治疗HBV最主要的治疗措施,目前国内外公认批准有效的抗HBV药物主要包括干扰素类[1]和核苷(酸)类似物(nucleoside analogues,NA),但单一抗病毒药如干扰素需注射治疗,不良反应较大,不适用于肝硬化失代偿期和白细胞及血小板明显减少的肝病患者;核苷类药物,其中以拉米夫定疗效最为确切。细胞研究证实,拉米夫定能有效抑制HBV复制,但仅仅抑制病毒DNA的复制量及其复制中间体的产量,核苷类药物疗程难以确定,因此在停止用药后可发生反跳,长期应用可产生耐药突变,且副作用大,费用高。与干扰素和核苷类药物相比,传统中药在长期治疗HBV过程中体现了其疗效稳定、毒副作用小的独特优势。中草药治疗HBV的有效性在于它具有促进肝脏细胞的修复、保护细胞膜、调节免疫功能和抑制病毒复制等方面的作用。茅莓是一种传统民间中药,据《中药大辞典》记载,茅莓的根、茎和叶均可药用,用于治疗肝脾肿大、黄疸、慢性肝炎等[2]。目前有国内外学者报道茅莓提取物(乙酸乙酯部分)对HBsAg和HBeAg两种抗原的表达均有抑制作用,但尚无茅莓提取物(乙酸乙酯部分)在体内抗乙型肝炎病毒相关方面的报道,为此进行本研究。
1 材料与方法
1.1 药物 受试药物茅莓提取物(乙酸乙酯部分),为粉末剂由南方医科大学药理教研室提供。阳性药选择:选择对鸭乙型肝炎病毒(duck hepatitis B virus,DHBV)抑制作用较强的拉米夫定作为阳性对照药,规格0.1 g,中国苏州葛兰素史克制药(苏州)有限公司生产,批号:H20070581。
1.2 动物 3日龄麻鸭,购自广西临桂县五通镇孵化场,体重约50 g/只,常规饲养。饲养环境:温度20~25 ℃,相对湿度60%~80%,定时通风换气,每日约12 h光照。饲料:宝鼎501小鸭饲料,由穗屏企业有限公司饲料厂生产,40 kg/包。
1.3 主要试剂及仪器 Taq酶,10×PCR buffer、dNTP mixture、6×loading buffer,均购自北京赛百盛生物工程有限公司。引物由北京赛百盛生物工程有限公司合成,梯度聚合酶链反应(polymerase chain reaction,PCR)仪,mastercycler gradint 型号5331。高速离心机,Eppenolf 型号5415D。Dyy-6C型电泳仪。NC膜:购自Amersham公司;DHBV质粒:由广州中医药大学热带病研究所病毒室提供;缺口翻译药盒:购自promega公司;α-32 p-dCTP,购自北京亚辉公司;Sephadex G-50:购自Pharmacia公司;96孔杂交点样器:美国Bio-rad公司产品;盖革氏计数器:美国S.E.International 公司产品。常规HE染色所需试剂由南方医科大学组胚教研室提供。
1.4 方法
1.4.1 模型筛选 DHBV阳性鸭子的筛选:3日龄麻鸭200只于第2天经胫静脉取血,分离血清后,用常规PCR方法检测DHBV,第5天出结果,筛选出先天感染DHBV鸭65只。
1.4.2 分组与给药 取经PCR方法筛选出的先天感染DHBV鸭50只,随机分为5组,每组10只:茅莓提取物400、200、100 mg/kg组,生理盐水对照组1 ml/kg;拉米夫定50 mg/kg组,每天灌胃2次,连续灌胃21 d。
1.4.3 取样方法 在给药前(T0),用药后7 d(T7)、14 d(T14)、21 d(T21),停药后3 d(P3)、7 d(P7)自胫静脉取血分离血清,-20 ℃冻存待检。停药7 d后将实验动物全部颈动脉放血处死,立即摘取肝脏,取肝右叶相同部位组织0.5 cm×0.5 cm大小,用10%中性福尔马林固定,石蜡包埋切片,HE染色待检。
1.4.4 DHBV-DNA 检测方法取上述鸭血清采用斑点杂交法,每批同时点膜,测定鸭血清中DHBV-DNA水平的变化,按缺口翻译试剂盒说明书方法,用32P标记DHBV-DNA探针,并作鸭血清DNA斑点杂交,放射自显影膜片斑点,在酶标检测仪上测定OD值(滤光片波长为490 nm),计算鸭血清DHBV-DNA密度。
1.4.5 肝组织病理学观察 参照2001年《病毒性肝炎防治方案》及目前国际上常用Knodell HAI、Ishak、Scheuer 和Chevallier 等评分系统或半定量计分方案,了解肝脏炎症病理变化程度,以及评价药物疗效。本实验观察指标:细胞水肿、气球样变、间质炎细胞浸润、点状坏死。400倍光学显微镜下观察HBV肝组织:(1)细胞水肿:不出现者为(-);占肝小叶1/2~1/3者为(+);占肝小叶1/2以上者为(++);肝小叶广泛水肿者为(+++)。(2)气球样变:评分同细胞水肿。(3)间质炎细胞浸润:未见者为(-);偶见者为(+);广泛可见者为(+++);居于(+)与(+++)之间者为(++)。(4)坏死:不出现为(-);肝小叶出现1~2个坏死灶者为(+);出现3~4个坏死者(++),出现4个以上坏死灶者为(+++)。
1.5 统计学方法 采用SPSS 13.0软件包进行统计分析,多组计量资料分析采用One-way ANOVA,多重比较采用最小显著差数法(least significant difference,LSD);双向有序等级资料采用线趋势检验,两两比较采用S-N-K法。
2 结果
2.1 鸭血清DHBV-DNA检测结果 盐水对照组动物血清DHBV-DNA水平稳定。拉米夫定口服21 d可显著抑制血清DHBV-DNA,停药3 d和7 d后DHBV-DNA显著回升。茅莓提取物各剂量组各时点血清DHBV-DNA变化差异无显著性,见表1。

表1 茅莓提取物在鸭体内对DHBV-DNA的抑制作用
注:与对照组相同时间比较:1)P<0.05,2)P<0.01;与同组T0比较:3)P<0.01
2.2 肝组织病理学显微镜观察 茅莓提取物大剂量组的鸭肝组织内可见重度细胞水肿,但气球样变较其他各组轻,未见坏死、纤维化和间质炎细胞浸润。对照组及各药物组动物均可见肝细胞重度细胞水肿、气球样变性,几乎无点灶状及碎屑样坏死,无纤维增生,可见轻度间质炎细胞浸润,这些病理表现各组差异无显著性(P>0.05),见表2。
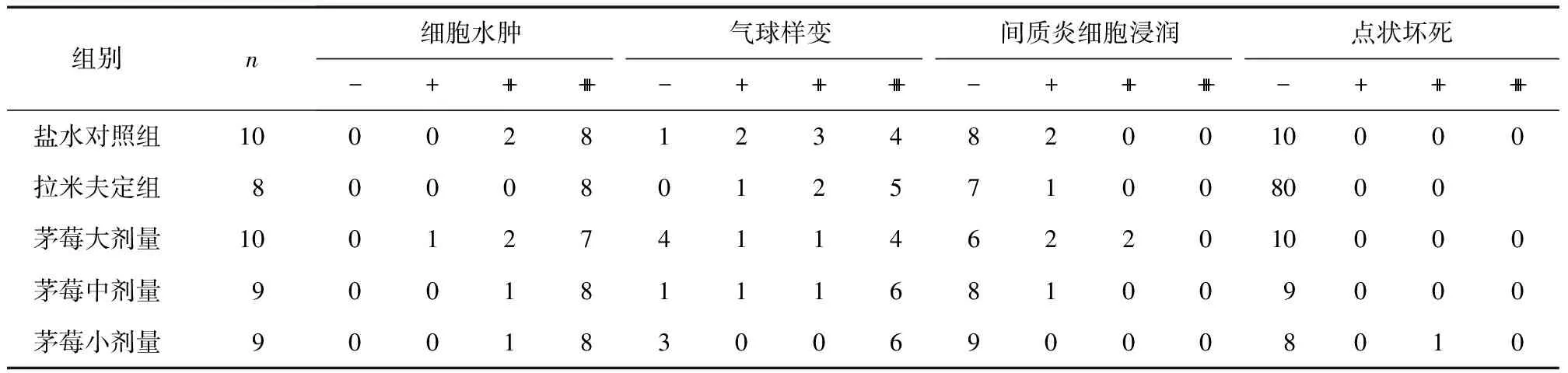
表2 各组鸭肝病理变化结果
注:各组肝组织病理检查,P>0.05
3 讨论
HBV属于嗜肝DNA病毒科,这个家族的所有病毒都很小,嗜肝性,毒粒形态和基因组相似,复制经RNA逆转录,毒粒形态和基因组相似,复制经RNA逆转录。一些哺乳动物和禽类嗜肝病毒的发现为人类研究人乙型肝炎病毒的生物学相关机制提供了实验和道德伦理上的便利。由于禽类嗜肝病毒的DHBV与人乙型肝炎病毒均属于嗜肝病毒科,两者在毒粒形态、结构、基因组成、复制及传播方式等方面均很相似[3-5]。国内目前多选用后天感染的鸭为肝炎的动物模型。国外学者目前普遍采用DHBV感染1~3日龄雏鸭建立乙型肝炎动物模型,通过比较,先天感染DHBV的雏鸭较后天感染模型的血清病毒持续时间长,病毒滴度高;对肝组织的炎性反应长期存在,细胞病变较为明显,其病毒血症持续时间较长且较稳定,无明显的自然转阴现象,是研究人类乙型肝炎发病机制、病毒复制过程及筛选有效治疗药物的理想动物模型[6]。本研究发现:盐水对照组鸭血清DHBV-DNA水平稳定,阳性药物拉米夫定可显著抑制血清DHBV-DNA,停药3 d和7 d DHBV-DNA显著回升,与国内外报道的结果和临床结果都相吻合。国内外学者报道茅莓提取物(乙酸乙酯部分)对HBsAg和HBeAg两种抗原的表达均有抑制作用,且在96 h达高峰,并呈现浓度依赖性和时间依赖性,这说明茅莓提物(乙酸乙酯部分)在体外有抗乙型肝炎病毒的作用,然而在体内茅莓提取物(乙酸乙酯部分)各剂量组21 d疗程各时点血清DHBV-DNA变化差异无显著性[7-8]。这结果显示茅莓提取物经过体内代谢后在鸭体内对DHBV-DNA无抑制作用。考虑原因有:(1)茅莓提取物在体内确实无抗病毒作用,与国内报道的有相当多的药物体外有抑制病毒复制作用,而体内并无抗病毒作用相一致。(2)给药剂量不足不能达有效血药浓度,茅莓提取物在细胞试验中已表现出对HBsAg和HBeAg的表达抑制,并呈现出浓度依赖性和时间依赖性。(3)给药途径的影响,茅莓提取物在给鸭灌胃经鸭体内代谢后抗病毒的有效成分可能已经被破坏。(4)给药时间可能太短,目前常用两大类抗病毒药物都需要长期用药,作用机制不同,药物起效需要的时间也不一样。
综上所述,本实验研究中发现:茅莓提取物(乙酸乙酯部分)抗乙型肝炎病毒作用主要是通过其原形发挥作用,该原形在麻鸭体内经过代谢后,失去抗乙型肝炎病毒的作用。
参考文献:
[1]拉米夫定临床应用专家组.2003年拉米夫定临床应用专家共识[J].中华肝脏病杂志,2003,11(8):497.
[2]南京中医药大学.中药大辞典[M].2版.上海:上海科学技术出版社,2006:2699.
[3]斯崇文,王勤环.传染病学[M].北京:北京大学医学出版社,2004:2.
[4]杨绍基.传染病学[M].北京:人民卫生出版社,2002:112.
[5]彭文伟.传染病学[M].北京:人民卫生出版社,2001:132-134.
[6]杨书兰,张奉学,朱宇同,等.用PCR法筛选先天感染鸭乙肝模型及后天感染模型的比较[J].广州中医药大学学报,2001,18(3):256-259.
[7]Lok AS,McMahon BJ.Chronic hepatitis B [J].Hepatology.2007,45(2):507-539.
[8]Ghany M,Liang TJ.Drug targets and molecular mechanisms of drug resistance in chronic hepatitis B [J].Gastroenterology,2007,132:1574-85.

