创伤性脑损伤后脑水肿的分类及机制
王晶,张培,王怡萌,齐盈,高尚,杨智航
(1.沈阳医学院基础医学院临床医学专业2011级7班,辽宁 沈阳 110034;2.基础医学院生理教研室)
创伤性脑损伤(traumatic brain injury,TBI),也称为脑外伤,是指由创伤引起的脑组织损害。在当今社会仍是影响健康的常见疾病之一。损伤的原因大多为坠落伤、斗殴和交通事故。目前脑损伤的严重程度不断加重,其中交通事故占主要作用,虽然其引起的颅脑损伤在住院患者中所占的比例较小,但死亡率、致残率却很高。一些国家每年达100万以上,死亡率为9/10万,占住院全部死亡数的1%;而在我国每年有数十万人死于创伤,其中50%死于致命的创伤性脑损伤,15%~20%的死亡者年龄在5~35岁。TBI伤后,均有不同程度的脑水肿的发生和存在,引起病情进一步恶化,如果脑水肿治疗理想,能显著降低患者病死率、致残率,改善患者预后。
1 TBI的分类及病理变化
1.1 TBI的分类 TBI根据严重程度可分为:轻型、中型和重型。根据创口类型可分为:闭合性TBI和穿透性TBI。TBI的常见并发症有:运动功能缺陷、知觉障碍、认知缺陷、构音不清、语言障碍、外伤性癫痫、社交困难、自主神经功能紊乱、人格改变等。
1.2 TBI的病理变化 TBI的病理变化可分为原发性损伤、原发性损伤进展期、继发性损伤期、再生期,共4个时期[1]。原发性损伤指外伤即刻由机械外力直接作用导致的脑组织损伤,包括冲击性脑挫伤、滑动性脑挫伤、对冲性脑挫伤、剪切伤、冲击性血管反应(如硬脑膜下血肿、颅内压增高引起脑血流量下降、血管通透性增加引起脑水肿等)。继发性损伤指脑组织在直接损伤诱导下,发生复杂的病理生理改变后引起的脑继发性损伤,其在神经残疾中发挥重要作用。弥漫性轴索损伤(diffuse axonal injury,DAI)以脑白质轴索弥漫性损伤为主要特征,即可作为原发性脑损伤单独存在,也作为并发证与其他类型原发性脑损伤共同存在,被认为是钝性脑损伤的主要结局之一。阻断继发性脑损伤的作用环路有助于防止受损脑组织的凋亡,从而改善长期预后。
2 TBI的分类及发生机制
脑组织受到外来暴力打击后,出现过多的水分积聚在细胞内或者细胞外间隙,引起脑体积增大和重量增加。水分积聚于脑间质内,称为细胞外水肿;积聚于细胞内,包括胶质细胞或神经细胞内,称为细胞内水肿;两者常同时存在。脑组织的这种对暴力打击的病理生理反应称之为创伤性脑水肿。
创伤性脑水肿源于原发性脑损伤,其轻重程度与原发性脑损伤的程度密切相关。临床上局部的脑挫伤和脑挫裂伤引起局限性创伤性脑水肿,而严重的弥漫性轴索损伤可引起弥漫性的创伤性脑水肿,继发性的脑损伤可在很大程度上加重创伤性脑水肿的程度。从外伤后发生创伤性脑水肿的程度,可以间接判断原发性脑损伤的程度。创伤性脑水肿发生时,由于其脑组织的体积增加,使颅内压明显升高,甚至引起脑移位和脑疝,是导致死亡和残废的主要原因之一。
脑水肿作为创伤后脑损伤的病理现象,其发病机制与血脑屏障(blood brain barrier,BBB)受损、脑缺氧、颅内静脉压增高等诸多因素引起的导致脑组织中水分的运输和平衡失调有关。根据病理形态及发病机理,可将脑水肿分为渗透压性脑水肿、血管源性脑水肿和细胞毒性脑水肿3大类,随后又形成了因脑脊液循环障碍而引起的间质性脑水肿的概念[2]。
2.1 渗压性脑水肿 TBI时,下丘脑易遭到直接或间接损伤或水肿,使细胞外液的渗透压急剧下降,导致促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)和垂体后叶释放的抗利尿激素(antidiuretic hormone,ADH)的平衡遭到破坏,致使ACTH分泌不足,垂体后叶释放大量ADH,由此产生水潴留,低血钠、低血浆渗透压,导致血管水份向细胞内渗透,引起细胞内水肿,称为渗透压性脑水肿。常发生于脑损伤的亚急性期,通常在脑灰、白质的神经细胞内,BBB正常。
2.2 血管源性脑水肿 BBB结构与功能损害是血管源性脑水肿的病理基础。脑组织挫裂伤后,BBB遭受不同程度损害,其通透性增加,大量水份及血浆从毛细血管内渗出,积聚于血管周围间隙和神经细胞外间隙中,且逐渐向周围组织扩散,形成血管源性脑水肿,其发病机制如下。
2.2.1 微血管通透性增高 正常BBB只容许一些小分子溶质通过,因脑毛细血管通透性很低,其外周几乎被星形胶质细胞终足所包围,后者被视为BBB的组成部分(第二道屏障),故平时组织间液几乎不含蛋白。当脑损伤后,脑血管由于机械性损伤而导致BBB受损破坏,水肿液含较多蛋白质致使毛细血管通透性增加,水分渗出增多[3]。脑血流自动调节功能紊乱,脑血流锐减,加剧脑缺血缺氧。同时,在脑损伤局部区域也可引起脑血流过度灌注,导致脑细胞肿胀,血浆外渗增多,使脑水肿范围急剧扩展。
2.2.2 钙超载 脑损伤时脑组织缺血缺氧,可引起脑血流过度灌注,致使交感神经系统兴奋,大量释放儿茶酚胺(catecholamine,CA),乳酸堆积导致红细胞膜ATP酶活性降低,Na+、Ca2+含量增高,大量的Ca2+进入细胞内,胞浆中游离钙水平异常增高,甚至可达正常的10~15倍,即钙超载[4]。细胞内钙超载时,大量Ca2+沉积于线粒体,干扰氧化磷酸化过程,能量产生发生障碍,加重脑缺血缺氧。细胞内Ca2+升高激活PLA2和PLC,使膜磷脂降解,产生大量游离脂肪酸。特别是花生四烯酸(AA)在代谢过程中产生血栓素、白三烯等物质,同时产生大量的自由基,加重细胞损伤[5,6];其也可激活血小板,使其内Ca2+增加,形成微血栓,使受伤的脑组织缺血更加加剧,加重脑水肿。
脑组织由于缺血缺氧,脑血管平滑肌、内皮细胞均有明显的Ca2+内流增加,前者可使血管痉挛,后者可使内皮细胞收缩,内皮间隙扩大,血脑屏障开放,产生血管源性脑水肿。钙超载可以激活多种酶(ATP酶、蛋白酶、磷脂酶),使ATP、细胞蛋白质、脂质分解代谢增加,损害细胞骨架系统和膜系统,影响神经细胞内的快反应基因的表达和调控,影响细胞DNA,使细胞严重损害[7]。血管源性脑水肿主要存在于蛋白质中,一般在伤后立即出现,6~24 h达高峰。当BBB功能逐渐恢复后,含蛋白质成分的水肿液开始吸收减少,但这一过程一般要在受伤7 d以后才开始。
2.3 细胞毒性脑细胞水肿 脑损伤后,由于脑出血压迫和血管痉挛,脑组织细胞缺血、缺氧,能量代谢发生障碍,引起细胞钠泵和钾泵活性降低,Na+和Ca2+等大量储存于细胞内,细胞内渗透压升高,水分被动进入细胞内,导致细胞肿胀,故称为细胞毒性脑水肿,主要表现在神经元、胶质细胞及血管内皮细胞,同时伴有脑细胞外间隙的缩小。其发病机制如下。
2.3.1 细胞能量代谢障碍是细胞毒性脑水肿发生的基础 脑损伤后脑血管痉挛、颅内压增高、脑血流量减少使脑组织发生不完全性缺血,加之脑细胞糖原储存很少,组织中葡萄糖进行无氧酵解,ATP产生减少,仅为正常有氧代谢的5%。致使乳酸增多,细胞内PH值下降,造成细胞内、外酸中毒,钠泵、钙泵等离子泵运转失常,Na+大量储存于细胞内,Cl-由胞外进入胞内,结合为NaCl,使细胞内渗透压增高,大量水分被动内流,发生细胞内水肿。
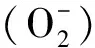
2.3.3 水通道蛋白(aquaporin,AQP) 又名水孔蛋白,是一组与水通透有关的细胞膜转运蛋白,广泛分布于动植物及微生物的细胞膜上,能够改变细胞膜对水的通透性,维持细胞内外水的平衡[9-10]。目前,在哺乳动物中发现至少13 种水通道蛋白[11],在脑组织中有6种:AQP1、AQP3、AQP4、AQP5、AQP8和AQP9,其中AQP4分布最广,主要分布于BBB星形胶质细胞膜表面,是介导水进出脑组织的主要蛋白,与调节脑内水平衡的关系最为密切[12]。AQP4不仅参与脑组织水代谢的生理和病理过程,而且可能调节脑脊液的形成及细胞外液容积的变化,并认为其在中枢神经系统作为渗透压感受器,介导和调节水的运输和平衡[13]。
然而随着对脑水肿研究的不断深入,已有研究推测脑中的AQP4可能有调节脑脊液的外流及细胞外液的体积的功能。Mahley等[14]在细胞毒性脑水肿模型中,显示AQP4基因敲除大鼠比野生型鼠更易存活,其脑水肿程度明显减低,说明在BBB不受损伤的情况下AQP4上调促进了细胞毒性脑水肿的发生;在缺血性脑水肿模型中,与正常组相比,AQP4基因敲除大鼠组的神经病理症状较轻,在缺血24 h后测定大脑半球肿胀百分率下降了35%。在创伤性脑水肿的实验中,Kiening等[15]研究认为在脑挫伤后24 h内AQP4在损伤区表达下降,是细胞毒性脑水肿的原因;而72 h后损伤区边缘的表达又开始增强,说明在BBB存在损伤的情况下AQP4上调可以减轻血管源性脑水肿;由此可见,AQP4在不同原因所致脑水肿中所起的作用是完全不同的。鲁宏等[16]通过磁共振技术发现缺血性脑水肿过程中存在AQP4的高表达。通过大鼠大脑中动脉栓塞实验,结果显示正常组和假手术组大脑实质微量AQP4表达,以脉络丛、室管膜细胞及血管周围的胶质细胞表达明显。进一步实验揭示,AQP4可能通过下列途径导致细胞内水肿:缺血、缺氧所致Na+-K+泵活性下降,使细胞内外渗透压失衡,激活了细胞膜外的渗透压感受器(或AQP4),通过相关的信号转导机制,使AQP4基因表达增强,AQP4蛋白合成增多,水通道开放,大量水分子流入细胞内形成细胞内水肿。
2.3.4 血浆内皮素(endothelin,ET) ET是含21个氨基酸的多肽,由血管内皮细胞产生,具有很强的收缩血管的作用。脑局部血管损伤引起全身性应激反应及局部出血,刺激下丘脑致ET含量升高。增多的ET通过与其受体结合激活磷脂酶产生自由基,从而使神经细胞和血管内皮细胞进一步损伤,造成脑组织水肿及坏死范围增大。自由基还可使血管内皮肿胀、破坏增加ET的释放。ET与自由基均可使大量Ca2+内流及兴奋性氨基酸(excitatory amino acids,EAAs)释放[17],引起神经细胞蛋白和磷脂代谢紊乱。导致严重的细胞毒性脑水肿,同时引起脑血管痉挛,BBB通透性增加,导致血管源性脑水肿。
细胞毒性脑水肿常发生在脑损伤的早期(24 h内),与血管源性脑水肿并存,发展迅速,对神经系统功能影响严重,伤后72 h开始消退。
2.4 间质性脑水肿 间质性脑水肿,水分来自于脑脊髓液,颅脑损伤后由于室管膜上皮受损严重,脑脊液吸收障碍,过多的脑脊髓液就在脑室中积聚,脑室内压升高引起脑室扩大,致使脑室内压力显著高于脑组织内的压力。产生脑室内-脑组织内压力梯度,这种压力梯度的显著差别,使脑室内液体可以透过脑室室管膜到脑室周围室管膜下白质内[18],造成不同程度的水肿。间质性脑水肿主要发生于脑损伤的后期或恢复期,常伴有脑白质萎缩脑积水。
综上所述,颅脑是人最重要的器官,它控制着人的生命中枢,在神经外科方面,颅脑外伤后引起的创伤性脑水肿作为临床常见的疾病往往病情十分严重,常常危及患者的生命,所以TBI一直是医学研究的一个既古老而又热门的话题。如果能更多认识脑水肿的发生机理,使脑水肿得到预防与治疗,则能使颅内疾病的治疗取得更好的结果。随着现代医学科学技术飞速的进步,相信在不久的将来,人类必将研究出疗效更确切的药物和更完善的治疗方法,而大大提高创伤性脑水肿的治愈率,降低其死亡和病残率。
参考文献:
[1]王忠诚.神经外科学[M].武汉:湖北科学技术出版社,2005,59-64.
[2]鲁宏,孙善全.脑水肿机制的研究进展[J].重庆医科大学学报,2002,27(4):494-496.
[3]陈火明,邹咏文.颅脑创伤后血脑屏障的改变[J].中华创伤杂志,2003,19(2):90- 92.
[4]Grotta JC,Manner C,Pettigrew LC,et al.Red blood cell disorders and stroke[J].Stroke,1986,17(5):811-817.
[5]Ikeda Y,Long DM.The molecular basis of brain injury and brain edema:the role of oxygen free radicals[J].Neurosurgery,1990,27(1):1-11.
[6]Wagner KR,Hua Y,de-Courten-Myers GM,et al.Tin-mesoporphyrin,a potent heme oxygenase inhibitor,for treatment of intracerebral hemorrhage:in vivo and in vitro studies[J].Cell Mol Biol(Noisy-le-grand),2000,46(3):597-608.
[7]徐如祥,易声禹,吴声伶,等.神经细胞Ca2+通道变化及对鼠血脑屏障通透性和外伤性脑水肿的影响[J].中华神经外科杂志,1992,8(1):41-43.
[8]袁淑娟,张生林.血浆内皮素、一氧化氮对脑出血病人脑水肿影响的研究[J].中西医结合心脑血管病杂志,2004,2(4):207-209.
[9]Ciechanowicz A,Krzyszta?owska M,Bińcjczak-Kuleta A.Aquaporins-a new element in the regulation of body water homeostasis [J].Pol Merkur Lekarski,2009,27(158):144-147.
[10]Yang S,Cui L.The action of aquaporins in cell elongation,salt stress and photosynthesis[J].Sheng Wu Gong Cheng Xue Bao,2009,25(3):321-327.
[11]Tait MJ,Saadoun S,Bell BA,et al. Water movements in the brain:role of aquaporins[J].Trends Neurosci,2008,31(1):37-43.
[12]Taya K,Marmarou CR,Okuno K,et al.Effect of secondary insults upon aquaporin-4 water channels following experimental cortical contusion in rats[J].J Neurotrauma,2010,27(1):229-239.
[13]李燕华,孙善全.低渗液对星形胶质细胞水通道蛋白-4表达的影响[J].中华医学杂志,2004,8(6):496-501.
[14]Mahley GT,Fujimura M,Ma T,et al .Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J].Nat Med,2000,6(2):159-163.
[15]Kiening KL,van Landeghem FK,Schreiber S,et al.Decreased hemispheric Aquaporin-4 is linked to brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324(2):105-108.
[16]鲁宏,孙善全.缺血性脑水肿的AQP4表达与磁共振成像的相关性研究[J].中国医学影像杂志,2003,19(8):957-960.
[17]刘爱芬,李义召,孙琳,等.脑出血病人血浆内皮素浓度的变化[J].脑和神经疾病志,1998,6(1):9-12.
[18]Solenov EI,Vetrivel L,Oshio K,et al.Optical measurement of swelling and water transport in spinal cord slices from aquaporin null mice[J].J Neurosci Methods,2002,113(1):85-90.

