姜黄素对大鼠大脑皮质缺血再灌注损伤的保护作用及其机制研究
刘莉,谭波涛,李昱,余刚
神经元通过线粒体氧化磷酸化生成ATP来提供能量,线粒体不是静止的细胞器,波动的内环境和增加的内生活性氧都会导致线粒体损伤,因此对细胞内代谢物、活性氧流通、线粒体功能和数量进行动态调节非常重要[1]。脑缺血过程中很多机制都会引起神经元线粒体功能障碍[2]。细胞内充足的线粒体数量及活跃的线粒体DNA(mtDNA)的复制和合成可改变病理状态下活性氧的增加[3-4]。线粒体转录因子A(mitochondrial transcription factor A,TFAM)是一种维持线粒体DNA复制量的核编码蛋白[3],是反映线粒体生物合成的重要因子[4]。研究证实,小鼠TFAM基因损伤可导致mtDNA损耗,影响mtDNA转录及其所编码多肽的合成,造成严重的呼吸链功能障碍[5]。解偶联蛋白2(UCP2)是一种跨线粒体内膜的质子通道转运蛋白[6],具有抑制线粒体活性氧生成[7]、降低线粒体电势差[8]、限制线粒体内Ca2+负荷[5]等作用,最终通过抑制细胞凋亡发挥保护效应。姜黄素是从姜黄根茎中提取的一种酚类物质,具有潜在的抗炎[9]、抗氧化[10]、抗肿瘤[11-12]等生物学效应[8]。已有研究表明,姜黄素对大鼠大脑局灶性缺血再灌注损伤具有保护作用[13],但其机制一直存在争议,尤其是姜黄素对线粒体的影响鲜有报道。本研究拟通过观察不同剂量姜黄素预处理对大鼠大脑皮质UCP2和TFAM表达的影响,探讨其对脑缺血再灌注损伤的保护机制。
1 材料与方法
1.1 实验动物及试剂 健康雄性SD大鼠80只,体重220~300g,由大坪医院实验动物中心提供。姜黄素(C1386,美国Sigma)用二甲基亚砜(DMSO)为溶剂配制为50mg/ml和100mg/ml两个工作浓度。
1.2 动物分组及处理 将大鼠随机均分为假手术组,缺血再灌注(I/R)组,姜黄素高剂量、低剂量组(简称高、低剂量组),每组20只。高、低剂量组于缺血前5d连续每天(最后一次于缺血前30min给药)分别经腹腔注射姜黄素100mg/kg和50mg/kg,假手术组和I/R组注射等体积DMSO。参照Longa等[14]的线栓改良法复制大鼠右侧大脑局灶性脑缺血模型,将一直径0.234mm的渔线经右侧颈外动脉切口缓慢向颈内动脉入颅方向推进18~20mm,感到阻力时即阻断大脑中动脉,2h后拨出鱼线完成造模。假手术组仅分离暴露颈总、颈外及颈内动脉,不予线栓插入。术后按照Longa 5分法[14]行神经症状评分,症状不明显(评分<1分)的动物予以剔除。
1.3 脑组织固定及尼氏染色 再灌注24h后,麻醉动物,打开胸腔,暴露心脏,将一输液针头插入左心室,向主动脉方向灌入生理盐水,同时于右心耳处剪一小口,灌注至右心房流出清亮液体,再由左心室灌入约200ml 4%多聚甲醛磷酸缓冲液固定。断头取脑,放入4%多聚甲醛溶液中固定过夜。在距右侧额叶前端3mm处向后(此为大脑中动脉供血的皮质区)切成厚3~4mm的薄片,依次放入梯度乙醇中脱水,二甲苯透明,包埋,切片。脑组织切片脱蜡后用蒸馏水冲洗,1%甲苯胺蓝溶液室温浸染30min;蒸馏水中冲洗后乙醇脱水,二甲苯透明,中性树胶封固。
1.4 电镜标本制备 灌注固定脑组织:所用灌注液为2%多聚甲醛与2%戊二醛的混合液,余步骤同前所述脑组织固定方法。在距额叶前端3mm和7mm处行冠状切片,取中间4mm厚脑块,沿矢状缝线旁开4mm处,与矢状缝所在面呈30°斜切,外侧皮质为缺血核心区。每例在内侧2mm以内取材3块,每块1mm3,于4%戊二醛中固定。按常规操作进行电镜标本制备,透射电镜观察神经元内线粒体的变化。
1.5 免疫组化染色 按照SP试剂盒说明书(北京康为世纪有限公司)进行免疫组织化学染色,所用抗体为兔抗大鼠UCP2多克隆抗体(1:200,博奥森公司)和兔抗大鼠TFAM单克隆抗体(1:100,美国Biovision)。光镜下胞质中棕黄色颗粒为阳性产物。应用Image Pro Plus 6.0(Media Cybernetics,美国)图像分析系统测定免疫阳性产物的平均光密度值。
1.6 TFAM和UCP2 mRNA表达测定 按照RNAiso Plus试剂盒(D9108A,日本TaKaRa)说明书提取皮质总RNA,引物由上海生工生物工程公司合成。引物序列:UCP2上游引物5'-GGTCGGAGATACCAGAGCAC-3',下游引物5'-ATGAGGTTGGCTTTCAGGAG-3',产物长度173bp;TFAM上游引物5'-ACGCCTAAAGAAGAAAGCACA-3',下游引物5'-ACACTGCGACGGATGAGAT-3',产物长度297bp;GAPDH上游引物5'-ACCACAGTCCATGCCATCAC-3',下游引物5'-TCCACCACCCTGTTGCTGTA-3',产物长度452bp。用一步法RT-PCR试剂盒(DRR037A,日本TaKaRa)进行反转录和PCR扩增,扩增产物行琼脂糖凝胶电泳,紫外分光光度计扫描,以GAPDH基因作为内参照,以UCP2和TFAM与GAPDH扩增条带光密度的比值表示UCP2和TFAM mRNA表达水平。
1.7 统计学处理 采用SPSS 17.0软件行统计学分析。计量资料以x±s表示,组间比较采用单因素方差分析,对多个样本均数间的两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
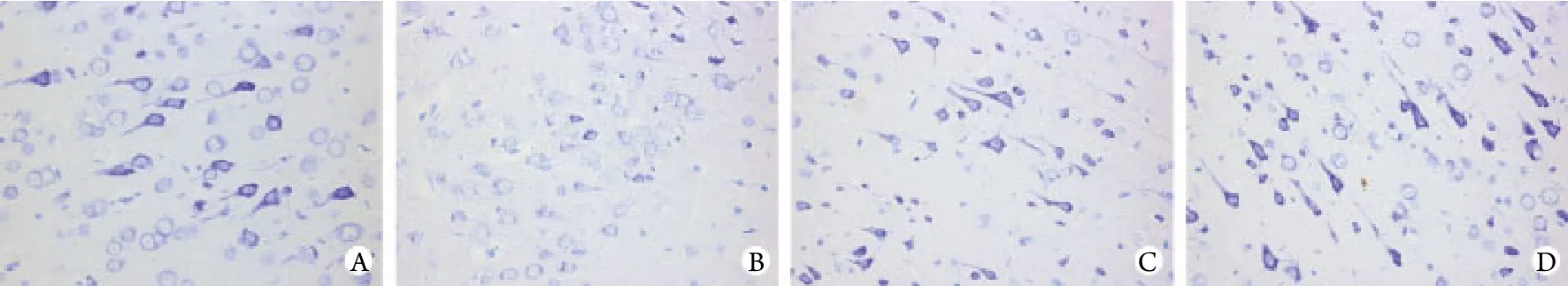
图1 姜黄素对皮质梗死区神经元尼氏体丢失的影响(尼氏染色 ×400)Fig. 1 Effect of curcumin on loss of Nissl body in infarcted cortex (Nissl staining ×400)A. Sham group; B. I/R group; C. Curcumin 50mg/kg group; D. Curcumin 100mg/kg group
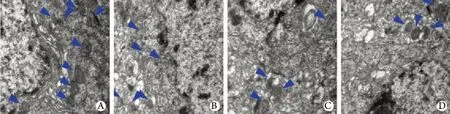
图2 姜黄素对皮质梗死区神经元线粒体形态的影响(透射电镜 ×5000 )Fig. 2 Effect of curcumin on mitochondrial morphology of neuron in infarcted cortex (transmission electron microscope ×5000)A. Sham group; B. I/R group; C. Curcumin 50mg/kg group; D. Curcumin 100mg/kg group
2 结 果
2.1 姜黄素对皮质梗死区神经元损伤的影响 在皮质缺血受累区域周围,I/R组染色后可见明显细胞水肿、空泡变性,尼氏小体颜色变浅且数目变少,甚至溶解消失。姜黄素高、低剂量组的神经元胞核清晰,尼氏小体深染成紫蓝色,核周围颗粒大,呈块状或颗粒状,高剂量组损伤程度比低剂量组轻(图1)。
2.2 姜黄素对皮质梗死区神经元线粒体形态的影响 假手术组大脑中动脉供血皮质区域内,线粒体大小、形态较一致,分布较均匀,线粒体嵴的排列规则有序。缺血再灌注损伤后,线粒体肿胀明显,嵴紊乱、短小,甚至断裂溶解。姜黄素预处理减轻了缺血再灌注对线粒体的损伤,线粒体嵴的减少较I/R组轻(图2)。
2.3 姜黄素对皮质梗死区UCP2和TFAM蛋白表达的影响 免疫组化染色显示,假手术组、I/R组、低剂量组和高剂量组的UCP2蛋白光密度值分别为0.01576±0.00021、0.00333±0.00016、0.00880±0.00032、0.01267±0.00018,TFAM蛋白光密度值分别为0.00642±0.00047、0.00215±0.00027、0.00237±0.00029、0.00295±0.00023。
由图3可见,假手术组中由右侧大脑中动脉供血的皮质区神经元内UCP2阳性产物表达丰富,呈深棕色,而I/R组中UCP2的表达显著下降(P<0.05),细胞形态也发生了变化。在相应区域内,高、低剂量组神经元内UCP2的表达较I/R组明显增多(P<0.05),且以高剂量组更为显著(P<0.05)。假手术组中相应皮质区可见大量TFAM阳性产物,缺血再灌注后TFAM表达下降(P<0.05)。与I/R组相比,高剂量组TFAM阳性表达显著增加(P<0.05),但低剂量组的表达量未见明显增加。
2.4 姜黄素对皮质梗死区UCP2和TFAM mRNA表达的影响 假手术组、缺血再灌注组、低剂量组和高剂量组的UCP2 mRNA相对表达量分别为0.14288±0.01445、0.10488±0.00564、0.16268±0.00990、0.21475±0.01401,TFAM mRNA相对表达量分别为0.40364±0.01607、0.18951±0.01176、0.20870±0.01902、0.29472±0.02307。
由图4可见,与假手术组比较,I/R组由大脑中动脉供血的皮质区中UCP2和TFAM mRNA表达显著降低(P<0.05)。高、低剂量组UCP2 mRNA表达水平均高于I/R组(P<0.05),且高剂量组升高更明显(P<0.05);但TFAM mRNA仅在高剂量组中较I/R组增高(P<0.05),低剂量组与I/R组比较无显著差异。

图3 姜黄素对皮质梗死区UCP2和TFAM表达的影响(SP ×400)Fig. 3 Effect of curcumin on the expressions of UCP2 and TFAM in infarcted cortex (SP ×400)

图4 姜黄素对皮质梗死区UCP2和TFAM的mRNA表达水平的影响Fig. 4 Effect of curcumin on the expression of mRNA of UCP2 and TFAM in infarcted cortex M. Marker; 1. Sham group; 2. I/R group; 3. Curcumin 50mg/kg group; 4. Curcumin 100mg/kg group
3 讨 论
姜黄素是从植物姜黄根茎中提取的一种可食用的多元酚,研究已证实其对脑血管疾病、神经中毒性疾病以及阿尔茨海默病、帕金森病、亨廷顿舞蹈症等多种神经变性疾病均有治疗效果[14],本实验旨在探讨其对急性缺血性脑损伤的保护机制。Yang等[15]认为姜黄素在脑缺血再灌注损伤后通过上调抗氧化基因上游因子Nrf2发挥保护作用。Nrf2可进一步促进HO-1转录。HO-1是二期酶(phase Ⅱ enzymes)中的一种,可诱导血红素降解,生成强效抗氧化分子胆红素[15],可与其他几种二期酶(如谷胱甘肽S-转移酶和NADPH)一起在体内形成强大的氧化应激防御系统。此外有研究认为,姜黄素可通过增加保护性蛋白Bcl-2表达,抑制下游分子细胞色素C的释放及Caspase3的活化,从而抑制细胞凋亡[16-17]。除了抗氧化效应,还有部分学者认为姜黄素可通过降低缺血再灌注后NF-κB和ICAM-1的表达减轻炎症反应,从而减轻脑损伤[18]。本实验也观察到姜黄素预处理明显减轻了皮质梗死区神经元的损伤,证实了既往研究提出的姜黄素对缺血再灌注脑损伤有保护作用这一结论[13]。
本研究还观察到姜黄素对神经元亚细胞器存在一定影响,如再灌注后肿胀的线粒体内嵴排列紊乱、变短甚至溶解,而一定剂量姜黄素预处理可减轻缺血再灌注对线粒体的损伤。线粒体嵴的数量与细胞呼吸功能有关,姜黄素可能通过保护神经元线粒体来抵抗缺血所致的呼吸功能下降,从而保护神经元。另外,本研究还发现姜黄素能上调与线粒体关系密切的UCP2和TFAM蛋白的表达,并且与剂量相关,提示UCP2和TFAM可能是姜黄素发挥脑保护效应的靶点。
UCP2是UCP家族中在大脑有广泛分布的蛋白之一,是一种线粒体内膜蛋白,主要表达于细胞质。有学者认为UCP2对脑缺血性损伤的保护作用与前炎症因子的抑制和细胞保护因子的激活有关[19]。UCP2过表达能在一定程度上抵消缺血诱导的IL-6增加和Bcl-2减少[20],还能增加细胞周期基因以及p-AKT、PKC和MEK蛋白的表达[19]。除此以外,UCP2还可能通过其他途径来
改善缺血性脑损伤。既然UCP2是一种线粒体内膜蛋白,我们有理由推测它可能通过改善线粒体功能而发挥保护效应。UCP2蛋白本身具有抑制线粒体活性氧生成[6]、降低线粒体电势差[10]、限制线粒体内Ca2+负荷[5]等作用。Andrews等[21]还报道胃促生长素可增加野生型小鼠含神经肽Y的神经元核周体内的线粒体数量,而UCP2基因敲除小鼠的线粒体数量没有增加,提示UCP2很可能有另一种鲜为人知的功能,即调控线粒体生物合成。
TFAM是反映线粒体生物合成功能的一个重要指标[22-23],其对缺血性损伤的保护作用已有学者报道,如Ikeuchi等[24]认为心肌缺血后过表达的TFAM可抑制mtDNA拷贝数的减少,维持线粒体呼吸链功能,从而抵抗心肌氧化应激损伤。类似的保护作用在脑缺血中也有报道,如Hokari等[4]发现野生型小鼠在脑缺血再灌注后出现大量受损神经元,细胞呈三角形,核周质固缩,并伴随神经纤维空泡变性,而TFAM超表达的转基因小鼠脑内的这种受损神经元明显减少。本实验结果显示,姜黄素预处理明显增加了大鼠皮质梗死区TFAM阳性产物的表达,且与神经元尼氏体丢失位于相同区域,提示TFAM的增加可能对缺血再灌注脑损伤起到了保护作用。
综上,UCP2与TFAM之间可能存在一定的相互调节关系,且本研究显示UCP2蛋白与TFAM蛋白在各处理组中的变化趋势一致,也证实了这一点,但具体机制尚需进一步研究证实。
[1] Chen SD, Yang DI, Lin TK, et al. Roles of oxidative stress,apoptosis, pgc-1α and mitochondrial biogenesis in cerebral ischemia[J]. Int J Mol Sci, 2011, 12(10): 7199-7215.
[2] Soane L, Kahraman S, Kristian T, et al. Mechanisms of impaired mitochondrial energy metabolism in acute and chronic neurodegenerative disorders[J]. J Neurosci Res, 2007, 85(15):3407-3415.
[3] Yin W, Signore AP, Iwai M, et al. Rapidly increased neuronal mitochondrial biogenesis after hypoxic-ischemic brain injury[J].Stroke, 2008, 39(11): 3057-3063.
[4] Hokari M, Kuroda S, Kinugawa S, et al. Overexpression of mitochondrial transcription factor A (TFAM) ameliorates delayed neuronal death due to transient forebrain ischemia in mice[J]. Neuropathology, 2010, 30(4): 401-407.
[5] Horvath TL, Diano S, Barnstable C. Mitochondrial uncoupling protein 2 in the central nervous system: neuromodulator and neuroprotector[J]. Biochem Pharmacol, 2003, 65(12): 1917-1921.
[6] Mehta SL, Li PA. Neuroprotective role of mitochondrial uncoupling protein 2 in cerebral stroke[J]. J Cereb Blood Flow Metab, 2009, 29(6): 1069-1078.
[7] Mattiasson G, Shamloo M, Gido G, et al. Uncoupling protein-2 prevents neuronal death and diminishes brain dysfunction after stroke and brain trauma[J]. Nat Med, 2003, 9(8): 1062-1068.
[8] Darvesh AS, Carroll RT, Bishayee A, et al. Curcumin and neurodegenerative diseases: a perspective[J]. Expert Opin Investig Drugs, 2012, 21(8): 1123-1140.
[9] Cheng Y, Ping J, Xu LM, et al. Curcumin inhibits the activation marker of hepatic stellate cells by up-regulating the peroxisome proliferator-activated receptorγ[J]. Chin J Pract Intern Med,2006, 26(24): 1937-1940.[成扬, 平键, 徐列明, 等. 姜黄素上调PPARγ抑制肝星状细胞活化标志表达的研究[J]. 中国实用内科杂志, 2006, 26(24): 1937-1940.]
[10] Zang WZ, Yang HQ, Xu J, et al. Effects of curcumin on PC12 cells impaired by mimic ischemia and reperfusion[J]. J Zhengzhou Univ (Med Sci), 2009, 43(3): 594-596.[臧卫周, 杨红旗, 徐军, 等. 姜黄素对缺氧复氧损伤PC12细胞的影响[J].郑州大学学报(医学版), 2009, 43(3): 594-596.
[11] Tang N, Zhang J, Du YP. Curcumin promoted the apoptosis of cisplain-resistant human lung carcinoma cells A549/DDP through down-regulating miR-186~*[J]. Chin J Lung Cancer,2010, 13(4): 301-306. [唐妮, 张艰, 杜永平. 姜黄素通过下调miR-186~*促进人肺腺癌细胞A549/DDP凋亡[J]. 中国肺癌杂志, 2010, 13(4): 301-306.]
[12] Wang GZ, Yang HN, Wu WH, et al. The effect of Curcumin on the growth and apoptosis of human cholangiocarcinoma cell line QBC939[J]. Acta Acad Med CPAF, 2003, 12(2): 93-96.[王光哲, 杨海宁, 武文红, 等. 姜黄素对人QBC939细胞生长抑制与凋亡的影响[J]. 武警医学院学报, 2003, 12(2): 93-96.]
[13] Shukla PK, Khanna VK, Ali MM, et al. Anti-ischemic effect of curcumin in rat brain[J]. Neurochem Res, 2008, 33(6): 1036-1043.
[14] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stoke,1989, 20(1): 84-91.
[15] Yang C, Zhang X, Fan H, et al. Curcumin upregulates transcription factor Nrf2, HO-1 expression and protects rat brains against focal ischemia[J]. Brain Res, 2009, 1282: 133-141.
[16] Zhao J, Yu S, Zheng W, et al . Curcumin improves outcomes and attenuates focal cerebral ischemic injury via antiapoptotic mechanisms in rats[J]. Neurochem Res, 2009, 35(3): 374-379.
[17] Feng X, Li Y, Wang XY. Effect of JAK/STAT pathway on renal ischemia-reperfusion injury in rats[J]. Med J Chin PLA, 2011,36(3): 218-220. [冯欣, 李垚, 王雪鹰. JAK/STAT通路在大鼠肾脏缺血再灌注损伤中的作用[J]. 解放军医学杂志, 2011,36(3): 218-220.]
[18] Zhuang R, Lin MX, Song QY, et al. Effects of curcumin on the expression of nuclear factor-kappaB and intercellular adhesion molecular 1 in rats with cerebral ischemia-reperfusion injury[J].Nan Fang Yi Ke Da Xue Xue Bao, 2009, 9(6): 1153-1155.
[19] Haines B, Li PA. Overexpression of mitochondrial uncoupling protein 2 inhibits inflammatory cytokines and activates cell survival factors after cerebral ischemia[J]. PLoS ONE, 2012,7(2): e31739.
[20] Lai XF, Ma KH, Qing CC, et al. Comparison of protective effect on ischemia-reperfusion myocardium between IGF-1 and ischemic postconditioning[J]. Med J Chin PLA, 2011, 36(8):808-812. [赖晓峰, 马康华, 秦春常, 等. IGF-1后处理与缺血后处理对缺血再灌注心肌保护作用的对比研究[J]. 解放军医学杂志, 2011, 36(8): 808-812.]
[21] Andrews ZB, Liu ZW, Walllingford N, et al. UCP2 mediates ghrelin's action on NPY/AgRP neurons by lowering free radicals[J]. Nature, 2008, 454(7206): 846-851.
[22] Larsson NG, Wang J, Wilhelmsson H, et al. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice[J]. Nat Genet, 1998, 18(3): 231-236.
[23] Scarpulla RC. Transcriptional paradigms in mammalian mitochondrial biogenesis and function[J]. Physiol Rev, 2008,88(2): 611-638.
[24] Ikeuchi M, Matsusaka H, Kang D, et al. Overexpression of mitochondrial transcription factor a ameliorates mitochondrial deficiencies and cardiac failure after myocardial infarction[J].Circulation, 2005, 112(5): 683-690.

