强噪声暴露后不同持续时间中等水平噪声暴露对豚鼠听力的保护作用研究
王晓花,章建程,王艳军,周宏元,徐灵活,胡家庆
近年来,随着舰船武器装备的发展,舰船吨位、航速以及动力装置马力的不断提高,舰船噪声污染日趋严重,成为舰艇舱室的主要环境有害因素。噪声对艇员的影响日益受到关注,成为航海医学研究的重要课题之一。研究证明,采用适宜参数的前噪声暴露,可对其后强噪声暴露引起的听力损失产生保护作用[1],可能机制为噪声前暴露可减少其后强噪声暴露引起的毛细胞缺失。畸变产物耳声发射(DPOAE)检测,具有频率特性客观、快速、无创等优点,是听力筛选及早期耳蜗功能改变检测的有效方法。氧化损伤作为噪声性听觉损伤的主要机制之一已得到大量研究证实,本研究观察强噪声暴露后,不同声环境条件下豚鼠DPOAE幅值的变化及总一氧化氮合酶(TNOS)活力,探讨强噪声暴露后不同声环境对豚鼠噪声性听觉损伤恢复的影响。
1 材料与方法
1.1 实验动物 30只雄性健康白化种红目豚鼠(海军医学研究所实验动物中心提供),耳廓反应灵敏,体重280~320g,鼠龄4个月。豚鼠饲养于海军医学研究所实验动物中心,自由饮水摄食,饲养环境温度22±3℃,环境噪声<50dB。
1.2 分组及噪声暴露 豚鼠随机均分为5组,每组6只:A组[110 decibels sound pressure level(dB SPL)白噪声4h后继续84dB SPL噪声暴露4h];B组(110dB SPL白噪声4h后继续84dB SPL噪声暴露8h);C组(110dB SPL白噪声4h后继续84dB SPL噪声暴露24h);D组(仅110dB SPL白噪声4h);E组(空白对照组,无噪声暴露)。噪声暴露在专门的噪声暴露室内进行,豚鼠单笼放置。声源采用Sine Random Generator(型号1207,丹麦BK公司),功率放大器采用Power amplifier(型号FJG500-1c)。暴露室中央和四角噪声水平均匀(±1dB)。
1.3 DPOAE测试 DPOAE测试仪器为美国IHS系统,豚鼠用1%戊巴比妥钠38mg/kg腹腔注射麻醉。A、B、C和D组豚鼠分别在噪声暴露前1d进行第1次DPOAE测定,噪声暴露停止后1d进行第2次DPOAE测定,噪声暴露停止后7d进行第3次DPOAE测定;E组豚鼠在相应时间点行DPOAE测试。测试参数设置:L1=L2=65dB SPL,f2/f1=1.22。DPOAE听力图取455、641、905、1281、1810、2563、3619、5121、7243共9个频率点进行测试,数据分析以频率f1为准。
1.4 血生化指标测定 豚鼠上述指标测试完毕后,即刻取血分离约0.5ml血浆样品冻存。利用超氧化物歧化酶(SOD)、丙二醛(MDA)和一氧化氮合酶(NOS)等相应试剂盒测试SOD活力、MDA含量和NOS活力。
1.5 统计学处理 各组指标数据以Excel建库,采用SPSS 13.0软件进行统计分析,组间比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
表1 噪声暴露前1d 5组9个频率点DPOAE幅值(±s, n=6)Tab.1 DPOAE amplitudes of 9 frequency points 1 day before noise exposure in 5 groups ±s, n=6)

表1 噪声暴露前1d 5组9个频率点DPOAE幅值(±s, n=6)Tab.1 DPOAE amplitudes of 9 frequency points 1 day before noise exposure in 5 groups ±s, n=6)
Group Frequency points(Hz)455 641 905 1281 1810 2563 3619 5121 7243 A 3.67±4.32 0.33±6.92 4.83±9.97 10.00±9.57 3.67±9.61 1.17±6.65 –4.83±5.83 3.00±10.26 16.17±15.55 B –5.00±6.40 –11.4±15.1 0.40±10.92 2.00±11.77 6.20±9.04 1.40±10.74 –2.60±12.50 6.80±14.29 20.40±8.79 C 2.50±6.09 4.17±5.19 8.17±8.98 6.67±12.16 1.50±11.95 –1.83±10.36 –5.83±12.11 6.83±12.54 22.00±9.67 D –4.67±10.7 0.00±10.79 4.17±5.19 7.17±14.55 2.50±11.78 –2.33±10.52 –2.17±9.60 5.16±13.82 20.17±14.80 E –2.50±7.61 –2.0±12.13 7.00±9.96 10.83±5.11 8.17±6.58 1.33±4.63 –3.00±8.83 5.83±11.94 25.17±6.65
2 结 果
2.1 噪声暴露前1d各组豚鼠DPOAE幅值变化 噪声暴露前1d,5组豚鼠9个频率点的DPOAE幅值间差异无统计学意义(表1)。
2.2 噪声暴露后1d各组豚鼠DPOAE幅值变化 噪声暴露后1d,与E组相比,D组1281、2563、3619、5121和7243Hz频率点的DPOAE幅值降低(P<0.05),表明豚鼠听力受损;C组与D组相比,差异无统计学意义(P>0.05),表明84dB、24h噪声环境对强噪声暴露后的听力损害无保护作用。与D组相比,A组1810Hz频率点DPOAE幅值升高(P<0.05),而在其他频率点,A组DPOAE幅值仅有升高趋势,但差异无统计学意义,表明A组中强噪声暴露后的声环境对听力损失的恢复可能有一定的促进作用。与D组相比,B组1810、5121Hz频率点DPOAE幅值升高(P<0.05),而在其他频率点,B组DPOAE幅值仅有升高趋势,但差异无统计学意义,说明B组中强噪声暴露后的声环境对听力损失的恢复也可能有一定促进作用(表2)。
2.3 噪声暴露后7d各组豚鼠DPOAE幅值变化 噪声暴露后7d,与E组相比,D组1281、1810Hz频率点DPOAE幅值升高(P<0.05),5121、7243Hz频率点DPOAE幅值降低(P<0.05),表明噪声暴露7d后,低频听力有部分恢复,高频听力损失仍然存在。而C组与D组相比差异无统计学意义(P>0.05),表明C组中强噪声暴露后的声环境无保护作用。与D组相比,A组5121Hz频率点DPOAE幅值升高(P<0.05),而在641、1281、2563、3619、5121、7243Hz频率点,DPOAE幅值仅有升高趋势,但差异无统计学意义。与D组相比,B组5121Hz频率点DPOAE幅值升高(P<0.05),而在455、641、905、2563、3619、5121、7243Hz频率点,DPOAE幅值仅有升高趋势,但差异无统计学意义,表明噪声暴露7d后,A、B组中强噪声暴露后的声环境对豚鼠听力损失尤其对高频部分的听力损失仍然有一定的保护作用(表3)。
表2 噪声暴露后1d 5组9个频率点的DPOAE幅值(±s, n=6)Tab.2 DPOAE amplitudes of 9 frequency points 1 day after noise exposure in 5 groups (±s, n=6)
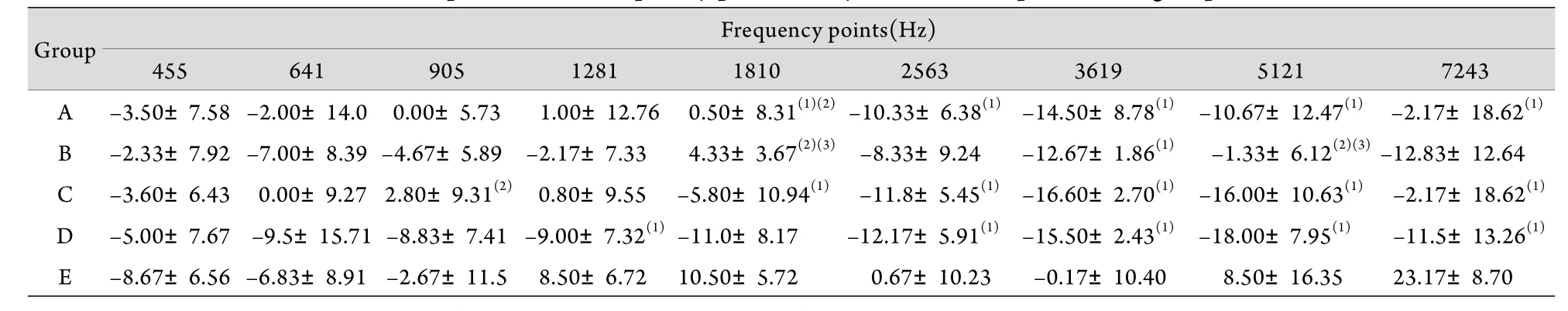
表2 噪声暴露后1d 5组9个频率点的DPOAE幅值(±s, n=6)Tab.2 DPOAE amplitudes of 9 frequency points 1 day after noise exposure in 5 groups (±s, n=6)
(1)P<0.05 compared with group E; (2)P<0.05 compared with group D; (3)P<0.05 compared with group C
Group Frequency points(Hz)455 641 905 1281 1810 2563 3619 5121 7243 A –3.50±7.58 –2.00±14.0 0.00±5.73 1.00±12.76 0.50±8.31(1)(2) –10.33±6.38(1) –14.50±8.78(1) –10.67±12.47(1) –2.17±18.62(1)B –2.33±7.92 –7.00±8.39 –4.67±5.89 –2.17±7.33 4.33±3.67(2)(3) –8.33±9.24 –12.67±1.86(1) –1.33±6.12(2)(3)–12.83±12.64 C –3.60±6.43 0.00±9.27 2.80±9.31(2) 0.80±9.55 –5.80±10.94(1) –11.8±5.45(1) –16.60±2.70(1) –16.00±10.63(1) –2.17±18.62(1)D –5.00±7.67 –9.5±15.71 –8.83±7.41 –9.00±7.32(1)–11.0±8.17 –12.17±5.91(1) –15.50±2.43(1) –18.00±7.95(1) –11.5±13.26(1)E –8.67±6.56 –6.83±8.91 –2.67±11.5 8.50±6.72 10.50±5.72 0.67±10.23 –0.17±10.40 8.50±16.35 23.17±8.70
2.4 各组豚鼠血浆SOD活力、MDA含量和NOS活力的测定 噪声暴露后7d,与E组相比,A、B两组SOD活力降低(P<0.05),MDA含量增加(P<0.05)。与D组相比,A、B两组MDA含量增加(P<0.05),C组TNOS活力降低(P<0.05)。与C组相比,A、B两组MDA含量增加(P<0.05,表4)。
表3 噪声暴露后7d各组9个频率点的DPOAE幅值(±s, n=6)Tab.3 DPOAE amplitudes of 9 frequency points 7 days after noise exposure in 5 groups (±s, n=6)
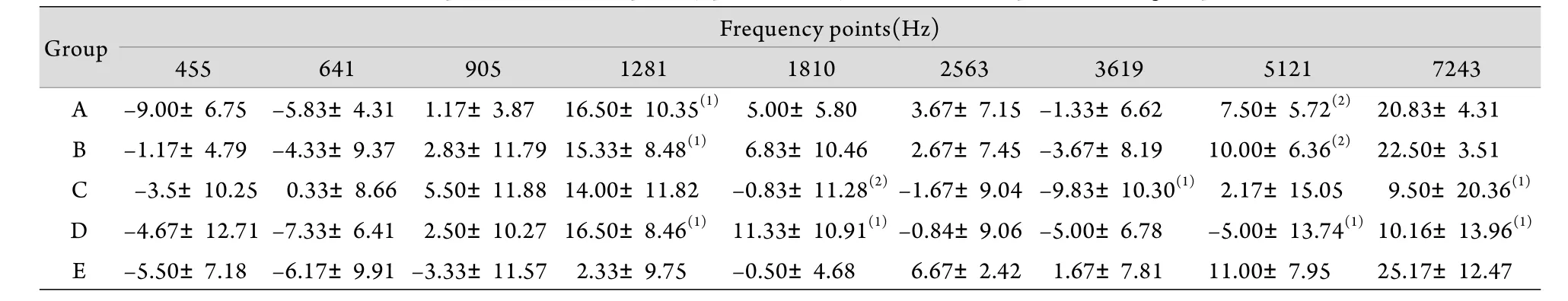
表3 噪声暴露后7d各组9个频率点的DPOAE幅值(±s, n=6)Tab.3 DPOAE amplitudes of 9 frequency points 7 days after noise exposure in 5 groups (±s, n=6)
(1)P<0.05 compared with group E; (2)P<0.05 compared with group D
Group Frequency points(Hz)455 641 905 1281 1810 2563 3619 5121 7243 A –9.00±6.75 –5.83±4.31 1.17±3.87 16.50±10.35(1) 5.00±5.80 3.67±7.15 –1.33±6.62 7.50±5.72(2) 20.83±4.31 B –1.17±4.79 –4.33±9.37 2.83±11.7915.33±8.48(1) 6.83±10.46 2.67±7.45 –3.67±8.19 10.00±6.36(2) 22.50±3.51 C –3.5±10.25 0.33±8.66 5.50±11.8814.00±11.82 –0.83±11.28(2)–1.67±9.04 –9.83±10.30(1) 2.17±15.05 9.50±20.36(1)D –4.67±12.71 –7.33±6.41 2.50±10.2716.50±8.46(1) 11.33±10.91(1)–0.84±9.06 –5.00±6.78 –5.00±13.74(1)10.16±13.96(1)E –5.50±7.18 –6.17±9.91 –3.33±11.57 2.33±9.75 –0.50±4.68 6.67±2.42 1.67±7.81 11.00±7.95 25.17±12.47
表4 噪声暴露后7d各组豚鼠SOD活力、MDA含量和NOS活力变化(x±s, n=6)Tab.4 Variance of the activity of SOD, TNOS and the content of MDA in five groups 7 days after noise exposure (±s, n=6)
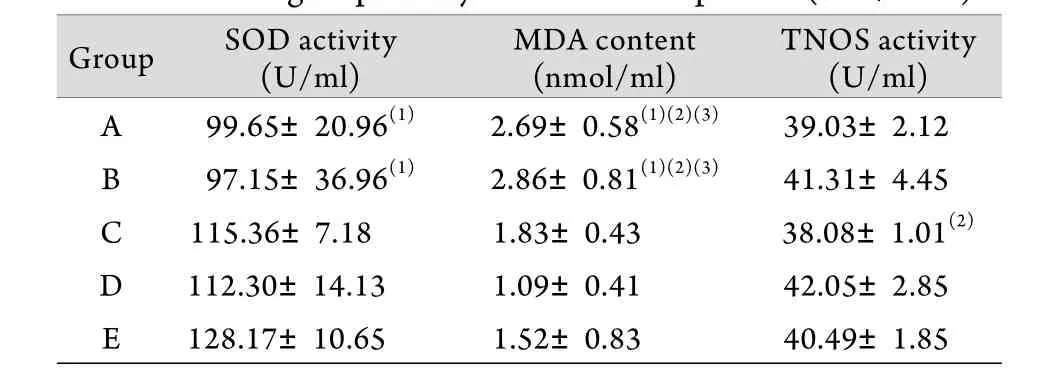
表4 噪声暴露后7d各组豚鼠SOD活力、MDA含量和NOS活力变化(x±s, n=6)Tab.4 Variance of the activity of SOD, TNOS and the content of MDA in five groups 7 days after noise exposure (±s, n=6)
(1)P<0.05 compared with group E; (2)P<0.05 compared with group D; (3)P<0.05 compared with group C
TNOS activity(U/ml)A 99.65±20.96(1) 2.69±0.58(1)(2)(3) 39.03±2.12 B 97.15±36.96(1) 2.86±0.81(1)(2)(3) 41.31±4.45 C 115.36±7.18 1.83±0.43 38.08±1.01(2)D 112.30±14.13 1.09±0.41 42.05±2.85 E 128.17±10.65 1.52±0.83 40.49±1.85 Group SOD activity(U/ml)MDA content(nmol/ml)
3 讨 论
DPOAE是由固定频率比和强度差的两个纯音fl、f2诱发耳蜗产生,在基底膜上,f1和f2的特性频率定位区之间会产生一系列调制声,f1-f2处DPOAE起源于基底膜上两个原始音f1、f2之间,此处幅值最大[2]。Rosanowski等[3]研究证明,中等强度噪声或外伤首先损伤外毛细胞,内毛细胞、支持细胞只在剧烈或长期损伤时才受累,而内毛细胞主要司声音传导,外毛细胞主要与听敏度有关[4]。因此纯音测听、听觉脑干反应(ABR)等检测声音传导的方法在损伤初始阶段结果正常,而耳声发射反映外毛细胞功能状态,可以表现为相应频率的异常,因而DPOAE被认为是一个检测早期听力损失的敏感指标。
近年来有研究表明,强噪声暴露后,与隔绝噪声环境相比,低强度噪声刺激对噪声性听觉损伤有保护作用,可能机制为强噪声暴露后,低强度噪声环境对听神经纤维轴突和毛细胞静纤毛的再生、耳蜗微循环的改善、神经生长因子的释放及耳蜗抗氧化能力的提高,有一定促进作用[5-6]。本研究结果显示,强噪声暴露后,84dB、4h和84dB、8h的声环境对强噪声暴露所致的听力损失恢复有一定促进作用,暴露后7d,保护作用仍然存在,尤其是高频听力损失;84dB、24h的噪声环境对强噪声暴露所致的听力损失没有保护作用。
研究显示,噪声刺激会影响耳蜗局部组织的有氧代谢,引起能量代谢超负荷、ATP耗竭,并产生氧自由基,从而对耳蜗产生毒性作用[7]。氧自由基生成增加的同时,会激活机体的防护体系,使抗氧化物质增多[8]。NOS在耳蜗局部和听觉系统低级中枢核团均有分布[9]。噪声刺激后,耳蜗内血管收缩,血流减慢,局部低氧分压、缺血会诱导NOS mRNA表达增强,产生具有直接细胞毒性的较高浓度的NO[10]。本研究拟从氧自由基反应及NO损伤的角度,探讨这一现象发生的机制,但结果并未证实其相关性,具体机制有待于进一步研究。
本实验中,我们观察到强噪声暴露后再处于中等水平噪声条件下,过氧化反应损伤仍在进行,过氧化产物的产生超过了机体的清除能力,抗氧化能力在噪声暴露早期代偿性升高后又出现降低。本实验中血浆TNOS无明显变化,可能是因为耳蜗是噪声直接作用的特异性靶器官,噪声暴露后起主要作用的是豚鼠耳蜗NOS神经元及其活力,血浆中TNOS的变化不显著[11]。
综上所述,本研究初步明确了强噪声暴露后不同持续时间中等水平噪声暴露对豚鼠听力的保护作用,研究结果可能对制定新的噪声防护综合措施具有一定的参考价值。
[1] Zuo H, Cui B, She X, et al. Changes in Guinea pig cochlea hair cells after sound conditioning and noise exposure[J]. J Occup Health, 2008, 50(5): 373-379.
[2] Davis B, Qiu W, Hamernik RP. The use of distortion product otoacoustic emissions in the estimation of hearing and sensory cell loss in noise-damaged cochleas[J]. Hear Res, 2004,187(1/2): 12-24.
[3] Rosanowski F, Eysholdt U, Hoppe U. Influence of leisure-time noise on outer hair cell activity in medical students[J]. Int Arch Occup Environ Health, 2006, 80(1): 25-31.
[4] Cheng H, Li H, Xu YP, et al. Effects of noise on pilots health[J].Med J Chin PLA, 2010, 35(10): 1261-1263. [程浩, 李宏, 徐怡萍, 等. 噪声对飞行人员健康的影响[J]. 解放军医学杂志,2010, 35(10): 1261-1263. ]
[5] Tanaka C, Chen GD, Hu BH, et al. The effects of acoustic environment after traumatic noise exposure on hearing and outer hair cells[J]. Hear Res, 2009, 250(1/2): 10-18.
[6] Hong BN, Kim SY, Yi TH, et al. Post-exposure treatment with ginsenoside compound K ameliorates auditory functional injury associated with noise-induced hearing loss in mice[J]. Neurosci Lett, 2011, 487(2): 217-222.
[7] Tian CS, Wang S, Sun F, et al. Changes of serum antioxidant enzyme activities after sound conditioning[J]. Chin Occup Med,2004, 31(2): 16-19. [田传胜, 王生, 孙菲, 等. 噪声适应性暴露对人体血清中抗氧化酶活性的影响[J]. 中国职业医学,2004, 31(2): 16-19.]
[8] Zelko IN, Mariani TJ, Folz RJ, et al. Superoxide dismutase multigene family: a comparion of the CuZn-SOD(SOD1), Mn-SOD(SOD2), and EC-SOD(SOD3) gene structures, evolution,and expression[J]. Free Radical Biol Med, 2002, 33(3): 337-349.[9] He QL, Xiong M, Li YY, et al. Expression of inducible nitric oxide synthase in cochlea of white and pigmented guinea pigs exposed to impulsive noise[J]. J Guangzhou Univ Trad Chin Med, 2010, 27(1): 87-91. [何青莲, 熊敏, 李云英, 等. 诱生型一氧化氮合酶在白色和杂色豚鼠脉冲噪声损伤耳蜗中的表达[J]. 广州中医药大学学报, 2010, 27(1): 87-91.]
[10] Domenico R. Pharmacology of nitric oxide:molecular mechanisms and therapeutic strategies[J]. Curt Pharm Des,2004, 10(14): 1667-1676.
[11] Wang XH, Xu LH, Wang YJ, et al. Effects of narrow-band noise exposure on nitric-oxide synthase and nitric oxide in the plasma of guinea pigs[J]. J Navy Med, 2011, 32(5): 299-301. [王晓花, 徐灵活, 王艳军, 等. 窄带噪声暴露对豚鼠血浆一氧化氮合酶活性和一氧化氮含量的影响[J]. 海军医学杂志, 2011,32(5): 299-301.]

