脂质体阿霉素和热疗对脑胶质瘤细胞的影响
史正华,张剑宁
脂质体阿霉素和热疗对脑胶质瘤细胞的影响
史正华,张剑宁
目的探讨脂质体阿霉素和热疗对脑胶质瘤细胞的增殖抑制及凋亡诱导作用。方法体外培养人脑胶质瘤细胞SWO-38,采用水浴加温法,观察单纯热疗、阿霉素化疗、脂质体阿霉素化疗、热疗+阿霉素化疗、热疗+脂质体阿霉素化疗对细胞增殖及凋亡的影响。MTT法确定阿霉素和脂质体阿霉素的工作浓度并检测细胞增殖情况,流式细胞术检测细胞凋亡情况。结果热疗+脂质体阿霉素化疗组、热疗+阿霉素化疗组的增殖抑制率分别为80.16%±3.78%、62.09%±3.05%,均显著高于脂质体阿霉素化疗组(40.27%±2.32%)、阿霉素化疗组(30.56%±2.03%)、单纯热疗组(16.51%±1.26%),差异有统计学意义(P<0.05),且热疗+脂质体阿霉素化疗组的增殖抑制率显著高于热疗+阿霉素化疗组(P<0.05)。热疗+脂质体阿霉素化疗组、热疗+阿霉素化疗组的细胞凋亡率分别为84.19%±2.69%、60.29%±1.47%,均显著高于脂质体阿霉素化疗组(46.72%±2.09%)、阿霉素化疗组(35.09%±1.46%)、单纯热疗组(17.85%±0.78%),差异有统计学意义(P<0.05),且热疗+脂质体阿霉素化疗组的细胞凋亡率显著高于热疗+阿霉素化疗组(P<0.05)。结论加热可增强阿霉素及脂质体阿霉素对人脑胶质瘤细胞SWO-38的增殖抑制和凋亡诱导作用,且对脂质体阿霉素的增敏作用更强。
多柔比星;热化疗;细胞增殖;细胞凋亡
脑胶质瘤是中枢神经系统常见的原发肿瘤,国内资料统计占颅内原发肿瘤的35.26%~60.96%,平均约为44.69%[1-2]。化疗能延长部分胶质瘤患者的生存期,但效果欠佳。即使是相同病理类型和级别的胶质瘤患者,治疗效果仍存在很大差异,治疗方法的不同无疑是重要影响因素,但肿瘤内在的生物学特性,特别是分子水平的差异应该是关键所在[1,3,4]。另外,血-脑脊液屏障的存在,也使脑胶质瘤化疗效果受到明显影响。肿瘤热疗是继手术、放疗、化疗、生物治疗之后的一种新的肿瘤治疗方法[5]。脂质体(liposome)多用做运载药物的载体[6],但普通脂质体进入体内后可被网状内皮系统所捕获,在血循环中存在的时间较短,因而不易到达肿瘤区域,使其应用受到一定限制[7]。热敏脂质体(thermosensitive liposomes,TSL)是在脂质体膜中加入一种热敏性磷脂,在达到一定温度时,脂质体膜的状态发生改变,导致其通透性增加,使药物大量释放[8],从而可明显提高肿瘤组织内的药物浓度。本研究观察热疗及脂质体阿霉素对脑胶质瘤细胞SWO-38的杀伤作用,并进一步探讨其对SWO-38细胞增殖及凋亡的影响。
1 材料与方法
1.1 主要试剂 注射用盐酸阿霉素(adriamycin,ADM)、脂质体阿霉素(liposomes-adriamycin,L-ADM)购自辉瑞制药有限公司。Annexin V-FITC/PI凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2 细胞培养及分组 人脑胶质瘤SWO-38细胞培养于含10%胎牛血清的RPMI 1640培养基,将培养瓶置于37℃、5%CO2、饱和湿度培养箱培养,每3~5d传代1次,取对数生长期细胞进行实验。细胞分为对照组、单纯热疗组、阿霉素化疗组、脂质体阿霉素化疗组、热疗+阿霉素化疗组、热疗+脂质体阿霉素化疗组,其中热疗时采用电热恒温水浴箱加热,加热温度43℃,波动≤±0.1℃。
1.3 药物工作浓度的确定 取生长状态良好的对数生长期SWO-38细胞,用含10%胎牛血清的培养液调整细胞密度为5×104/ml,接种于50ml的培养瓶中,将细胞分为对照组、单纯热疗组、阿霉素化疗组、脂质体阿霉素化疗组、热疗+阿霉素化疗组、热疗+脂质体阿霉素化疗组,每组6个复孔,阿霉素及脂质体阿霉素浓度均分别设为0、2、4、6、8、10、12、14、16mg/L。对照组及化疗组放在培养箱中继续培养,热疗组及热疗+化疗组即刻放入电热恒温水浴箱中加热相同时间(43℃ 1h),然后放回培养箱中继续培养24h,以MTT法测定细胞增殖抑制率,以24h时间点的IC50作为实验的工作浓度。
1.4 MTT法测定细胞增殖情况 取对数生长期的细胞,常规消化制成单细胞悬液,调整细胞密度为2.5×105/ml,接种于96孔培养板,每孔200μl, 37℃、5%CO2培养箱中培养24h,待细胞贴壁后,按1.3所述处理细胞(每组设6个复孔),每孔加入5g/L MTT 20μl,继续培养4h,取出培养板,弃去MTT液,每孔加入150μl DMSO,微量振荡器上震荡10min,然后将培养板置于全自动酶标仪上,在492nm波长处测定各孔的吸光度(A)值,计算细胞增殖抑制率。实验重复3次。细胞增殖抑制率(%)=(对照组A值一实验组A值)/对照组A值×100%。
1.5 流式细胞仪检测细胞凋亡情况 每组收集5×105个细胞,用含2%牛血清白蛋白的PBS溶液洗涤2次,分别加入FITC标记的Annexin V和PI(操作按说明书进行),避光放置1h,流式细胞仪检测,每次读取104个细胞。采用Cell Quest软件进行数据分析,计算细胞凋亡率。
2 结 果
2.1 阿霉素及脂质体阿霉素工作浓度的确定 从图1中可以看出,在相同浓度下,脂质体阿霉素对脑胶质瘤细胞的增殖抑制作用强于阿霉素。阿霉素IC50=8mg/L,脂质体阿霉素IC50=4mg/L,将其分别作为阿霉素及脂质体阿霉素的工作浓度。
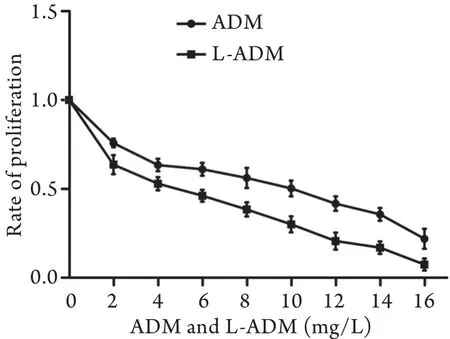
图1 不同浓度阿霉素、脂质体阿霉素对SWO-38细胞增殖率的影响Fig.1 Influence of different concentration of ADM and L-ADM on proliferation of SWO-38 cells
2.2 各组细胞增殖抑制率比较 SWO-38细胞经单纯热疗、阿霉素化疗、脂质体阿霉素化疗、热疗+阿霉素化疗、热疗+脂质体阿霉素化疗后,其增殖抑制率分别为16.51%±1.26%、30.56%±2.03%、40.27%±2.32%、62.09%±3.05%、80.16%±3.78%。统计学分析显示,热疗+阿霉素化疗组、热疗+脂质体阿霉素化疗组、阿霉素化疗组、脂质体阿霉素化疗组的细胞增殖抑制率均明显高于对照组(0%,P<0.05),且其余各组间比较差异均具有统计学意义(P<0.05)。
2.3 各组细胞凋亡率比较 SWO-38细胞经单纯热疗、阿霉素化疗、脂质体阿霉素化疗、热疗+阿霉素化疗、热疗+脂质体阿霉素化疗后,其细胞凋亡率分别为17.85%±0.78%、35.09%±1.46%、46.72%±2.09%、60.29%±1.47%、84.19%±2.69%。统计学分析显示,热疗+阿霉素化疗组、脂质体阿霉素化疗组、阿霉素化疗组、热疗+脂质体阿霉素化疗组细胞凋亡率均显著高于对照组(2.31%±0.21%,P<0.05),且其余各组间比较差异均具有统计学意义(P<0.05)。
3 讨 论
胶质瘤是一类发病率高、危害性大的中枢神经系统肿瘤,其典型临床症状为颅内压增高及瘤周脑组织受压表现[9]。目前胶质瘤的治疗以手术为主,放化疗为辅,但传统放化疗缺乏特异性,在杀灭肿瘤细胞的同时也往往带来明显的毒副作用,而单纯手术切除治疗胶质瘤的中位生存期仅为52周[10],因此有必要寻找新的有效的治疗手段。
阿霉素是临床常用的蒽环类抗肿瘤药物,然而该药在杀伤肿瘤细胞的同时,也会产生明显的全身不良反应,如骨髓抑制、心脏损害等,因此临床应用受到限制。近年来出现的脂质体阿霉素(liposome doxorubicin)既能加强药物的抗癌作用,又能减少其毒副作用[11]。
热敏脂质体的膜组成成分中有对温度敏感的物质,当加热到一定温度时,脂质体膜的状态发生改变,通透性增加,使药物大量释放。阿霉素热敏脂质体在血液中循环时间长,能明显降低肝脏和脾脏网状内皮系统对阿霉素的吞噬量,当在肿瘤病变部位局部加热时,可促使阿霉素在肿瘤局部大量释放并高度浓集,从而显著抑制肿瘤生长[12]。
从本文的研究结果可以看出:热疗+化疗后SWO-38细胞的增殖抑制率显著高于单纯热疗、单纯化疗,且热疗+脂质体阿霉素化疗组明显高于热疗+阿霉素化疗组。热疗+化疗后SWO-38细胞的凋亡率显著高于单纯热疗、单纯化疗,且热疗+脂质体阿霉素化疗组明显高于热疗+阿霉素化疗组。该结果表明热疗与脂质体阿霉素联合应用对脑胶质瘤细胞的抑制作用更强,一方面疗效得到明显提高,另一方面也可降低阿霉素的用量,减少毒副反应的发生。
脑胶质瘤的发病机制较为复杂,目前单一疗法尚不能获得理想的治疗效果,只有通过多学科的共同协作,以多种治疗方法进行优势互补及有机联合,才能到达理想的效果,但热疗与脂质体阿霉素联合应用治疗脑胶质瘤的疗效尚有待进一步临床验证。
[1] Freije WA, Castro-Vargas FE, Fang Z, et al. Gene expression profiling of gliomas strongly predicts survival[J]. Cancer Res, 2004, 64(18): 6503-6510.
[2] Zhang GB, Liu FS, Wang ZC. Progress of glioma stem cells nest[J]. J Neurosurg, 2011, 27 (12): 1287-1290.[张国滨, 刘福生, 王忠诚. 脑胶质瘤干细胞巢的研究进展[J]. 中华神经外科杂志, 2011, 27(12): 1287-1290.]
[3] Liang Y, Diehn M, Watson N, et al. Gene expression profiling reveals molecularly and clinically distinct subtypes of glioblastoma multiforme[J]. Proc Natl Acad Sci USA, 2005, 102(16): 5814-5819.
[4] Michotte A, Neyns B, Chaskis C, et al. Neuropathological and molecular aspects of low-grade and high-grade gliomas[J]. Acta Neurol Belg, 2004, 104(4): 148-153.
[5] Kianmanesh R, Scaringi S, Sabate J M, et al. Iterative cytoreductive surgery associated with hyperthermic intraperitoneal chemotherapy for treatment of peritoneal carcinomatosis of colorectal origin with or without liver metastases[J]. Ann Surg, 2007, 245(4): 597-603.
[6] Maruyama K. In vivo targeting by liposomes[J]. Biol Pharm Bull, 2000, 23(7): 791-799.
[7] Huwyler J, Yang J, Pardridge WM. Receptor mediated delivery of daunomycin using immunoliposomes: pharmacokinetics and tissue distribution in the rat[J]. J Pharmacol Exp Ther, 1997, 282(3): 1541-1546.
[8] Ishida O, Maruyama K, Yanagie H, et al. Targeting chemotherapy to solid tumors with long-circulating thermosensitive liposomes and local hyperthermia[J]. Jpn J Cancer Res, 2000, 91(1): 118-126.
[9] Zhang X, Gao L, Shi XW. Children glioma: A report of 53 cases[J]. J Pediatr Clin Pract, 2008, 23 (11) : 831-832.[张玄,高丽, 史锡文. 儿童脑胶质瘤53例[J]. 实用儿科临床杂志, 2008, 23(11): 831-832.]
[10] Huang XP, Chen JL, Zhang QP, et al. Surgery effect and prognostic factors of 146 cases of glioma[J]. J Nerve Oncol, 2006, 4 (3): 215-218.[ 黄小平, 陈建良, 张清平, 等. 脑胶质瘤146例手术效果及预后因素分析[J]. 中国神经肿瘤杂志, 2006, 4(3): 215-218.]
[11] Huang LS, Lin RJ. Antineoplastic role and evaluation of liposome adriamycin[J]. Strait Pharm, 2011, 23(9): 109-110.[黄丽珊, 林瑞金. 脂质体阿霉素抗肿瘤药的作用及评价[J]. 海峡药学, 2011, 23(9): 109-110.]
[12] Deng B, Ye L, Wang C, et al. The proliferation and apoptosis of liposome adriamycin on nasopharyngeal carcinoma cell lines HNE-1[J]. J Chongqing Med Univ, 2009, 34(11): 1479-1481. [邓碧, 叶琳, 王驰, 等. 脂质体阿霉素对人鼻咽癌HNE-1细胞株增殖与凋亡作用的研究[J]. 重庆医科大学学报, 2009, 34(11): 1479-1481.]
Effects of liposome-adriamycin (L-ADM) and thermotherapy on glioma cells: an experimental study
SHI Zheng-hua1, ZHANG Jian-ning2*
1Department of Neurosurgery, Xijing Hospital, Fourth Military Medical University, Xi'an 710032, China
2Department of Neurosurgery, Navy General Hospital, Beijing 100048, China
*
, E-mail: jnhang2005@yahoo.com.cn
ObjectiveTo observe the effects of liposome-adriamycin (L-ADM) and thermotherapy on proliferation and apoptosis of SWO-38 glioma cells.MethodsThe SWO-38 glioma cells were cultivated in vitro. The effects of thermotherapy (43℃), ADM chemotherapy, L-ADM chemotherapy, thermotherapy + ADM chemotherapy, and thermotherapy + L-ADM chemotherapy on the cell proliferation and apoptosis were observed. The working concentration of ADM and L-ADM, and the cell proliferation rate were determined by MTT method. The apoptotic rate was determined by flow cytometry.ResultsThe proliferation inhibition rate of thermotherapy + L-ADM chemotherapy and thermotherapy + ADM chemotherapy was 80.16%±3.78% and 62.09%±3.05%, respectively, and it was significantly higher than that of L-ADM chemotherapy (40.27%±2.32%), ADM chemotherapy (30.56%±2.03%) or thermotherapy (16.51%±1.26%, P<0.05), and the proliferation inhibition rate of thermotherapy + L-ADM chemotherapy was higher than that of thermotherapy + ADM chemotherapy (P<0.05). The apoptotic rate of thermotherapy + L-ADM chemotherapy and thermotherapy + ADM chemotherapy was 84.19%±2.69% and 60.29%±1.47%, respectively, and it was significantly higher than that of L-ADM chemotherapy (46.72%±2.09%), ADM chemotherapy (35.09%±1.46%) and thermotherapy (17.85%±0.78%, P<0.05), and the apoptotic rate of thermotherapy + L-ADM chemotherapy was higher than that of thermotherapy + ADM chemotherapy (P<0.05).ConclusionThermotherapy can enhance proliferation inhibition and apoptosis induction effect of ADM and L-ADM on SWO-38 glioma cells, and this effect is even stronger with L-ADM.
doxorubicin; thermochemotherapy; cell proliferation; apoptosis
R739.410.53
A
0577-7402(2013)03-0201-03
2012-10-22;
2013-02-16)
(责任编辑:胡全兵)
史正华,硕士研究生。主要从事脑肿瘤方面的基础与临床研究
710032 西安 第四军医大学西京医院神经外科(史正华);100048 北京 海军总医院神经外科(张剑宁)
张剑宁,E-mail:jnzhang2005@yahoo.com.cn

