肺病理取材定量比较研究及其诊断学意义
李海胜,杜鹃,王海燕,岳彩黎,杨策,蒋建新
在肺脏基础和临床研究中,鉴于肺脏独特的解剖结构和复杂的细胞组成[1],科学取材﹑规范处理组织标本是各种肺脏病理研究的关键环节和先决条件。肺脏体积的90%为空气,仅10%为组织,再加上肺脏独特的囊泡结构,所以肺脏固定成为具有一定难度的问题。目前,关于肺脏固定存在方法不统一﹑条件不一致等问题,导致不同研究结果间可比性差,并出现组织结构问题,如肺泡塌陷﹑变形﹑肺泡结构破坏,甚至出现肺间隔增厚﹑细胞数目增多﹑出血﹑肺泡体积增大等人工假象[2]。肺脏固定存在的问题最终使后续的体视学形态定量分析失去诊断意义。因此,优化并规范肺脏固定方法以提高病理诊断价值显得尤为重要。本研究以大鼠为研究对象,分别采用单纯气管内固定﹑单纯肺循环固定和气管肺循环联合固定等三种肺脏固定方法,利用HE染色﹑免疫荧光染色定性观察和体视学定量分析不同方法对肺泡结构和细胞抗原的影响,旨在确认能客观反映肺脏病理变化的最佳操作流程,为基于形态定量分析的肺脏病理诊断提供实验依据。
1 材料与方法
1.1 实验动物 健康成年SD大鼠,雌雄不限,体重约250g,由第三军医大学大坪医院实验动物中心[许可证号SCXK(军)2007-017]提供。饲养室恒温22±2℃,明暗各12h交替循环条件下饲养,自由饮食﹑饮水。
1.2 主要器材和试剂 手术器械(上海医疗器械,中国)。头皮针(上海金塔医疗器械,中国),16G静脉留置针(B.Braun,德国),荧光显微镜(Olympus,日本),石蜡包埋机和石蜡切片机(Leica,美国);40%福尔马林溶液(广东光华,中国);正常驴血清(Jackson,017-000-121,美国),pro-SPC(Santa cruz,SC7706,美国),Ki67(Abcam,ab66055,英国),AF488(Invitrogen,A21206,美国),AF594(Invitrogen,A11058,美国),DAPI(Sigma,D8417,美国)。
1.3 中性缓冲福尔马林(neural buffer formalin,NBF)配制方法[3]40%福尔马林原液10ml,NaH2PO4·H2O 400mg,Na2HPO4650mg,ddH2O 90ml,充分混匀,调整pH=7.2~7.4。
1.4 实验分组 将15只大鼠随机分为3组:单纯气管内固定组﹑单纯肺循环固定组﹑气管肺循环联合固定组,每组5只。
1.5 单纯气管内固定法 大鼠腹腔注射60mg/kg的2%戊巴比妥钠麻醉,尾静脉注射300U/kg浓度为500U/ml的浓肝素行全身肝素化。游离暴露气管,行气管插管。开腹暴露并剪断腹主动静脉放血,向上剪破膈肌使肺脏萎陷,开胸暴露心脏和肺脏,以25cmH2O压力经气管插管灌注NBF,持续10min;结扎气管,整肺浸入NBF,4℃过夜。
1.6 单纯肺循环固定法 大鼠麻醉﹑肝素化同前;开腹暴露并剪断腹主动静脉放血,开胸暴露心脏和肺脏,于右心室中下1/3穿刺进针行肺动脉置管,注射器经肺动脉置管5min内先后推入50ml PBS和50ml NBF,后续处理同前。
1.7 气管和肺循环联合固定法 大鼠麻醉﹑肝素化同前;游离暴露气管,行气管插管;开腹暴露并剪断腹主动静脉放血,向上剪破膈肌使肺脏萎陷,开胸暴露心脏和肺脏,于右心室中下1/3穿刺进针行肺动脉置管,以25cmH2O压力经肺动脉置管滴入5IU/ml肝素化PBS,直至肺完全变白;以25cmH2O压力经气管插管灌注NBF,持续10min;待肺充盈后以25cmH2O压力经肺动脉置管滴入NBF,持续10min,后续处理同前。
1.8 组织块抽样和切片 游离右下肺,按照2mm间隔横切成4~5个组织片,每个组织片从中间矢状切成2个组织块,每只大鼠共8~10个组织块,依次编号,按照等距随机抽样的原则选择2~3个组织块,抽取的组织块放入NBF,负压抽吸使其沉入瓶底,继续4℃固定48h。固定完成后梯度酒精脱水,氯仿透明,浸蜡,以靠近肺尖的横切面为底面进行石蜡包埋。按照5μm厚度切片,每个组织块连续切2张,第1张行HE染色,第2张行免疫荧光染色。
1.9 免疫荧光染色 石蜡切片脱蜡至水,0.01mol/L柠檬酸盐缓冲液(pH 6.0)高压修复2.5min,0.2%TritonX-100穿孔15min,10%正常驴血清室温封闭1h,一抗4℃孵育过夜,二抗37℃孵育1h,DAPI室温孵育5min,抗荧光淬灭封片剂封固,荧光显微镜采集图像。一抗包括:Ⅱ型肺泡上皮标志pro-SPC(鹅抗小鼠,1:30),表达于细胞质;增殖标志物Ki67(兔抗小鼠,1:200),表达于细胞核;二抗包括:AF594(驴抗鹅,1:400),AF488(驴抗兔,1:400)。
1.10 观察指标 肺泡结构和细胞抗原:HE染色观察肺泡大小﹑肺泡形态﹑肺间隔等肺泡结构变化,免疫荧光染色观察胞质抗原pro-SPC和胞核抗原Ki67的阳性信号数量﹑分布和强度。
肺泡线性截距(Lm):由图1A可见,每张切片随机选取4个非重叠400倍视野,Photoshop叠加6×7水平测试线段,以左侧端点为计数点,计数位于肺泡腔的左侧端点数(P)和测试线段与肺间隔的交点数(I),Image J软件测量测试线段长度(d),根据公式Lm=2×[(d×p)/I]计算Lm值[4]。肺实质体积密度(Vv):组织切片和视野选取方法同图1A;由图1B可见,Photoshop叠加9×9测试点,计数时以“十”字测试点的右上象限为准,右上象限击中肺实质即进行计数,得到落在肺实质上的总点数(Pp)和视野内所有测试点数目(PL),根据公式Vv=Pp/PL计算Vv值[5]。肺间隔厚度(T):组织切片和视野选取方法同图1A,由图1C可见,Photoshop叠加5条水平测试线,Image J软件测量被测试线贯穿且夹角大于60°的肺间隔厚度[6](图1)。
1.11 统计学处理 利用SPSS 13.0软件进行分析,数据以±s表示,数据呈正态分布,组间比较采用单因素方差分析,Scheffe法进行两两比较,P<0.05为差异具有统计学意义。

图1 肺形态定量分析指标Lm(A)﹑Vv(B)﹑T(C)测定示意图Fig. 1 Diagrammatic sketch of determination of lung morphological measurements, Lm(A), Vv(B) and T(C)
2 结 果
2.1 不同固定方法对肺泡结构的影响 大体观察发现,单纯气管内固定组肺脏呈红色,单纯肺循环固定组和气管肺循环联合固定组肺脏呈白色,各组肺脏大小无明显差异。HE染色发现单纯气管内固定组血管内和肺间隔可见大量红细胞聚集,肺间隔略有增厚,但肺间隔无断裂,肺泡腔无明显扩大(图2A);单纯肺循环固定组血管内和肺间隔未见红细胞,但肺间隔明显增厚,肺泡变形,并且肺间隔内出现空泡,可能为固定不完全的组织溶解形成的空洞或残留的气体(图2B);气管肺循环联合固定组血管和肺间隔无红细胞残留,肺间隔菲薄,肺泡形态自然,固定效果最好(图2C)。
2.2 不同固定方法对细胞抗原的影响 对细胞质抗原pro-SPC的免疫荧光染色发现,单纯气管内固定组未出现阳性染色,而单纯肺循环固定组的阳性细胞数明显多于气管肺循环联合固定组(图3AC)。对细胞核抗原Ki67染色结果发现,单纯气管内固定组的阳性细胞数少于气管肺循环联合固定组和单纯肺循环固定组(图3D-F)。
2.3 不同固定方法对Lm的影响 单纯肺循环固定组肺泡Lm最小,单纯气管固定组肺泡腔Lm略有增高,但与单纯肺循环固定组比较,差异无统计学意义(P>0.05);气管肺循环联合固定组肺泡腔Lm较其他两组均有增高,但仅与单纯肺循环固定组比较,差异有统计学意义(P<0.05,表1)。
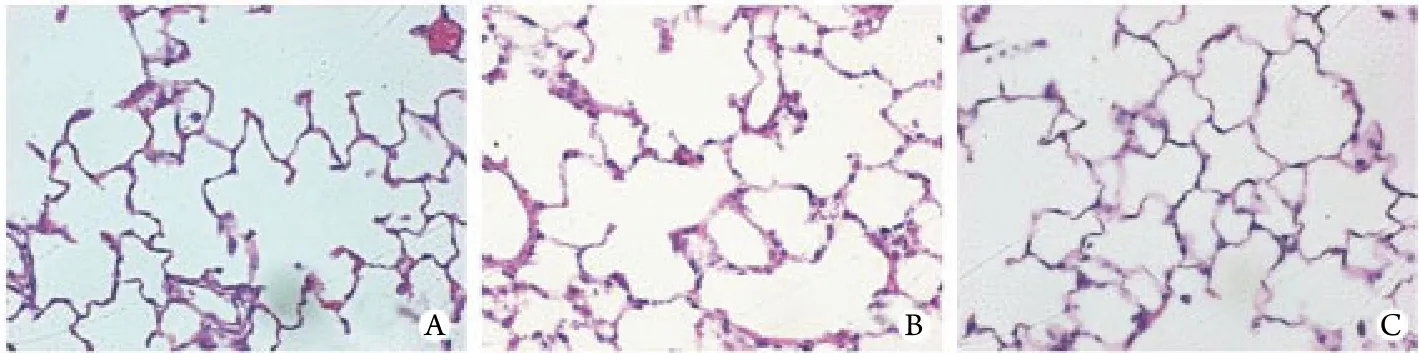
图2 不同固定方法对肺泡结构的影响Fig.2 Effect of different fixation methods on alveolar structure

图3 不同固定方法对细胞抗原的影响Fig. 3 Effect of different fixation methods on cell antigen
2.4 不同固定方法对Vv的影响 在三种固定方法得到的肺组织中,单纯肺循环固定组肺Vv最大,单纯气管内固定组次之,气管肺循环联合固定组最小,且各组间比较差异均具有统计学意义(P<0.05,表1)。
2.5 不同固定方法对T的影响 三种固定方法中,单纯肺循环固定组的T最大,单纯气管内固定组次之,气管肺循环联合固定组最小,且各组间比较差异均具有统计学意义(P<0.05,表1)。

表1 不同固定方法对肺形态学指标的影响Tab. 1 Effect of different fixation methods on lung morphometric index
3 讨 论
科学规范地肺脏取材是肺脏基础和临床研究的重要先决条件。目前常用的肺脏固定方法主要有直接浸泡固定[7]﹑压力或体积控制肺循环灌洗固定[8]﹑压力或体积控制气管灌注固定[9-11]﹑气管肺循环联合固定[12],但比较各种方法固定效果的文献极少,且大部分均为定性观察,鲜有文献对各种方法的优劣进行客观化定量评价。本研究利用普通的定性观察和客观的体视学定量分析,评价了三种常见固定方法对肺泡结构和细胞抗原的影响,为基础研究和临床诊断中肺脏固定方法的选择提供了可靠的实验依据。
肺组织固定中,最为关键的参数是固定液的种类﹑气管内灌注压力﹑肺循环灌洗压力等。常用的固定液主要包括福尔马林和多聚甲醛。一般认为,福尔马林是甲醛的水溶液,甲醛在水溶液中易聚合生成不溶的白色沉淀即多聚甲醛,商品化的福尔马林仅含37%~40%甲醛,还包含10%甲醇和其他甲酸盐等杂质。但是福尔马林和多聚甲醛均以单体形式与蛋白质交联发挥固定作用。实际上,福尔马林溶于pH为7.2~7.4的缓冲液时,其中的低聚物可以迅速解聚为单体形式;多聚甲醛中的高聚物则需加热等其他处理才能解聚为单体形式的甲醛。因此,10%中性福尔马林缓冲液(NBF)可以快速穿透组织,收缩性小,在有效保护抗原的同时能很好保持形态结构完整性,应用最为广泛,更适合推广[13]。美国胸科协会和欧洲呼吸协会(ATS/ERS)推荐的气道灌注压力为20~25cmH2O,可将肺固定于肺总量的生理扩张状态[14-15]。生理状态下肺动脉压力为15~20mmHg(20.4~27.2cmH2O),因此25cmH2O的肺循环灌注压力既可保证肺循环灌注彻底,又可避免灌注压过大引起的液体外渗。实际操作时需要注意以下几点:①用于气管和肺循环灌注的整个管道系统应尽可能粗﹑短,而且使得液体具备一定流速;②灌注管道内不能残留气体,因为气体会引起肺动脉堵塞,影响灌注效果;③气管肺循环联合固定时,气管内固定一定要早于肺循环固定,因为肺循环固定后肺组织即失去弹性不能回缩,肺内存在大量气体。气管灌注时,固定液不易进入肺泡腔,甚至会压迫气体从肺表面溢出造成肺泡破裂,而如果首先进行气管灌注,在开始灌注前,肺组织的弹性回缩力会排出肺内大部分的气体,从而利于固定液快速入肺;④整肺置于NBF固定过夜可以在排除肺重力影响的状态下使肺组织变硬,所以在后续切割组织块时可避免压迫组织。
任何一种固定方法的目的都是尽可能将操作本身对组织状态的影响降至最低,最终体现组织的真实情况。理想状态下,固定后各种组织结构和抗原应该没有任何改变,不会出现任何类型的“人工假象”。定性观察发现,在肺泡结构完整性方面,单纯气管内固定组肺间隔较薄,肺泡形态比较自然,但由于未去除红细胞,所以肺间隔和血管内存在大量红细胞,部分组织甚至出现肺泡内出血假象;单纯肺循环固定虽然可避免血管内红细胞对组织结构的影响,但出现肺间隔增厚﹑肺泡变形﹑部分肺间隔空泡假象等情况;总体而言,气管肺循环联合固定既可消除红细胞的影响又能更好保存肺泡结构,固定效果最好。在抗原保存方面,由于Ⅱ型肺泡上皮细胞可以增殖﹑分化并替代损伤脱落的Ⅰ型肺泡上皮细胞[16],最终修复肺泡上皮。目前由损伤介导的Ⅱ型肺泡上皮细胞增殖能力的变化是主要研究热点,因此我们通过Ⅱ型肺泡上皮细胞特异标志物pro-SPC和细胞增殖标志物Ki67的免疫荧光双染来评价不同固定方法对细胞抗原的保存效果。结果表明气管肺循环联合固定和单纯肺循环固定对抗原的保存效果都比较好,单纯气管内固定则相对较差,但是单纯肺循环固定会引起肺泡腔缩小,导致视野内阳性细胞数目明显多于气管肺循环联合固定。综合考虑,气管肺循环联合固定对肺泡结构和细胞抗原的保存效果最好。
肺泡线性截距Lm主要反映肺泡腔的扩张程度,常用来评价肺气肿严重程度,Lm越大肺泡腔越大,Lm越小肺泡腔越小[4,14],正常情况下Lm为35~40μm[1-2]。形态定量分析发现,气管肺循环联合固定组和单纯气管内固定组的Lm值均在正常范围内且并无明显差异,但显著高于单纯肺循环固定组,提示气管内滴注固定液可以减少肺泡的萎缩和塌陷。肺实质体积密度(Vv)指单位体积肺组织中含有的肺实质体积,常用来评价肺实变程度,Vv越大肺实变越严重;而肺间隔厚度可以从结构上反映气体交换能力,生理情况下肺间隔越薄气体交换能力越强[14];由于我们研究的区域主要为肺泡区域,肺实质几乎全为肺间隔,因此肺间隔厚度和Vv有一定的相关性,肺间隔越厚,Vv越大。体视学分析结果显示,单纯肺循环固定组的肺间隔增厚和Vv最大,单纯气管内固定组次之,气管肺循环联合固定组最小,提示单纯肺循环固定会造成肺间隔增厚的假象,进而造成Vv的增高;虽然单纯气管内固定组肺间隔厚度较单纯肺循环固定组明显降低,但由于肺间隔有红细胞残留,肺间隔增厚和Vv也略大;气管肺循环联合固定组从肺泡腔和血管腔双重固定,利于固定液的快速渗透,从而减少组织离体后和接触固定液前的自溶时间,最终固定的肺间隔菲薄,Vv也相应较小。因此,气管肺循环联合固定法更能真实反映处于功能状态下的肺组织结构。
当然,没有任何一种“万能”的固定方法,我们需要根据研究目的进行选择。单纯肺循环固定虽然可以避免红细胞对组织结构的影响,但不能观察肺充血﹑出血的病理表现;单纯气管内固定虽然可以更好地固定肺间隔,保持肺泡形态,但由于灌洗液进入肺泡时的冲洗作用,会对反映肺泡腔内病理改变的指标(如水肿液﹑肺泡表面活性物质﹑肺泡腔内炎性细胞等)有影响[17]。总之,气管肺循环联合固定法可以更好地保存肺泡结构和抗原,适用于各种以肺泡结构和细胞抗原为研究对象的病理基础和临床研究。
[1] Bertoncello I, McQualter JL. Endogenous lung stem cells: what is their potential for use in regenerative medicine[J]? Expert Rev Respir Med, 2010, 4(3): 349-362.
[2] Braber S, Verheijden KA, Henricks PA, et al. A comparison of fi xation methods on lung morphology in a murine model of emphysema[J]. Am J Physiol Lung Cell Mol Physiol, 2010,299(6): 843-851.
[3] Cai WQ. Histochemistry and Cytochemistry[M]. Beijing:People's Medical Publishing House, 2009. 2-11. [蔡文琴. 组织化学与细胞化学[M]. 北京: 人民卫生出版社, 2009. 2-11.]
[4] Lindsey JY, Ganguly K, Brass DM, et al. c-Kit is essential for alveolar maintenance and protection from emphysema-like disease in mice[J]. Am J Respir Crit Care Med, 2011, 183(12):1644-1652.
[5] Jung K, Schlenz H, Krasteva G, et al. Alveolar epithelial type II cells and their microenvironment in the caveolin-1-deficient mouse[J]. Anat Rec (Hoboken), 2012, 295(2): 196-200.
[6] Ghezzo RH. An Introduction to Lung Morphometry[M]//Hamid Q, Shannon J, Martin J. Physiologic basis of respiratory disease. Canada: BC Decker Inc, 2005. 769-775.
[7] Lei M, Ni YF, Li XF, et al. Protective effects of trichostatin a on lipopolysaccharide-induced acute lung injury in mice[J]. Med J Chin PLA, 2012, 37(4): 283-287. [雷鸣, 倪云峰, 李小飞, 等.曲古菌素A对脂多糖致急性肺损伤小鼠的保护作用观察[J].解放军医学杂志, 2012, 37(4): 283-287.]
[8] Danchuk S, Ylostalo JH, Hossain F, et al. Human multipotent stromal cells attenuate lipopolysaccharide-induced acute lung injury in mice via secretion of tumor necrosis factor-α-induced protein 6[J]. Stem Cell Res Ther, 2011, 2(3): 27.
[9] Giangreco A, Arwert EN, Rosewell IR, et al. Stem cells are dispensable for lung homeostasis but restore airways after injury[J]. Proc Natl Acad Sci USA, 2009, 106(23): 9286-9291.
[10] Yang YS, Yang MC, Guo Y, et al. PLAGL2 expression-induced lung epithelium damages at bronchiolar alveolar duct junction in emphysema: bNip3- and SP-C-associated cell death/injury activity[J].Am J Physiol Lung Cell Mol Physiol, 2009, 297(3): 455-466.
[11] Ni YF, Wang J, Yan XL, et al. Histone deacetylase inhibitor,butyrate, attenuates lipopolysaccharide-induced acute lung injury in mice[J]. Respir Res, 2010, 11: 33.
[12] Trachsel S, Purkabiri K, Loup O, et al. High-quality lung fixation by controlled closed loop perfusion for stereological analysis in a large animal model[J]. J Surg Res, 2011, 166(2): e97-e102.
[13] Matsuda Y, Fujii T, Suzuki T, et al. Comparison of fixation methods for preservation of morphology, RNAs, and proteins from paraffin-embedded human cancer cell-implanted mouse models[J]. J Histochem Cytochem, 2011, 59(1): 68-75.
[14] Hsia CC, Hyde DM, Ochs M, et al. An of fi cial research policy statement of the american thoracic society/european respiratory society: standards for quantitative assessment of lung structure[J]. Am J Respir Crit Care Med, 2010, 181(4): 394-418.[15] Roland Hausmann.Methodsof lung fixation[J]. Forensic Pathol Rev, 2006, 4(10): 437-451.
[16] Kotton DN. Next-generation regeneration: the hope and hype of lung stem cell research[J]. Am J Respir Crit Care Med, 2012,185(12): 1255-1260.
[17] Ochs M, Fehrenbach H, Nenadic I, et al. Preservation of intraalveolar surfactant in a rat lung ischaemia/reperfusion injury model[J]. Eur Respir J, 2000, 15(3): 526-531.

