丹参酮IIA对大鼠脑缺血再灌注后细胞凋亡、Drp-1、TRPM7表达的影响
肖晗汤其强刘磊磊韩若东
·论 著·
丹参酮IIA对大鼠脑缺血再灌注后细胞凋亡、Drp-1、TRPM7表达的影响
肖晗*汤其强*刘磊磊*韩若东△
目的探讨丹参酮IIA对大鼠局灶性脑缺血再灌注后细胞凋亡、Drp-1、TRPM7表达的影响。方法分别用高低剂量丹参酮IIA预处理大鼠,制备局灶性脑缺血模型,缺血2 h后开始监测缺血区大脑中动脉脑血流变化直到再灌注24 h,2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色法检测脑梗死体积,原位末端标记(in situ nick-end labeling,TUNEL)检测神经元凋亡,免疫组化及Western blot检测发动相关蛋白-1(dynamin-related protein 1,Drp-1)、瞬时受体电位离子通道蛋白7(transient Receptor Potential cation chan⁃nel7,TRPM7)蛋白表达水平。结果丹参酮IIA高低剂量组能明显抑制缺血区脑组织Drp-1及TRPM7蛋白表达(P<0.05),减少凋亡细胞数(P<0.05),缩小脑梗死体积(P<0.05)。缺血2 h后再灌注24 h,I/R组右侧大脑中动脉缺血区血流量下降为31.80%±2.49%,与I/R组比较,I/R+Tan1组及I/R+Tan2组血流量分别为(54.8%±3.27%)、(58.8%±3.03%),P<0.05,但丹参酮IIA高低剂量组两者之间的脑梗死体积、TUNEL阳性细胞数、对脑血流量的改善无差异性(P>0.05)。结论丹参酮IIA对大鼠局灶性脑缺血再灌注后神经元凋亡及线粒体裂解有抑制作用,其机制可能与改善缺血区脑血流量,减少Drp-1、TRPM7表达有关。
丹参酮IIA再灌注 脑 细胞凋亡
线粒体是细胞能量代谢的重要场所,也是缺血/再灌注早期易累及的细胞器。研究表明,Drp-1是介导线粒体裂变的重要执行分子[1]。另外,TRPM7通过激活下游的磷酸肌醇3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)通路参与神经元生长、增殖、代谢的调节[2-3]。丹参酮IIA是治疗脑缺血的常用中药[4],用它预处理大鼠对大鼠脑缺血再灌注损伤具有保护作用,但它对脑缺血再灌注诱导的神经元凋亡及Drp-1、TRPM7表达的研究鲜见报道。实验采用不同剂量丹参酮IIA预处理大鼠1周,大脑中动脉线栓法制备局灶性脑缺血模型,缺血2 h再灌注24 h,观察各组大鼠脑梗死体积的大小,脑缺血区血流量的改变,神经元凋亡情况以及Drp-1、TRPM7的表达,探讨丹参酮IIA对脑缺血再灌注损伤的保护机制。
1 材料与方法
1.1 实验方法与分组
1.1.1 手术方法及术前处理 76只雄性SD大鼠(购自安徽医科大学医学实验动物中心);质量250~300 g,随机分成4组,假手术组(S组)、缺血再灌注组(I/R组)、丹参酮IIA低剂量组[10 mg/(kg·d),I/R+Tan1组]和丹参酮IIA高剂量组[30 mg/(kg·d),I/R+Tan2组],每组19只。灌胃1周后,参照O.En⁃gel[5]等大鼠大脑中动脉栓塞模型方法制备局灶性脑缺血模型。缺血2 h后抽出线栓,再灌注24 h。假手术组,同样操作,但不插入线栓。参照Longa[6]评分标准选择纳入和排除大鼠:0分为正常,无神经学征象;1分:动物不能完全伸展左前肢;2分:动物行走时向左侧转圈;3分:动物行走向左侧跌倒;4分:无自发活动,有意识障碍。神经功能缺损评分在1~3分为模型成功,0分和4分剔除,实验中随机补充,保证每组动物数不变。
1.1.2 大脑中动脉的脑血流监测使用激光多普勒监测右侧大脑中动脉缺血周边区脑血流,计算血流降低值。
1.1.3 TTC法测定脑梗塞体积梗死灶呈白色,正常脑组织呈红色。脑梗死体积(%)=苍白区重量/(苍白区重量+非苍白区重量)×100%。
1.1.4 TUNEL检测神经元凋亡凋亡阳性细胞细胞核呈棕黄色。阳性率=阳性细胞数/(阳性细胞数+阴性细胞数)×100%。
1.1.5 免疫组化、Western blot检测Drp-1,TRPM7蛋白表达免疫组化中Drp-1呈细胞质黄染、TRPM7阳性细胞细胞膜黄染。Western blot法对Drp-1,TRPM7蛋白进行光密度积分值分析。
1.2 统计学方法采用SPSS17.0进行统计学分析,脑血流量和阳性细胞数以(±s)表示,多组比较采用单因素方差分析(F检验),检验水准α=0.05。
2 结果
2.1 缺血区脑血流量从缺血2 h开始监测缺血区大脑中动脉脑血流变化,选择2,8,24 h这三个时间点记录绘图,与I/R组比较,再灌注后24 h,I/R+ Tan1组及I/R+Tan2组脑血流量下降减少,差异有统计学意义(P<0.05)。但不同时间点的丹参酮处理组间脑血流量的变化无明显差异性(P>0.05)(见图1)。
2.2 丹参酮IIA对脑缺血再灌注大鼠脑梗死体积的影响I/R组大鼠缺血2 h再灌注24 h缺血侧脑组织有明显的梗死现象;与I/R组相比,I/R+Tan1组及I/R+Tan2组脑梗死体积明显缩小(P<0.05),但丹参酮高低剂量组之间比较无统计学差异(P>0.05)(见图2)。
2.3 丹参酮IIA对大鼠局灶性脑缺血再灌注后神经元凋亡的影响丹参酮高低剂量处理大鼠可以减少I/R组大量出现TUNEL阳性细胞,具有统计学意义(P<0.05),但丹参酮高低剂量组之间无统计学差异(P>0.05)(见图3)。
2.4 免疫组化检测缺血2 h再灌注24 hDrp-1及TRPM7蛋白含量表达的影响 Drp-1蛋白阳性表达于细胞质,TRPM7蛋白阳性表达于细胞膜,均呈棕黄色颗粒。与S组比较,I/R组大鼠缺血半暗带区阳性细胞Drp-1明显增加(P<0.01),与I/R组比较,I/R+Tan1组及I/R+Tan2组Drp-1、TRPM7组阳性细胞均降低(P<0.01),其中以I/R+Tan2组降低最为明显(P<0.05)(见图4、5)。
2.5 Western blot检测缺血2 h再灌注24 h后Drp-1及TRPM7蛋白表达水平与S组比较,I/R组Drp-1、TRPM7蛋白表达明显高于S组(P<0.01);与I/R组比较,I/R+Tan1组及I/R+Tan2组Drp-1、TRPM7逐渐降低(P<0.05),其中以I/R+Tan2组降低最为明显(P<0.05)(见图6)。
3 讨论
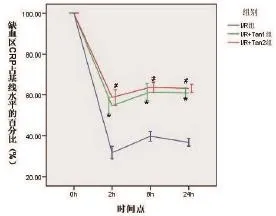
图1 不同时间点模型组和治疗组大脑中动脉的脑血流量变化与I/R组比较,#*P<0.05。
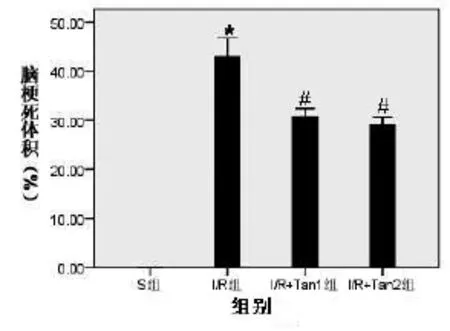
图2 丹参酮IIA对脑缺血再灌注大鼠脑梗死体积的影响 与S组相比,*P<0.05;与I/R组比较,#P<0.05
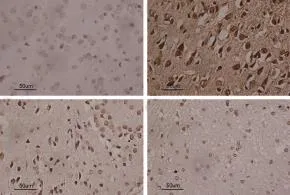
图3 大鼠脑组织TUNEL阳性细胞(TUNEL染色,400×)A:S组;B:I/R组;C:I/R+Tan1组;D:I/R+Tan2组
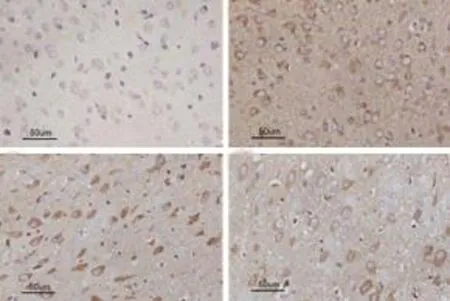
图4 大鼠脑组织DRP-1阳性细胞(免疫组织化学染色,400×)A:S组;B:I/R组;C:I/R+Tan1组;D:I/R+Tan2组
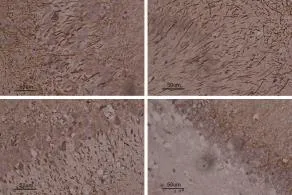
图5 大鼠脑组织TRPM7阳性细胞(免疫组织化学染色,400×)A:S组;B:I/R组;C:I/R+Tan1组;D:I/R+Tan2组
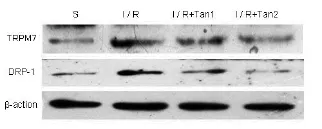
图6 丹参酮IIA对Drp-1、TRPM7蛋白表达的影响
丹参酮IIA可以减少缺血再灌注后脑梗死体积,改善大鼠神经功能缺损症状,减少神经细胞凋亡,这与既往研究相一致[7]。其保护机制主要涉及减轻缺血再灌注后的炎症反应[8]及氧化应激损伤[9],降低细胞内Ca2+超载[10]等方面。Drp-1为dynamin超家族成员之一,Labrousse等[11]在研究Drp-1对线粒体外膜的影响时,发现超表达Drp-1分子可以加速线粒体裂解;而敲除Drp-1基因后,抑制了内源性的Drp-1表达,进而减少了线粒体的裂解,说明Drp-1是线粒体裂解的必需分子。目前未见Drp-1在脑缺血再灌注中的研究,于是我们采用丹参酮IIA预处理大鼠,然后制备缺血再灌注模型,发现I/R组较S组Drp-1明显升高,证实Drp-1参与了脑缺血再灌注过程。同时I/R+Tan1组及I/R+Tan2组大鼠脑组织Drp-1阳性细胞逐渐降低,凋亡细胞的减少及脑梗死体积的缩小都说明了丹参酮IIA可能具有调节Drp-1的抗凋亡的作用。既往研究曾证明,在脑缺血再灌注中,通过其它方式如凋亡相关基因bcl-2抑制Caspase3的激活可以保护线粒体膜的稳定性,从而减少神经元凋亡[12]。虽然目前尚无抑制Drp-1在脑缺血再灌注中具有神经保护作用的文献证据,但对Drp-1作用机制的研究表明增加表达的Drp-1,可以从神经元胞浆中转位至线粒体,并激活Caspase系统,使线粒体内重要蛋白及细胞器受损,最终导致线粒体破碎,引起细胞凋亡[13-14]。而我们在脑缺血再灌注中的研究结果也与此机制相一致。至少证明Drp确实参与丹参酮IIA改善脑缺血再灌注的过程。
另外,由于参与非兴奋性神经元细胞死亡过程,TRPM7有望成为治疗脑缺血疾病潜在新靶点[15]。TRPM7同时具有阳离子离子通道活性和蛋白激酶结构域,与PI3K/Akt通路有密切关系。PI3K/Akt信号通路参与缺血性神经保护作用后干预[16-17],Akt磷酸化神经细胞中内皮型一氧化氮合酶的Ser1177区域,从而激活下游酶[18-19]。通过Akt激活的一氧化氮合酶可能对细胞的凋亡有重要生理作用,在脑损伤或脑缺血中作用明显[20]。但丹参酮IIA是否影响缺血再灌注后TRPM7的表达,未见研究。我们发现在假手术组中,大鼠无神经行为缺损症状,仅出现少量TRPM7的表达,模型组中,大鼠出现不同程度的神经行为缺损症状,脑血流量也明显下降,TRPM7则明显表达增多,预处理丹参酮IIA显著降低了脑梗死后TRPM7水平,以I/R+Tan2组更为明显,提示丹参酮IIA可能通过抑制脑梗死后PI3K/Akt中TRPM7蛋白表达来达到保护作用。
实验还发现,丹参酮IIA挽救脑梗死体积及细胞凋亡的作用与剂量无明显相关性,给予不同剂量的药物后观察到,Drp-1,及TRPM7虽然表达下降,但是丹参酮IIA低剂量组与高剂量组的脑梗死体积及TUNEL阳性细胞凋亡数目并没有明显差异,具体原因不明。推测可能是脑血管自我调节稳定性遭到破坏,虽然在丹参酮的作用下血流恢复但是不稳定的血流灌注引起脑水肿过度继发脑梗死体积和细胞凋亡的产生。
综述所述,Drp-1,TRPM7在脑缺血再灌注大鼠脑组织中超表达,引起线粒体功能障碍而诱发的细胞凋亡可能是脑缺血再灌注损伤的原因之一。而丹参酮IIA能干预Drp-1及TRPM7表达,抑制线粒体裂解,减少细胞凋亡,其保护机制可能还涉及PI3K/Akt通路。
[1]Santel A,Frank S.Shaping mitochondria:the complex posttrans⁃lational regulation of the mitochon drial fission protein DRP1[J]. IUBMB Life,2008,60(7):448-455.
[2]Bae CY,Sun HS.Current understanding of TRPM7 pharmacolo⁃gy and drug development for stroke[J].Acta Pharmacol Sin, 2013,34(1):10-16.
[3]Xu X,Chua CC,Gao J,et al.Neuroprotective effect of humanin on cerebral ischemia/reperfusion injury is mediated by a PI3K/ Akt pathway[J].Brain Res,2008,1227:12-18.
[4]Han JY,Fan JY,Horie Y,et al.Ameliorating effects of com⁃pounds derived from Salvia miltiorrhiza root extract on microcir⁃culatory disturbance and target organ injury by ischemia and re⁃perfusion[J].Pharmacol Ther,2008,117(2):280-295.
[5]Engel O,Kolodziej S,Dirnagl U,et al.Modeling stroke inmice-middle cerebral artery occlusion with the filament model [J].J Vis Exp,2011,47:2423.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle ce⁃rebral artery occlusion without craniectomy in rats[J].Stroke, 1989,20(1):84-91.
[7]Lam BY,Lo AC,Sun X,et al.Neurprotective effects of tanshi⁃nones in transient focal cerebral ischemia in mice[J].Phyto⁃medicine,2003,10(4):286-291.
[8]Dong K,Xu W,Yang J,et al.Neuroprotective efects of Tanshino⁃neII A on permanent focal cerebral ischemia in mice[J].Phyto⁃ther Res,2009,23(5):608-613.
[9]Tang QQ,Han RD,Xiao H,et al.Neuroprotective effects of tan⁃shinone IIA and/or tetramethylpyrazine in cerebral ischemic in⁃jury in vivo and in vitro[J].Brain Research,2012,1488(7):81-91.
[10]何素冰,何丽娜,杨军.丹参酮对大鼠皮层神经细胞钙超载损伤的保护作用[J].中成药,2002,24(5):371-373.
[11]Labrousse AM,Zappaterra MD,Rube DA,et al.Celegans dyna⁃min-related protein DRP-1 controls severing of the mitochon⁃drial outer membrane[J].Mol cell,1999,4(5):815-826.
[12]巴晓红,刘英,曹俊芳.吸氧预处理对大鼠局灶脑缺血神经细胞凋亡及Bcl-2、Bax的影响[J].中国神经精神疾病杂志, 2010,36(3):178-180.
[13]Leinninger GM,Backus C,Sastry AM,et al.Mitochondria in DRG neurons undergo hyperglycemic mediated injury through Bim,Bax and the fission protein Drp1[J].Neurobiol Dis,2006, 23(1):11-22.
[14] Sawada M,Sun W,Hayes P,et al.Ku70 suppresses the apoptot⁃ic translocation of Bax to mitochondria[J].Nat Cell Biol,2003,5
[15](4):320–329. Asrar S,Aarts M.TRPM7,the cytoskeleton and neuronal death
[16][J].Channels,2013,7(1):6-16. Yuan Y,Guo Q,Ye Z,et al.Ischemic postconditioning protects brain from ischemia/reperfusion injury by attenuating endoplas⁃mic reticulum stress-induced apoptosis through PI3K-Akt path⁃
[17]way[J].Brain Res,2011,1367:85-93. Zhou Y,Fathali N,Lekic T,et al.Remote imb ischemic post⁃conditioning protects against neonatal hypoxic-ischemic brain injury in rat pups by the opioid receptor/Akt pathway[J].Stroke,
[18]2011,42(2):439-444. Hashiguchi A,Yano S,Morioka M,et al.Up-regulation of endo⁃thelial nitric oxide synthase via phosphatidylinositol 3-kinase pathway contributes to ischemic tolerance in the CA1 subfield of gerbil hippocampus[J].J Cereb Blood Flow Metab,2004,24
[19](3):271-279. Lin HY,Wu CL,Huang CC.The Akt-endothelial nitric oxide synthase pathway in lipopolysaccharide preconditioning-in⁃duced hypoxic-ischemic tolerance in the neonatal rat brain[J].
[20]Stroke,2010,41(7):1543–1551.季艳琴,孙树清.一氧化氮和一氧化氮合酶在大鼠脑损伤组织中的表达[J].中国神经精神疾病杂志,2012,38(11): 692-695.
The effect of tanshinone IIA on apoptosis and the expression of,Drp-1 and TRPM7 in a rat model of cere⁃bral ischemia reperfusion.
XIAO Han,TANG Qiqiang,LIU Leilei,HAN Ruodong.Department of Neurology Disease,the Affiliated Provincial Hospital of Anhui Medical University,Hefei 230000,China.Tel:0551-62283114.
Objective To explore the effect of Tanshinone IIA on apoptosis and expression of Drp-1 and TRPM7 in a rat model of focal cerebral ischemia and reperfusion.Methods Rats were pretreated with high or low dose of tanshinone IIA before 2 h-focal cerebral ischemia plus 24 h-reperfusion.Cerebral blood flow in the middle cerebral artery was moni⁃tored during reperfusion.TTC,TUNEL and western blotting were used to detect the volume of cerebral infarction,apopto⁃sis and the protein expression of Drp-1 as well as TRPM7,respectively.Results Compared with control group,pretreat⁃ment with Tanshinone IIA could significantly down-regulate the expression of protein Drp-1 and TRPM7(P<0.05),attenu⁃ate apoptosis(P<0.05),and reduce the volume of ischemia infarction.The volumes of right middle cerebral artery blood flow were(31.80%±2.49%),(54.8%±3.27%),and(58.8%±3.03%)in controls,low-dose and high dose of tanshinone, respectively.Both low-dose and high-dose tanshinones improved cerebral blood flow.(tanshinone vs.control;all P<0.05). However,there was no statistical difference between low-dose and high-dose Tanshinone IIA groups in all measured out⁃comes(P>0.05).Conclusions Tanshinone IIA can inhibit ischemia-induced neuronal apoptosis and mitochondrial fissionprobably through improving cerebral artery blood flow and reducing the overexpression of Drp-1,TRPM7.
Tanshinone IIA Reperfusion Brain Apoptosis
R743
A
2013-08-19)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2013.12.004
☆ 安徽省卫生厅医学科研课题(编号:2010B003)
*安徽医科大学附属省立医院神经内科(合肥230000)
△ 亳州市人民医院重症监护室
(E-mail:tqq1995@126.com)

