固定波长UV-VIS光对大豆油品质的影响
于殿宇 刘 鑫 王 玥 邹小雨 奚会松 江连洲
(东北农业大学食品学院,哈尔滨 150030)
油脂及富含油脂的食品在人们的膳食中占较大比例,但是大豆油在存放过程中受空气、温度、光照、金属离子和油脂本身脂肪酸组成等因素的影响,会发生复杂的化学变化,导致其劣变[1]。
油脂的酸败是因油脂水解而产生游离脂肪酸,以及脂肪酸进一步氧化分解所引起的变质现象。油脂氧化酸败,是使其中的中性脂肪分解为甘油和脂肪酸,或使脂肪酸中的不饱和链断开形成过氧化物。过氧化物是一种中间产物,它很不稳定,能继续分解成醛、酮类及其他氧化物,致使油脂进一步变质。因此酸价和过氧化值是国家成品油脂卫生检验的必检项目,是判断油脂酸败程度的主要指标[2]。
脱色是油脂精炼过程中的重要步骤之一,油脂精炼的每一道工序,如脱胶、碱炼、脱色、脱臭等都影响油脂的色泽和品质。油脂工业中,大多用活性白土作为脱色剂。
油脂的色泽主要是由油中类胡萝卜素产生的,类胡萝卜素受不同因素的影响,导致其出现不同的变化规律。许多学者对食品加工贮藏过程及采用模拟系统研究表明,氧、光、热等因素对类胡萝卜素的稳定性均会产生破坏性影响,氧是类胡萝卜素降解的重要因索,光照也能导致类胡萝卜素的降解,热处理会导致类胡萝卜素的破坏并使其形成顺式类胡萝卜素异构体[3-6]。
许多相关出版物都有描述各种类胡萝卜素最大吸收波长与吸光系数的综合实例[7-9]。本研究是采用VIS-450及UV-365对油脂进行照射,利用有益波段的紫外及可见光,有效降低油品质劣变程度以降低油脂的色泽,不但减少了活性白土对油脂的污染,而且节约资源与能源。
1 材料与方法
1.1 材料和试剂
大豆油:九三牌三级大豆油;试剂均为分析纯。
1.2 设备和仪器
CEL-HXF300/CEL-HXUV300氙灯光源::北京中教金源科技有限公司;WSL-2罗维朋比色仪:上海物理光学仪器厂。
1.3 试验方法
分别精确量取50mL油样于18个100mL烧杯中,其中每9杯为一组,第1组在不同温度、时间条件下用UV-365进行避光照射。与此同时,第2组在不同温度、时间条件下用VIS-450进行避光照射,第3组试验,每隔2min对UV-365和VIS-450照射的油脂进行氧化诱导期测定,分别采用国标GB 5530—1985GB/T5538—2005GB/T22460—2008测定油脂的酸价、过氧化值及色泽。分别测定5组,过氧化值、酸价、色泽分别取算数平均值。
脱色率公式:(C0-C1)/C0
式中:C0为脱色前红值;C1为脱色后红值。
2 结果与讨论
2.1 光照脱色温度对油脂酸价的影响
采用VIS-450及UV-365分别在不同光照温度下对大豆油进行照射,酸价测定结果如图1所示。

图1 光照脱色温度对油脂酸价的影响
由图1可见,随着光照温度的增加,油脂中的酸价呈上升趋势,并且UV-365照射的酸价比VIS-450照射的酸价高。这是因为在试验温度下,光可以加速油脂的氧化,并且公式ε=h×c/λ可知,光能量与光波长成反比,UV-365光比 VIS-450光能量高,UV-365光更能催化加速油脂氧化生成游离脂肪酸。
2.2 光照脱色时间对油脂酸价的影响
采用VIS-450及UV-365分别在不同光照时间下对大豆油进行照射,酸价测定结果如图2所示。

图2 光照脱色时间对油脂酸价的影响
由图2可见,随着光照时间的延长,油脂中的酸价呈上升趋势,并且 UV-365光照射的酸价比VIS-450日光照射的酸价高。这是因为随着时间的延长,光积累量逐渐增大,大豆油中的游离脂肪酸生成量增加,导致油脂酸价的增加。并且由于光能量的不同导致酸价升高的不同。
2.3 光照脱色光通量对油脂酸价的影响
采用VIS-450及UV-365分别在不同光照光通量下对大豆油进行照射,酸价测定结果如图3所示。

图3 光照脱色光通量对油脂酸价的影响
由图3可见,随着油脂光照脱色温度的增加,油脂中的酸价呈上升趋势,并且UV-365光照射的酸价比VIS-450光照射的酸价高。这是因为光通量的增大,使单位面积的光通量增多,并且UV-365光比VIS-450光能量高,加速了油脂水解反应生成游离脂肪酸。
2.4 光照脱色温度对油脂过氧化值的影响
采用VIS-450及UV-365分别在不同光照温度下对大豆油进行照射,过氧化值测定结果如图4所示。
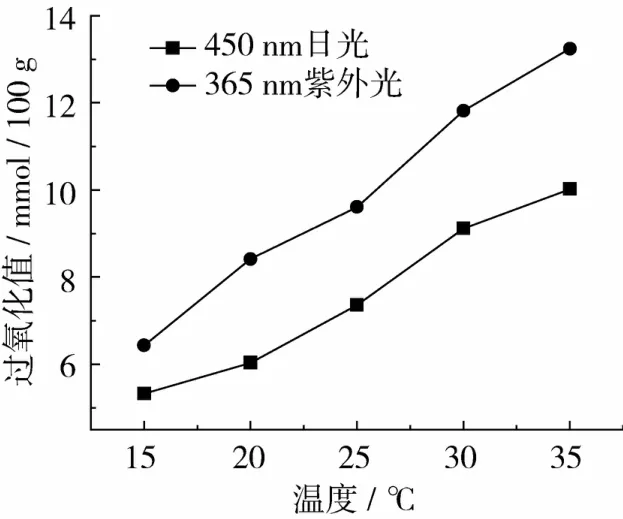
图4 光照脱色温度对油脂过氧化值的影响
由图4可知,随着光照温度的增加,油脂的过氧化值呈上升趋势,并且VIS-450照射的过氧化值比UV-365照射的过氧化值高,这主要是光照能加快油脂氧化链式反应,促使过氧化物的分解和聚合,从相对于双键的α-位的H原子分裂出来的均裂原子团开始,形成的碳原子团与氧反应生成过氧化原子团,过氧化原子团进入链反应形成过氧化物[10],导致过氧化值升高。
2.5 光照脱色时间对油脂过氧化值的影响
采用VIS-450及UV-365分别在不同光照时间下对大豆油进行照射,过氧化值测定结果如图5所示。
由图5可知,随着光照脱色时间的增加,油脂中的过氧化值呈上升趋势,并且VIS-450照射的酸价比UV-365照射的酸过氧化值高。这主要是因为随着时间的增长,光积累量逐渐增大,油脂中不饱和脂肪酸被光所氧化,生成过氧化物,进而使油脂的过氧化值增大。
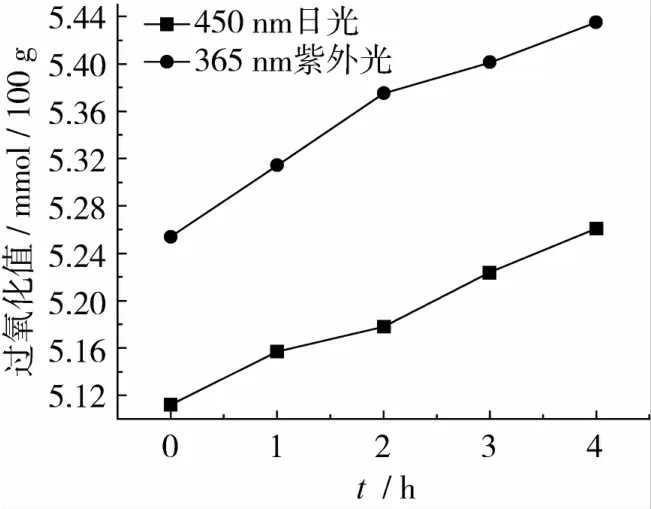
图5 光照脱色时间对油脂过氧化值的影响
2.6 光照脱色光通量对油脂光氧化值的影响
采用VIS-450及UV-365分别在不同光照光通量下对大豆油进行照射,过氧化值测定结果如图6所示。

图6 光照脱色光通量对油脂过氧化值的影响
由图6可知,随着照射光照脱色光通量的增加,油脂中的过氧化值呈上升趋势,并且VIS-450照射的酸价比UV-365照射的酸过氧化值高。其原因是光对油脂氧化有明显的促进作用,它最终导致油脂变质。光源可以是人工光线(白炽光或荧光),也可以是太阳光。不仅紫外线,而且所有的可见光均对油脂产生恶劣影响[11]。光线是能量,可以促使油脂产生自由基或促使氢过氧化物分解。不饱和脂肪酸的共轭双键强烈吸收紫外线后,引发连锁反应,并加速过氧化物的分解。射线能显著提高自由基的生成速度,增加脂肪酸氧化的敏感性,加重酸败变质[12]。
2.7 光照脱色温度对油脂色泽的影响
采用VIS-450及UV-365分别在不同光照温度下对大豆油进行照射,脱色率测定结果如图7所示。

图7 光照脱色温度对油脂色泽的影响
由图7可知,随着光照脱色温度的增加,油脂脱色率呈上升趋势,并且VIS-450照射油脂脱色率比UV-365紫外光照射的油脂脱色率高,其主要原因是试验温度下,大豆油中的类胡萝卜素对VIS-450吸收率比UV-365吸收率大,并且VIS-450能使类胡萝卜色链的结构的破坏,稳定性降低,进而导致油脂色泽降低。
2.8 光照脱色时间对油脂色泽的影响
采用VIS-450及UV-365分别在不同光照时间下对大豆油进行照射,脱色率测定结果如图8所示。

图8 光照脱色时间对油脂色泽的影响
由图8可知,随着光照脱色时间的增加,油脂脱色率呈上升趋势,并且VIS-450照射油脂脱色率比UV-365紫外光照射的油脂脱色率高,其原因是随着油脂光照时间的增长,溶氧量增加使氧气对类胡萝卜素的不饱和双键起破坏性作用增强,使其氧化分解,导致油脂色泽降低。并且随着时间的延长,类胡萝卜素对VIS-450能量吸收逐渐积累,使油脂色泽进一步降低
2.9 光照脱色光通量对油脂色泽的影响
采用VIS-450及UV-365分别在不同光照光通量下对大豆油进行照射,脱色率测定结果如图9所示。
由图9可知,随着光照脱色光通量的增强,油脂脱色率呈上升趋势,并且VIS-450照射油脂脱色率比UV-365紫外光照射的油脂脱色率高,其原因是电流增大,使光强度提高。光强度提高促进了类胡萝卜素分子中C—C双键的氧化断裂,并有一定的促羟基化和环氧化反应。导致类胡萝卜素的分解降级[13-14]。并且光对类胡萝卜素有二种作用效应,其一是形成顺反双键,使电磁波谱向蓝端漂移2~10 nm;其二是加速类胡萝卜素链的氧化,呈色基团降解断裂,光谱向紫外区漂移,失去颜色[15]。

图9 光照脱色光通量对油脂色泽的影响
2.10 最佳工艺条件的确定
通过单因素试验,确定光通量 1 600、2 000、2 400 lm,温度 20、25、30℃,时间 2、3、4 h,VIS-450及UV-365光设计正交试验,确定最佳工艺条件。

表1 波长为450 nm时的工艺条件

表2 波长为450 nm时的试验结果
从表2可以看出对大豆油脱色率影响主次顺序为:光通量>温度>时间,A3B3C3为最佳工艺条件:光通量2 400 lm,温度35℃,时间3 h,按照正交试验得出的最佳参数进行试验,油脂脱色率为53.2%。得到VIS-450光照脱色的最优工艺条件:光通量2 400 lm,温度35℃,时间3 h,脱色率为53.2%。

表3 波长为365 nm时的工艺条件

表4 波长为365 nm时的试验结果
从表4可以看出对大豆油脱色率影响主次顺序为:光通量>温度>时间,A3B3C2为最佳工艺条件:光通量2 400 lm,温度35℃,时间2 h,按照正交试验得出的最佳参数进行试验,油脂脱色率为42.4%。得到UV-365光照脱色的最优工艺条件:光通量2 400 lm,温度35℃,时间2 h,脱色率为42.4%。
3 结论
本试验是对大豆油加速氧化过程进行了初步研究,用VIS-450、UV-365光照对大豆油进行照射,通过单因素及正交试验,VIS-450光照脱色的最优工艺条件:光通量2 400 lm,温度35℃,时间3 h,脱色率为53.2%,氧化诱导期42~44 min之间。UV-365光照脱色的最优工艺条件:光通量2 400 lm,温度35℃,时间2 h,脱色率为42.4%,氧化诱导期34~36 min之间。结果表明:UV-365比VIS-450对大豆油品质劣变影响较大;VIS-450比UV-365对大豆油脱色率影响较大。
参考文献
[1]张蕊,祖丽亚,樊铁,等.不同贮存条件下大豆油氧化指标的比较[J].中国粮油学报,2007,22(5):112-114
[2]孙丽琴,孙立军,郑刚,等.不同的存放条件对油脂酸价和过氧化值的影响[J].粮油加工,2007(2):45-46
[3]陈志行,王建平,黄剑兴.叶黄素的提取和稳定性研究[J].食品科学,2005,26(9):284-288
[4]沈国鹏,徐贵敏,刘芳.脂溶性类胡萝卜素的提取及其稳定性研究[J].河南农业科学,2003(8):30-32
[5]钦传光,丁焰,王顺朝.橘皮色素的提取及其性质研究[J].食品工业科技,1997(5):10-11
[6]王淑敏,李静,赵艳茹.皮黄色素的提取新法研究[J].许昌师专学报:自然科学版,2001,20(2):71-73
[7]E de Ritter,A E Purcell.in Carotenoids as Colorants and Vitamin A Precursors[M].J C Bauernfiend.New York and London:Academic Press,1981
[8]B H Davies,in Chemistry and Biochemistry of Plant Pigments.T W Goodwin[M].2nd Edition.London and New Work:Academic Press,1976
[9]Craft N E,Soares J H.Relative solubility,stability,and,absorptivity of lutein and b-carotene inorganic solvents[J].J Agric Food Chem,1992,40(3):431-434
[10]邓鹏,王守经,王文亮,等.豆油氧化机理及检测方法研究[J].中国食物与营养,2008(8):17-19
[11]丁纯孝译.脂食品的劣化及其防止[M].北京:商业部科技情报研究所,1985
[12]罗炎斌,胡云辉.脂酸败及其控制[J].企业技术开发,2000(7):28-29
[13]KOPAS-LANELM,WARTHESENJJ.Carotenoid photostability in raws pinch and carrots during cold storage[J].Journal of Food Science,1995,60(4):773-776
[14]Pesekca,Warthesenjj.Photodegradation of carotenoids in a vegetable juice system[J].Journal of Food Science,1987,52(3):744-746
[15]王业勤,李勤生.天然类胡萝卜素研究进展、生产、应用[M].北京:中国医药科技出版社,1997:125-208.

