空心二氧化硅纳米微球包裹的photosan对胃腺癌细胞AGS的杀伤作用*
霍成龙,刘国清,邓小峰,何 杰,苗雄鹰,熊 力*
(1.中南大学湘雅二医院普外科,湖南 长沙410011;2.长沙市八医院东院120,湖南 长沙410011)
胃癌目前是全球发病率第四位的恶性肿瘤,在肿瘤中致死率居第二位。我国是胃癌高发国家,每年新发病例占全球的40%[1],且早期胃癌诊断率低,大部分胃癌病人出现症状时,已是胃癌中晚期,许多已失去了手术的机会。为提高晚期病人的生活质量和延长病人生命,迫切需要一种对正常组织危害小,全身副反应少的治疗。
光动力学疗法(photodynamic therapy,PDT)是一种新型肿瘤治疗技术,它们能够选择性的杀死肿瘤细胞,减小对正常组织的危害[2]。作为一种冷光化学反应,它主要依赖于光敏剂和光(常用激光)的相互作用,同时受组织内氧浓度影响,因而光敏剂是影响PDT作用效果的重要因素[3]。
与常规光敏剂相比较,纳米光敏剂具有颗粒小、比表面积大、表面反应活性高、活性中心多、催化效率高、吸附能力强等特点,制成导向药物,可达到靶向输药至特定器官的目的[4,5]。
本实验通过研究比较空心二氧化硅纳米微球包裹的photosan和普通photosan对人胃腺癌细胞AGS的增殖抑制率和杀伤机制,来评价纳米化-photosan的优势,为光敏剂的研究提供进一步的理论支持。
1 材料和方法
1.1 实验材料与仪器
1.1.1 细胞系 人胃腺癌细胞株AGS购自中南大学湘雅细胞库。
1.1.2 试剂与仪器 原硅酸四乙酯(TEOS,99.99%),聚丙烯酸(PAA,M.W=3000),聚丙烯酸钠(PAAS,M.W=45000),以上试剂购自阿拉丁化学有限公司(上海)。无水乙醇(99.7%),氨,阿摩尼亚(25-28%),购自中国医药集团公司。光敏剂Photosan(一种血卟啉寡聚体混合物)粉末,购自德国Diolitec药厂,DMEM高糖培养基和胎牛血清购自Gibco Invitrogen公司。MTT试剂购自sigma公司。LD-630半导体激光机光动力仪是由深圳雷迈公司提供。
1.1.3 制备空心二氧化硅纳米微球包裹的photosan具体简要步骤 在室温下,通过单段潮湿法制备包含光敏剂的纳米颗粒,即用0.165 mg聚丙烯酸(或者聚丙烯酸)和1 mg的Photosan溶解在4 mL的氨中,然后快速添加100 mL无水乙醇,在避光出充分搅拌均匀(大概0.5 h)。然后,在10 h内将1.395 g原硅酸四乙酯缓慢的添加到里面。每间隔2 h在电磁搅拌器搅拌一次。充分反应后,用离心机分离,用去离子水和无水乙醇洗涤三次,在真空干燥箱中用60℃烘干备用。
1.2 细胞培养及处理
1.2.1 细胞培养 人胃腺癌细胞AGS在含10%胎牛血清的DEME高糖培养液,37℃、5%CO2的培养箱中培养,取指数生长期的细胞进行实验。
1.2.2 纳米化-photosan和普通photosan处理细胞 人胃腺癌细胞AGS用0.25%胰酶消化,制备成浓度为2*105个/ml细胞悬浮液。以每孔200μL体积接种于96孔培养板中,每行接种6个孔,共6行,然后将培养板移入CO2恒温培养箱中,37℃、5%CO2及饱和湿度条件下培养24 h。实验分为实验对照组(既不光照也不加光敏剂),单纯光敏剂组(只加不同剂量的光敏剂,不行光照),单纯光照组(不加光敏剂,只进行不同剂量的光照),实验组(既加光敏剂也行光照)。将纳米化photosan颗粒悬液用不含血清的培养基稀释成浓度为20 mg/L,15 mg/L,10 mg/L,5 mg/L,2.5 mg/L的溶液。弃去细胞培养液,用PBS将细胞洗涤两遍,然后避光下加入含有纳米颗粒的培基200μL在37℃、5%CO2及饱和湿度条件下孵育4 h。4 h后,避光下弃去含纳米-photosan的培基,PBS洗涤两遍。然后,加入200μL普通培基。用630 nm的波长照射细胞,光照剂量分别为2 J/cm2,4 J/cm2,6 J/cm2。同样步骤使用普通光敏剂photosan处理细胞。
1.3 纳米化-photosan和普通photosan对细胞增殖影响的检测
1.3.1 MTT法检测 处理后的细胞继续孵育24 h后,每孔加入20μL MTT,孵育4 h后,弃去各孔内培养液,每孔中加入150μL DMSO,并于一空白孔中加入150μL DMSO作为调零标准;于振荡器上振荡10 min,使结晶物充分溶解,在酶联免疫检测仪上选择570 nm波长测定各孔OD值,记录结果。细胞生存率=实验组OD值/对照组OD值×100%
1.3.2 流式细胞术检测凋亡率 基于MTT实验结果,选择光照浓度为4 J/cm2,药物浓度为10 mg/L的条件处理细胞。收集各组细胞行细胞凋亡流式细胞术检测方法:使用Annexin V-FITC&PI细胞凋亡检测试剂盒(Biouniquer公司)检测。按试剂盒的使用说明操作。
2 统计分析
以上实验重复三次,结果用SPSS19.0统计,所有结果以用均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
3 结果
3.1 纳米化-photosan和普通photosan对AGS细胞MTT检测结果
sPDT后AGS细胞增殖明显受到抑制,在一定范围内,随着光照剂量和光敏剂浓度的增加,人胃腺癌细胞AGS的细胞生存率明显下降(P<0.05),当光照剂量达到一定程度(4 J/cm2),增加光照剂量,纳米化-photosan实验组的细胞生存率不再降低(P>0.05,图1)。当纳米化-photosan光敏剂达到一定浓度后(10 mg/L),增加纳米化-photosan光敏剂的浓度,细胞生存率不再降低(P>0.05,图2)。
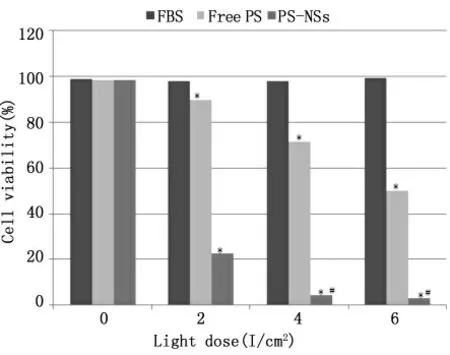
图1 光敏剂浓度为10 mg/L时,AGS细胞生存率的比较(*代表P<0.05,#代表P>0.05)Fig.1 Photosensitizer concentration of 10 mg/L,comparison about AGScell survival
3.2 纳米化-photosan和普通photosan对AGS细胞凋亡的影响
在实验参数(光照强度4 J/cm2,光敏剂剂量为10 mg/L)条件下,应用流式细胞仪检测各组细胞的凋亡率,FITC/PI双染流式图说明:PDT治疗后,纳米化光敏剂和普通光敏剂均发生了细胞凋亡,其中纳米化photosan实验组发生凋亡(69.15%)明显高于普通photosan(15.32%),见图3。
4 讨论
众所周知,光敏剂被肿瘤组织选择性吸收是光动力治疗的关键。但目前临床使用较多的光敏剂如血卟啉衍生物等卟啉类药物存在着一些缺点,最主要的是其最大吸收波长不在对人体组织透过率较佳的红光区,药效不尽理想,且皮肤光毒性大等,因而临床应用受到限制[6]。相比光敏剂的开发困难,各种类型光动力仪的开发则容易很多。因此,PDT未来的发展步伐极大程度上取决于光敏剂的研究进度。

图2 光照强度为4 J/cm2时,AGS细胞生存率的比较(*代表P<0.05,#代表P>0.05)Fig.2 Light dose for 4 J/cm2,comparison about AGS cell survival
由于大部分的光敏剂具有疏水性,这导致了两个不可避免的问题:1.药物在血液中的运输2.由于光敏剂的聚集导致较低的光物理性能,减少的光动力治疗的效果。因此,必须在体内通过某种转运系统把光敏剂送到治疗部位,这种转运系统要求简单但是有足够的效率实现高选择性,高光动力效应,并且有较低的副作用[7,8]。
介孔二氧化硅纳米粒子(mesoporous silica nanoparticles,简称MSNs)作为纳米药物载体具有独特的结构和显著的性能:巨大的比表面积(>900 m2·g-1)和孔体积(>1 cm3·g-1),规整的孔道,可调的孔径(2-10 nm),易于修饰的内外表面[9]。尤其是近些年来,MSNs的表面修饰及功能化取得了突破性进展:利用官能化的纳米粒子、高分子、蛋白质等作为“门卫”(Gatekeepers)来控制药物释放,显著表明MSNs在生物技术和生物医药等方面有许多潜在的应用价值[10]。

图3 流式结果Fig.3 The results of FCM test
Photosan是光动力治疗的经典光敏剂,由于硅基纳米分子具有独一无二的优势,如体积小并且孔隙均匀,具有无毒性和生物相容性,已经广泛的成为药物和基因载体的一种有效手段[11-14]我们以二氧化硅纳米颗粒作为载体,合成性质稳定并且具有组织相容性的新型纳米化光敏剂。多孔二氧化硅纳米粒子的结构不仅能作为疏水光敏剂的一个合适载体,并且氧气和生成的单态氧能够轻易渗透。这对光动力治疗是必须的[11,15]更重要的。而且,与传统的运载系统不同,以二氧化硅作为载体的光敏剂不需释放运载的药物[16]。
通过MTT测定AGS细胞的生存率,与普通photosan相比,纳米化-photosan杀伤细胞的作用更强。经光照后,超过一半的AGS细胞在普通photosan或纳米化-photosan浓度低至5 mg/L和10 mg/L被杀死。熊小强等[17]制备了聚乳酸一羟基乙酸共聚物(polylactide-co-glycolide,PLGA)包 裹meta-四-(间 羟基苯基)二氢卟吩[meta(tetrahydroxyphenyl)chlorin,m-THPC]的纳米型光敏剂,并在体外研究其对人肝癌细胞光动力治疗作用,结果也发现纳米化的光敏剂对肝癌细胞的杀伤能力高于普通光敏剂。光敏剂纳米化改善了普通光敏剂的光化学效能,提高了其水溶性,增加了肿瘤组织内有效光敏药物的浓度,从而提高肿瘤细胞的光动力治疗的效果。
5 结论
总之,纳米化-photosan和普通photosan均能杀伤细胞,纳米化的-photosan比普通photosan的杀伤作用要强。这说明将光敏剂固定在二氧化硅里,能够产生光学性质稳定,并且治疗效率高的光敏剂。更重要的是,提高了光敏剂在细胞中的转运效率。对于PDT治疗肿瘤,这可能代表一个创新的转运系统。
[1] FERLAY J,SHIN H,BRAY F,et al.Estimates of worldwide burden ofcancer in 2008:GLOBOCAN 2008[J].Int JCancer,2010,127(12):2893-2917.
[2] LI Weina,YANG Jiqing,LIU Yuansheng,et al.Photodynamic therapy and sonodynamic therapy[J].Chinese Journal of Medical Physics,27(2):1781-1784.
[3] SHAO HONGXIA,LIU RONG,WU QI,et al.Role of photosensitizer in photodynamic therapy[J].Medical Recapitulate,2008,14(22):3404-3407.
[4] ZHI PX,QINGH Z,GAOQL.Inorganic nanoparticles as carriers for efficient cellular delivery[J].Chemical Engineering Science,2006,61(3):1027-1040.
[5] ZHANGHaixia,WANGJiexin,LE Yuan.Review of liquid controlled precipitation process for preparation of pharmaceutical nano-/microparticles[J].Journal of Chemical Industry and Engineering(China),2010,61(7):1720-1733.
[6] PATRIAIA A,KRISTIAN B,KEITH A CENGEL,et al.Photodynamic therapy of cancer:An update[J].CA Cancer J Clin,2011,61:250-281.
[7] Y N KONAN,R GURNY E ALLEMANN.State of the art in the delivery of photosensitizers for photodynamic therapy.[J]Photochem Photobiol B,2002,66(2):89-106.
[8] M SONCIN,L POLO,E REDDI,et al.Rodgers:Effect of the delivery system on the biodistribution of Ge(IV)octabutoxyphthalocyanines in tumour-bearing mice[J].Cancer Lett,1995,89(1):101-106.
[9] LAI C Y,TREWYN B G,JEFTINIJA D M,et al.A mesoporous silica nanosphere-based carriersystem with chemically removable CdS nanoparticle caps for stimuli-responsive controlled release of neurotransmitters and drug molecules[J].JAm Chem Soc,2003,125(15):4451-4459.
[10] SLOWING I I,VIVERO-ESCOTO JL,WU CW,et al.Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers[J].Adv Drug Deliv Rev,2008,60(11):1278-1288.
[11] I ROY,T Y OHULCHANSKYY,H E PUDAVAR,et al.Ceramic-based nanoparticles entrapping water-insoluble photosensitizing anticancer drugs:a novel drug-carrier system for photodynamic therapy[J].Am Chem Soc,2003,125(26):7860-7865.
[12] D BREVET,M GARY-BOBO,L RAEHM,et al.Mannosetargeted mesoporous silica nanoparticles for photodynamic therapy[J].Chem Commun,2009,12:1475-1477.
[13] S H Cheng,CH Lee,CSYang,et al.Mesoporous silica nanoparticles functionalized with an oxygen-sensing probe for cell photodynamic therapy:potential cancer theranostics[J].Mater Chem,2009,19(9):1252-1257.
[14] H L TU,Y SLIN,H Y LIN,et al.In vitrostudies of functionalized mesoporous silica nanoparticles for photodynamic therapy[J].Adv Mater,2009,21(2):172-177.
[15] D BECHET,P COULEAUD,C FROCHOT,et al.Barberi-Heyob:Nanoparticles as vehicles for delivery of photodynamic therapy agents[J].Trends Biotechnol,2008,26(11):612-621.
[16] JW SNYDER,E SKOVSEN,JD LAMBERT,et al.Subcellular,time-resolved studies of singlet oxygen in single cells[J].Am Chem Soc,2005,127(42):14558-14559.
[17] 熊小强,陈汝福,汪峰,等.PLGA-m-THPC纳米型光敏剂的制备及其光动力治疗肝癌细胞的研究[J].中华普通外科学文献,2008,12(6):460-464.XIONG Xiaoqiang,CHEN Rufu,WANG Feng,et al.Production of PLGA-m-THPC nanoparticles and it’s photodynamic therapy on human hepatic cancer cell[J].Chinese Archives of General Surgery,2008,12(6):460-464.

