人血清白蛋白药物输运过程中的催化作用研究*
魏言春,宋佳兴
(华南师范大学生物光子学研究院激光生命科学研究所、暨激光生命科学教育部重点实验室,广东广州 510631)
许多小分子药物可以高亲和性地与血浆蛋白可逆结合。这种结合可以延长药物分子在血液中的循环寿命,有利于药物的输运,同时也减少了具有药理活性的游离药物分子的浓度,起到“缓释”作用[1,2]。另外,与蛋白质结合对于那些在血浆中溶解度非常低的药物的输运也尤为重要。但结合有时也会对药效的发挥产生不利的影响,甚至导致药物的变性和失效[3]。因此研究结合影响药物功能发挥的原因,不仅对于揭示体内的药物动力学问题,指导合理用药具有一定意义,同时对于进行药物分子设计、开发新药,也具有重要的指导意义。
药物和蛋白的结合虽然不是特异性的,不像受体配体结合那样专一,但蛋白和药物分子的结合都发生在相对稳定的结合部位并伴随一定程度的构象变化[4,5]。人血清白蛋白(HSA)是人血浆中含量最为丰富的蛋白质,是最为重要的药物结合蛋白。HSA分子包括三个结构上相似的功能域(domainⅠ,Ⅱ,Ⅲ),每个功能域又包含两个相似的螺旋结构的亚域(subdomainA和subdomainB),六个亚域聚集在一起,形成了一个不对称的心型分子[6,7]。研究表明药物在HSA上的结合部位有三个包括Ⅰ:吲哚及苯二氮卓结合部位;Ⅱ:华法令及阿扎丙宗结合部位;Ⅲ:洋地黄毒甙结合部位。
1992年,Carter在报道HSA的高分辨晶体结构的同时,也报道了几种配体与 HSA结合的情况[8]。他们指出HSA上的亚域ⅡA和ⅢA上的疏水腔是其主要的配体结合部位。HSA能够和许多药物结合,研究表明有些药物和HSA结合能够促进药物的传输和药效的发挥,但也有些药物会因为这种结合降低了药效。许多药物在进入人体后都会产生各种不良的反应,而不良的反应的原因至今许多仍不清楚[9]。
小分子探针海莹荧光素类似物FCLA是一种活性氧化学发光探针,它可以和活性氧反应并产生化学发光。报道表明HSA能够影响FCLA的氧化反应过程,显著增强化学发光强度[10,11]。蛋白和药物的相互作用可以通过结合影响药物作用强度和时间的长短,进而对药物的吸收、分布、排泄及其他方面产生重要作用,从而影响其生物活性的发挥,本研究中则运用可产生化学发光标示氧化反应状态的化学发光探针FCLA分析研究HSA对药物产生影响的可能机制,从而进一步揭示体内药物动力学过程。
1 材料和方法
1.1 试剂和仪器
PBS配制 FCLA(Tokyo Kasei Kogyo Co.,Tokyo,Japan)母液 100μmol/L HSA(purity 96% ,Sigma,St.Louis,Missouri)母 液 50μmol/L,光 敏 剂 (PPIX,50μmol/L,Aldrich Chemical Co.,Milwaukee,Wisconsin)置于-4℃冷藏待用。等温滴定量热仪ITC购于MicroCal,MA,USA,型号为VP-ITC.该仪器可测量的温度范围为2~80℃,最小可检测热效应0.125 μJ;等温数据由计算机自带的 origin 7.0软件进行分析、拟合。激光器为635 nm,semiconductor laser,NL-FBA-2.0-635,nLight Photonics Corporation,Vancouver,WA,购自美国。单光子计数仪 PMT,Model MP 952,PerkinElmer Optoelectronics,Wiesbaden,Germany。热电偶温度检测仪:51Ⅱ,Thermometer,Fluke,购自美国。
1.2 等温滴定
整个实验溶液温度为25℃展开实验。实验前对 600μL FCLA(50μmol/L)和 2mL 的 HSA(10μmol/L)脱气10 min;化合物泵入自动注射器中,向反应池(1.458mL)的HSA滴定.每次滴定10μL的化合物,共计30次滴定,首次滴定延迟60 s,两次滴定时间间隔为240 s,注射针搅拌速度为416 r/min。FCLA和HSA两者结合的热效应要扣除FCLA自身的稀释热。
1.3 HSA对FCLA氧化反应的增强作用
FCLA(10μmol/L)自氧化检测及加入 HSA(10μmol/L)后FCLA的自氧化光子计数测量。检测时间为1 min。配制光敏剂(PPIX,5μmol/L)、HSA(10μmol/L)、FCLA(10μmol/L)的溶液 2mL 在激光(635 nm,50 mW/cm2)的照射下用单光子计数仪(Filter,bandpass 530 nm)产生的化学发光。以及FCLA加入灭活的(10μmol/L,80℃水浴15 min)和新鲜的HSA(10μmol/L)的化学发光。检测时间1 s。实验重复三次。
1.4 HSA对FCLA氧化反应速度影响实验
将HSA母液稀释成不同浓度的溶液(0-2.5μmol/L)取 2mL分别至于玻璃平皿中。加入 100μmol/L FCLA 200μL,吹打均匀后立即检测光子强度。实验重复三次。
1.5 温度对催化氧化反应速度的影响
将 FCLA(10μmol/L)溶液和 FCLA(10μmol/L)+HSA(10μmol/L)溶液2mL分别置入玻璃平皿,用电加热器底部均匀加热,并同时热电偶温度检测仪测量温度。为了获得较低温度起点,溶液和玻璃皿均预冷至4℃。在加热的同时用光子计数器记录发光强度变化。
2 结果

图1 25℃时HSA与FCLA在缓冲液中结合的等温滴定图.FCLA,50μmol/L;HSA,10μmol/L;每次滴定10μL,共滴定30次Fig.1 Representative ITC profiles for the titration of FCLA(50μmol/L)into HSA(10μmol/L)at the temperature of 25 ℃ .Everytime 10μL for 30 times.
等温滴定量热法(ITC)是用于测量分子间相互作用的方法,已在生命科学、生物物理、物理化学等领域得到广泛的应用[12,13]。它独一无二的优势在于单次实验即可得出完整精确的热力学参数,包括结合位点数N、亲和常数Kb、焓变△H、熵变 T△S、吉布斯自由能△G。图1为原始滴定等温线,实验结果数据分别为,N:0.825;Kb:6.77 ×105 L mol-1;△H:5.707 kcal mol-1;T△S:13.877 kcal mol-1:△G:-5.661 kcal mol-1。数据表明25℃溶液中,HSA和FCLA两者在滴定混合中有一个自发结合的过程(△G<0)并且吸热,结合能的变化则证实了二者的结合。

图2 HSA对FCLA化学发光的增强作用。图A:FCLA(10μmol/L)自氧化及 HSA(10μmol/L)对FCLA的自氧化增强。图B:在光敏反应产生的大量活性氧(PPIX,5μmol/L)的刺激下FCLA的化学发光。灭活的和新鲜的HSA(10μmol/L)分别被加入到反应液中Fig.2 FCLA Chemiluminescence is enhanced by HSA.A:The self oxidation of FCLA(10μmol/L)and the enhancement by HSA(10μmol/L).B:Large amount of reactive oxygen is produced to excite chemiluminescence of FCLA.The active and inactive HSA is added in the solution
图2表明HSA显著地提高了FCLA的化学发光。实验数据表明,在有氧的条件下,单独的HSA不能发光,而单独的FCLA由于自氧化可以产生微弱的发光。但是当HSA加入FCLA溶液时其化学发光被显著地提高。表明FCLA自氧化反应的活化能阈值被HSA降低了。因此,HSA必然和FCLA存在一个物理结合反应,正是这种结合引起的相互作用最终导致FCLA氧化阈值的降低。
为了进一步验证和检测HSA和FCLA的结合效应,HSA经高温破坏了其生物活性结构,蛋白三级结构解散。图二B可以看到在FCLA强氧化实验中,有活性的HSA明显提高了化学发光的强度,而灭活的HSA反而降低了化学发光。
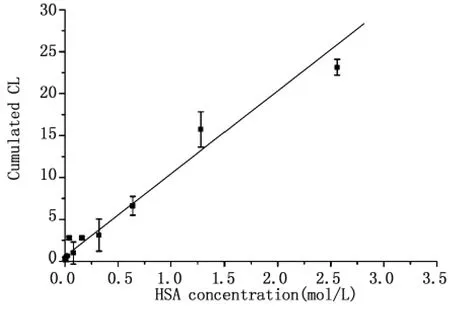
图3 HSA浓度对氧化反应速度影响。将不同浓度的HSA溶液(0-2.5μmol/L)2mL置于玻璃皿中,加入100μmol/L FCLA 200μL,检测光子强度。数据点用直线拟合 (R=0.92609)Fig.3 The influence of HSA concentration to oxidation reaction.2mL different HSA concentrations were transmitted in glass vessel,200μL FCLA(100μmol/L)was then added in.Emitted photons were detected.The data were fitted by linear(R=0.92609)
酶解过程是酶与底物结合后引起反应活化能的降低从促进了反应的进行。而酶催化的基础是和底物的结合,图二的结果恰恰表明了这种结合。根据酶催化理论,酶浓度对反应速度有影响:当反应系统中底物的浓度足够大时,酶促反应速度与酶浓度成正比,即ν=k[E]。因此我们考察了HSA浓度的变化对FCLA反应速度的影响。图三中,当反应系统中底物(FCLA)的浓度足够大时,FCLA的反应速度和HSA的浓度成正比关系。实验结果表明,作为生物活性大分子,白蛋白和FCLA结合后具有提高氧化反应速度的作用,类似酶的作用。
为了进一步验证HSA的这种类似酶催化的效应,又做了温度变化实验。图四表明温度变化对HSA催化FCLA化学反应存在影响。其中A图表明随着温度的升高,FCLA分子和氧分子趋向更易发生反应,因此发光增强,但在温度超过60℃时,可观测到化学发光强度的下降。加了HSA的实验显示了同样的结果,不同的是发光下降的温度阈值被延后了。图B显示了HSA增强发光的比率变化,虽然从绝对值上在低于60℃时反应是随着温度的增加而增加的,但比率结果显示在约20℃时HSA具有最高的相对催化反应效果。
3 讨论
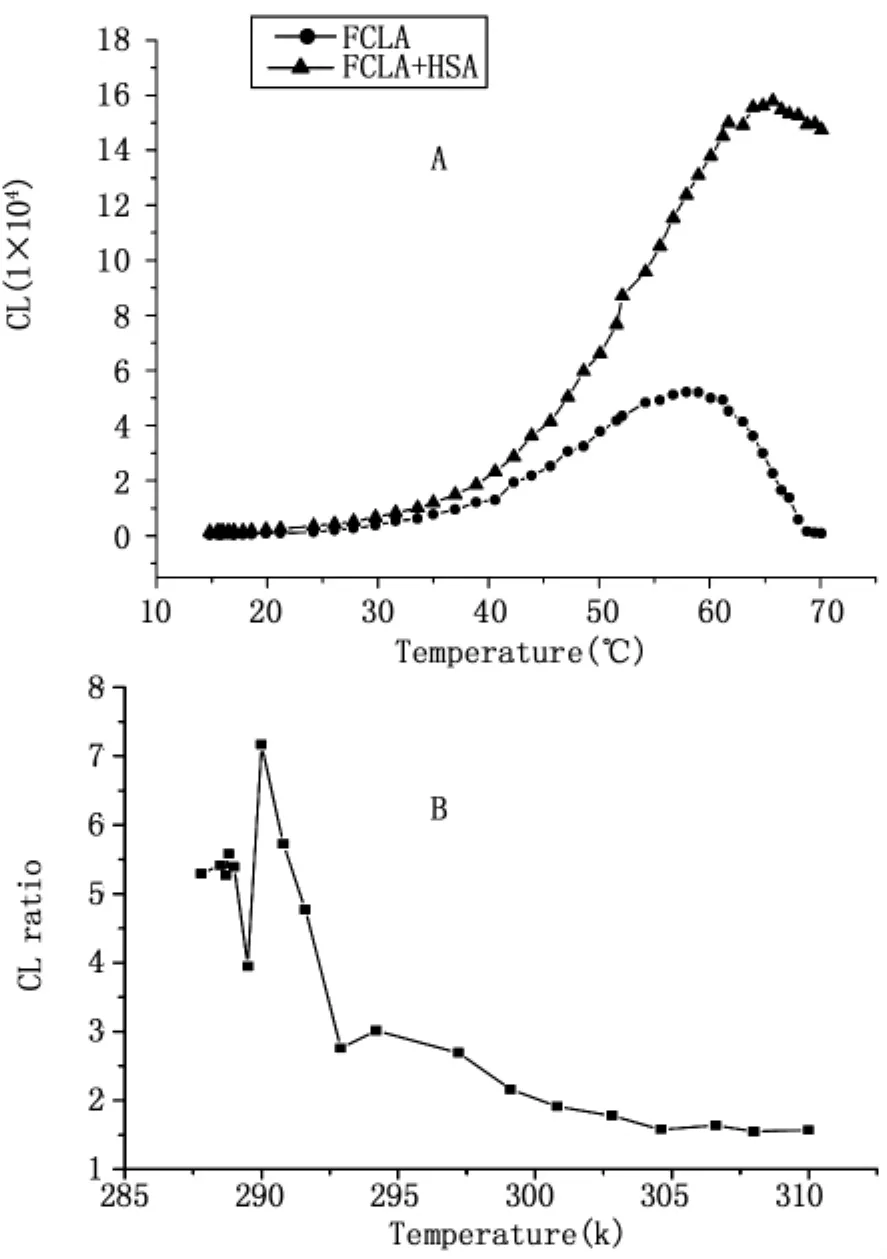
图4 温度对氧化产生化学发光的影响。A:化学发光强度与温度的关系;B:化学发光比率与温度的关系。将FCLA(10μmol/L)溶液和FCLA(10μmol/L)+HSA(10μmol/L)溶液 2mL 分别置入玻璃平皿,用电加热器底部均匀加热,并同时热电偶温度检测仪测量温度,同时用光子计数器计数Fig.4 A:The relation of chemiluminescence and temperature;B:The relation of chemiluminescence ratio and temperature.Temperature influences photons emitting.FCLA(10μmol/L)and FCLA(10μmol/L)+HSA(10μmol/L)solution(2mL)was transmitted into a glass vessel respectively.The vessel was evenly heated.The temperature and emitting photons were detected simultaneously
等温滴定实验结果表明FCLA和HSA是一个吸热的结合过程。同时由△H >0,△S>0及热容等数据进一步分析表明:疏水作用是两者结合的主要作用力。因此判断结合位点在HSA的疏水腔中。当高温破坏蛋白三级结构后,疏水腔消失,结合位点被破坏,对FCLA的发光增强作用消失。其原因可推测为:有活性的HSA三级结构完整,具有正常的药物结合功能区,因此能够和FCLA结合,而结合降低了氧化反应所需的活化能,进而促进了反应提高了化学发光的强度,而失活的HSA因为其三级结构的破坏,不但不能结合FCLA,反而由于大量裸露的还原性基团能够对活性氧产生猝灭反应,形成和FCLA的氧化竞争,因此抑制了化学发光。总之,结合是提高氧化反应的关键,类似于酶的催化,HSA在反应过程中起到了催化的作用,HSA和FCLA的结合降低了FCLA分子氧化反应所需的活化能,促进了反应的进行。
酶的催化对温度的依赖性很高,过高和过低的温度都会影响酶的催化效率。为了研究HSA对FCLA氧化反应类酶催化效果,又考察了温度对HSA催化作用的影响。实验结果表明随着温度的升高,分子的动能增加,FCLA分子和氧分子趋向更易发生反应,因此发光逐渐增强。但过高的温度(图中约为60℃以上)也同时导致FCLA激发态分子自身的碰撞加剧,从而导致物理猝灭的发生。但是加了HSA后,由于FCLA和大分子HSA的结合降低了FCLA分子碰撞的几率,因而可以在一定程度上抑制这种物理猝灭,使发光下降的温度阈值延后。HSA增强发光的比率变化表明在20℃左右时HSA具有最强的相对催化效果。另外,结果显示,HSA温度影响曲线也和真正的酶有所区别,对温度的敏感性没有酶那么强,这也是和HSA在体内的功能并非催化生化反应作用有关。
总之,实验结果表明,FCLA可以自发和HAS结合,通过HSA以类似酶作用的效果降低了FCLA分子氧化反应的活化能,导致了FCLA氧化反应的增强。利用结合物FCLA本身是化学发光探针,并借助单光子监测手段,我们实时高灵敏地观测到了这种影响。血液中的HSA是许多药物的载体,本研究表明,在设计和应用药物时,HSA和药物的结合输运可能会导致药物抗氧化或者抗药物交叉反应能力的降低,一些药物潜在的不良反应可能和这个原因有关。因此应该考虑避免这种结合导致的药物副作用,以提高药物的利用效率,防止副效应的产生。本研究对于提高药物的寿命和药效的发挥、降低药物不良反应,进行科学的药物分子设计等具有重要的指导意义。
[1]SUBRAMANIAN G M,FISCELLA M,LAMOUSÉ-SMITH A,et al.Albinterferon alpha-2b:a genetic fusion protein for the treatment of chronic hepatitis[J].C Nat Biotechnol,2007,25(12):1411-1419.
[2]MEYER M C,GUTTMAN D E.The binding of drugs by plasma proteins[J].J Pharm Sci,1968;57:895-918.
[3]ULRICH KRAGH-HANSEN,VICTOR TUAN GIAM CHUANG,MASAKI OTAGIRI.Practical aspects of the Ligand-Binding and enzymatic properties of human serum albumin Biol[J].Pharm Bull,2002,25(6)695-704.
[4]KRAGH HANSEN U.Molecular aspects of ligand binding to serum albumin[J].Pharmacol Rev,1981,33:17-53.
[5]DOCKAL M,CARTER D C,RUKER F.Conformational transitions of the three recombinant domains of human serum albumin depending on pH[J].J Biol Chem,2000,275:3042-3050.
[6]DOCKAL M,CARTER D C,RÜKER F.The three recombinant domains of human serum albumin structural characterization and ligand binding properties[J].J Biol Chem,1999;274:29303-29310.
[7]COLMENAREJO G.In silico prediction of drug2 binding strengths to human serum albumin[J].Med Res Rev,2003,23:275-301.
[8]HE XIAOMIN,CARTER D C.Atomic structure and chemistry of human serum albumin[J].Nature,1992,358(16):209.
[9]郭宾,李川.药物与血浆蛋白结合的药理学基础及其研究进展[J].中国临床药理学与治疗学,2005,10(3),241-253.GUO BIN,LI CHUAN.Progress in research and evaluation on drug2plasma protein binding in pharmacology[J].Chin J Clin Pharmacol Ther,2005,10(3),241-253.
[10]JING ZHOU,DA XING,QUN CHEN.Enhancement of fluoresceinyl cypridina luciferin analog chemiluminescence by HSA for singlet oxygen detection[J].Photochemistry and Photobiology,2006,82,4.1058-1064.
[11]Y C WEI,J ZHOU,D XING,et al.In vivo monitoring of singlet oxygen using delayed chemiluminescence during photodynamic therapy[J].J Biomed Opt,2007,12(1),014002.
[12]SUZANN M,FARIAL A T,DING D Y,et al.Biacore in structure-function relationships and thermodynamics[J].J Mol Biol,2000,300:321-337.
[13]AMIT A,CHANDRAMOULI B,NITI K,et al.Binding of berberine to human telomeric quadruplex-spectroscopic,calorimetric and molecular modeling studies[J].FEBS J,2008,275:3971-3983.

