低酸、低浓度硫酸亚铁酸性浸出氧化锰矿的研究
赵景龙,黄丽华
(广西有色金属集团有限公司,广西南宁 530022)
在湿法生产电解锰及锰系列产品的过程中,对低品位氧化锰矿来说,硫酸亚铁(FeSO4)是一种优良的还原浸出剂,其来源丰富,价格低廉;从其物理化学性质看,在生产过程中对周围环境、生产设施和操作者的负面影响基本没有;在锰的湿法浸出过程,对氧化锰矿粉中的锰浸出彻底,浸出率高,浸出速度快,各种文献报道和试验数据表明,相对氧化锰矿的其它还原浸出,无论是火法或是湿法,在可操作性、工艺运行和生产方面的综合成本上,显示出用硫酸亚铁浸取氧化锰矿具有强大的技术、环保、成本优势。
硫酸亚铁法浸出氧化锰矿的研究经历了较长时间完善发展,硫酸亚铁法浸出原理和硫铁矿法一样,都是利用铁的还原性来浸出氧化锰矿,硫酸亚铁在酸性溶液浸出氧化锰矿中作为还原剂,使氧化锰矿中的四价锰和高价锰还原成硫酸锰,用于生产硫酸锰或其它锰系产品。热力学计算表明,该浸出反应在常温下可自发进行,热力学推动力较大,反应为放热反应。综合国内发表的用硫酸亚铁浸出氧化锰矿的试验报告可知其反应条件大体为:反应温度20~95℃,初始硫酸浓度30~210 g/L,液固比3~8∶1,在搅拌下反应时间为0.5~1 h,二氧化锰浸出率可达95%以上。过程中铁起着一个重要的媒介作用,因此对铁电化学性质的充分认知,对氧化锰矿浸出过程的浸出、还原、分离、沉淀和利用有实质意义。
关于硫酸亚铁浸取氧化锰矿粉的研究,多数资料和文献着重研究的是浸出过程的高温度、高酸度、高浸出剂浓度、搅拌强度和粒度等主要影响因素和溶液中铁锰的如何分离,偏重于理论方面,应用于生产实践时,还存在着各种困难和障碍不能克服,未见有推广应用和实际生产。本文研究的是在固定条件下(即电解锰生产的自然条件下)低品位氧化锰矿全湿法还原浸出法的浸出部分,结合锰电解生产实际,着重研究主要影响因素低浸出剂浓度和低酸浓度对浸出过程的影响。
1 实验原理及过程控制
1.1 反应原理
氧化锰矿与硫酸亚铁之间可能产生以下3种反应:
在中性硫酸亚铁溶液中:

在微酸性硫酸亚铁溶液中:
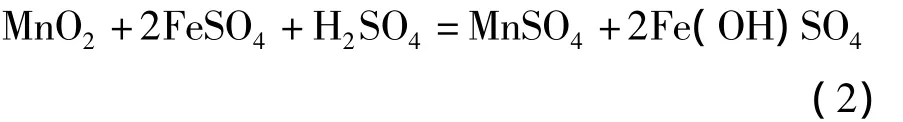
在有过量酸存在的硫酸亚铁溶液中:

1.2 试验原料
原矿为块状矿石,来源于广西来宾地区。经破碎后磨细筛分,粒度分别为:0.165 mm、0.125 mm、 0.106 mm、0.074 mm,分样装袋备用。因着重考察浸出,对原矿只进行了锰和铁元素含量的分析,结果见表1。

表1 原矿铁、锰元素含量分析
从原矿分析中可以看到,原矿中铁含量为10.46%,在锰矿中属于较高水平,必要时可以考虑综合回收利用。对于锰元素的分析,可以看出,绝大部分锰元素都分布在MnO2中,属于难浸锰矿。
1.3 反应过程控制的要求
电解锰正常生产时,阳极废液组成为 Mn:10~13 g/L;H+:32~36 g/L,决定了生产或实验的初始条件。由上述3个反应式可知,(1)式反应过程和生产过程有Fe(OH)3胶体沉淀的可能,影响后序过程固液分离,故反应必须在酸性条件下进行,即按反应(3)式进行,至少也要达到(2)式的条件要求。为了提高锰矿粉中锰的浸出率,防止有Fe(OH)3胶体沉淀,对浸出终点必须有要求,一般要求浸出终点溶液含Fe2+:3~8 g/L;H+:10~15 g/L。
1.4 浸出酸度的选择
反应(3)式简化为:

从上式和原子量计算可知一个质量浓度的铁,可浸出约0.5个质量浓度的锰,反应需要酸为一个质量浓度铁的1.75倍;固定条件下始酸取高限为: H+:36 g/L,终酸:H+:15 g/L,约最多有21 g/L左右的酸能够参与反应,即36-15=21 g/L;考虑到杂质钙、镁、铁的酸耗及原料组成的不确定性,酸不足时可考虑少量补充浓酸;原则上尽量不额外补酸,降低生产过程操作、反复调控的难度。
1.5 浸出剂浓度的选择
配入适当浓度的硫酸亚铁。因最多有21 g/L左右的酸能够参与反应,由反应(4)可知酸量为亚铁质量浓度的1.75倍,导出实际参与反应所需亚铁的浓度为12 g/L,为了提高锰矿粉中锰的浸出率,需过量Fe2+:3~8 g/L,即浸出剂中总的亚铁浓度为:15~20 g/L,取中间值按17 g/L计。最终浸出剂组成为Mn: 13 g/L;H+:36 g/L;Fe2+:17 g/L左右的混合液。
1.6 浸出步骤及实验结果
浸出实验在有效体积为2 L带有机械搅拌和热水浴的烧杯中进行,先将称好的硫酸亚铁用锰阳极废液按要求浓度配好,配好的浸出剂组成见表2。
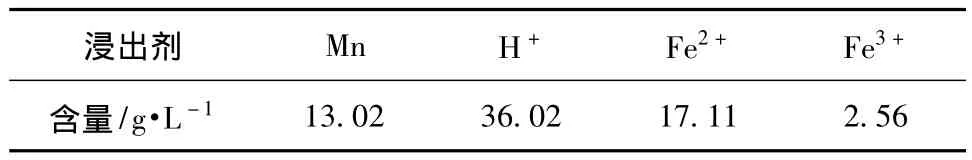
表2 浸出剂组成
投入锰矿粉81.5 g,室温浸出(约25℃),浸出2 h,液固比约25∶1,搅拌强度120~140 r/min,待反应达到预定时间后立即过滤,滤渣用蒸馏水洗涤1次后,最后浸出液和浸出渣分别取样分析,结果见表3、表4。

表3 低酸、低浓度硫酸亚铁浸出锰矿粉实验原始数据
浸出后液全铁含量稍高,可能是部分矿粉中的铁被溶出,增加了全铁量。另投料量少,浸出过程溶液锰浓度的增量有限,变化幅度不大,增加了检测难度,浸出终点是因分析误差,部分数据有出入。总体上浸出结果与实验预案的目标相符,达到了预期的效果和目的。
2 浸出过程主要影响因素的讨论
2.1 浸出剂浓度
浸出剂的浓度对氧化锰矿的浸出有很大影响,浸出剂的浓度与酸度又紧密关联。

表4 浸出后液及渣的分析结果
2.1.1 高浓度浸出剂的探讨
浸出剂的浓度越高,浸出锰的浓度和效率就越高,但相应参与反应所需的酸量就越多,呈线性增长,需在废液酸度的基础上补充大量的硫酸;电解锰生产正常条件下,一般要求锰合格新液含Mn2+:32~40 g/L,要达到此浓度,按反应(4)式及原子量计算可知,需浸出剂溶液含亚铁(Fe2+)达50~60 g/L,酸100 g/L以上,才能一次浸出达到要求;又因Fe2+浓度高,浸出时生成Fe3+的浓度也高,防止Fe3+的沉淀,就需维持更高浓度的酸,在如此高Fe2+浓度条件下进行浸出,实际生产中会有如下表现:
1.需额外补加大量的酸,增加生产成本;生产操作过程和体系酸平衡不易控制,后序生产过程需消耗大量的中和剂。
2.亚铁试剂消耗大,增加成本,在后序生产中产生大量的铁渣,铁不能综合利用。
3.生成过高浓度的Fe3+会不利后续操作和固液分离。在后序生产中,溶液中铁与锰的分离会很困难,要考虑选择何种分离铁的工艺,分离铁的过程费时、费力、费能耗,造成工艺及设备复杂、冗长。
2.1.2 低浓度浸出剂的探讨
电解锰废液一般:Mn2+10~13 g/L,H+32~36 g/L左右;选择浸出剂溶液含亚铁(Fe2+)15~20 g/L,是基于电解锰阳极废液中的酸含量,为使得低品位氧化锰矿能在酸性条件下,与硫酸亚铁按反应(3)式进行,至少也要达到反应(2)式的条件要求。为提高锰的浸出率和回收率,浸出终点时Fe2+含量保持3~8 g/L,即Fe2+5 g/L左右,不低于3 g/L,以提高浸出率。考虑到废液的含酸量,实际上每次浸出约最多有10~16 g/L浓度的Fe2+参与反应。
1.基本不用额外补加大量的酸,降低酸耗,降低生产成本。
2.选择合适的浸出还原工艺(此点极为重要),不用消耗亚铁试剂,降低生产成本,且不产生铁渣。
3.溶液中全铁总浓度相对低,溶液中铁与锰的分离,在后序生产过程中,通过适当的、较容易的工艺调整,即便使溶液中的铁全部以Fe(OH)3的形式沉淀,也可以较易分离,固液分离不困难。
2.2 浸出酸度
以电解锰阳极废液所含的酸为始酸,反应后的终酸保持10~15 g/L范围。总酸量主要为锰耗酸、杂质耗酸和终酸三者之和。
2.3 浸出温度
本实验做了25℃、50℃、75℃三组温度测试,三组实验反应速度皆快,因投料量小,体系溶液中前、后锰浓度增加的幅度差距变化不显著,实际上不易测定。通过终点锰浓度到达的用时测试,温度越高,用时越短,即升高温度有利于反应进行。
2.4 矿粉粒度的影响
在多相反应中,固相表面积的大小起着一种类似浓度的作用。固相表面积越大,浸出反应进行的速度就越快,在一定的温度和酸度下,固相分散度越高,锰的浸出率也越高。从表3实验数据显示,矿样的粒度对浸出的影响基本不大,实际生产时采用0.165~0.074 mm即可,粒度太细粉磨工序较麻烦且增加能耗,同时给后序浸出工序的抽滤带来困难,实验表明:采用矿粉过100目筛(0.165 mm),即可获得理想的浸出率,又利于后序抽滤。
2.5 浸出时间的影响
从表3实验数据显示,室温下浸出5 min内,锰的浸出率达到65%以上;10 min内锰的浸出率达到70%~80%;20 min内锰的浸出率达到90%以上,反应速度非常快。30 min后已基本浸出完毕,锰的浸出率增长趋于平缓,继续延长时间,并不能显著地提高锰的浸出率。
综上所述,在固定条件下,实验体系的液固比可达25∶1,体现出以下一些优缺点:
优点:浸出速度快,浸出彻底,浸出率高,反应时间短,常温浸出即可,无需加热。
缺点:(1)单次浸出,溶液中Mn2+的浓度约只能增长5~8 g/L;(2)液固比大,体现在生产实践时,则溶液周转量就大,稍显笨拙。
3 结论
1.本实验在较低的温度、酸度和浸出剂浓度条件下浸出,可以达到很高浸出率,实现快速浸出。
2.因电解锰生产的一些固有特征,如:(1)电解锰生产的原料,氧化锰矿的锰品位普遍比较低,高品位不易获得;(2)电解锰阳极废液的酸浓度比较低; (3)生产出的锰合格新液含Mn2+32~40 g/L也比较低;(4)从锰合格新液至阳极废液,约只有20~25 g/L的锰被电积出来,溶液循环量大等特点的局限,基本注定了用低品位氧化锰矿生产电解锰的浸出过程,必须是反复的、循序渐进的低酸、低浓度浸出剂浸出过程,一蹴而就达到所需的浓度不易操作,也是不现实的,必须在传统工艺思路上有所创新和突破,在工艺设备上有所改变和调整,才能以简单合理的工艺和较低的生产成本来实现。
3.通过本实验的浸出终点条件可知,该方法亦可应用于复杂氧化锰矿和深海锰结核的浸出过程,可同时浸出其中的锰、钴、镍和铜,有利于拓宽原料来源渠道和综合回收,给复杂锰矿的浸出打开一条切实可行路子。
4.因浸出条件温和,试剂消耗少,节能、减排、降本、增效的变化和增量幅度大,可根本改变目前用氧化锰矿生产电解金属锰困局的潜力巨大。
5.只对浸出还原造液部分做改动,增加还原设施和部分浸出设施,其它除杂、电解不变,老厂改造和新厂扩建皆适宜。
[1] 陈家镛.湿法冶金中铁的分离与利用[M].北京:冶金工业出版社,1991.
[2] 朱道荣.软锰矿-硫酸亚铁的酸性浸出[J].中国锰业,1992,(1):30-31.
[3] 李进中,钟宏.氧化锰矿还原浸出工艺技术研究进展[J]中国锰业,2011,(4):1-6.
[4] 李同庆.低品位软锰矿还原工艺技术与研究进展[J].中国锰业,2008,(2):4-14.
[5] 王德全,宋庆双,彭瑞东.用硫酸亚铁浸出同时沉淀铁矾法处理低品位锰矿[J].东北大学学报(自然科学版),1998,19(2): 168-170.
[6] 李同庆.电解二氧化锰生产技术的新进展[J].电池工业,2007,(1):178-183.
[7] 袁明亮,庄剑呜,陈荩.用硫酸亚铁渣直接浸出低品位软锰矿[J].矿产综合利用,1994,(6):6-9.
[8] 王德全,宋庆双.用硫酸亚铁浸出低品位锰矿[J].东北大学学报(自然科学版),1996,17(6):606-609.
[9] 彭荣华,李晓湘.用钛白副产的硫酸亚铁浸锰制备高纯二氧化锰[J].无机盐工业,2006,38(12):48-50.
[10] 张东方,田学达,欧阳国强,等.银锰矿中锰矿物的铁屑还原浸出工艺研究[J].中国锰业,2007,25(1):24-26.

