基于手持技术的“氧化还原反应”教学设计
蔡 阳
(扬州市新华中学 江苏 扬州 225009)
一、指导思想和理论依据
手持技术,又称传感技术,是由数据采集器、传感器和配套的软件组成的定量采集各种常见数据并能与计算机连接的实验技术系统。到目前为止,在化学领域的研究较多侧重于手持技术在化学研究性学习中的应用,而对于将手持技术整合于化学常规教学课堂( 尤其在新课程背景下) 的实践却相对罕见,这还没有完全发挥手持技术的优越性。[1]
本文将手持技术的应用融入到氧化还原反应这节课的教学中,将钢铁腐蚀过程中,氧气的参与过程形象具体地呈现在学生面前,探测出氧化还原反应发生过程中电子转移形成的微电流,给师生一个现代化的共同探讨问题的平台。
二、教材分析
氧化还原反应是高中化学的核心概念,贯穿于整个高中化学教学的始终。苏教版高中《化学1(必修)》教材中氧化还原反应这个概念在专题一第一单元 “物质的分类与转化” 这一节和专题二第一单元“氧化还原反应”这一节均有出现。这样的分散设置降低了学生的学习难度。本节课是讲解专题二第一单元“氧化还原反应”这一节的内容。学生已经初步接触了氧化还原反应的概念,但对于氧化还原反应的微观实质还不清楚。本节课要让学生系统性地把握这一概念,并引导学生深入理解氧化还原反应的实质。
三、教学目标
[知识与技能]
(1)知道氧化还原反应的特征和本质。
(2)能够判断氧化剂、还原剂、氧化产物、还原产物。
[过程与方法]
(1)通过设置问题情境、分析现象等活动,提高学生分析、联想、类比、迁移及概括的能力;
(2)通过实验进行思考和交流,提高实验探究的能力。
[情感态度与价值观]
(1)通过小组探究活动,体验科学探究的过程,感受科学探究的乐趣;
(2)认识氧化还原反应对生产、生活及科学研究的意义。
四、教学重、难点
[重点]
氧化还原反应的判断方法及实质。
[难点]
判断氧化剂、还原剂的规律及应用。
五、教学用具
溶氧传感器、微电流传感器、毫安电流传感器、数据采集器及配套软件、计算机、烧杯、玻璃棒、植物、锌片、铁粉、氯化钠溶液、硫酸铜溶液。
六、教学过程
[情境引入]
展示钢铁腐蚀的图片并提问:谁是腐蚀钢铁的罪魁祸首?
(由于钢铁腐蚀是缓慢平和的过程,氧气又无色无味,教师在这种情况下引入手持技术,检测铁生锈过程中氧气的变化,可以让学生真实地感受到氧气参与了反应。)
[实验]将两药匙铁粉倒入饱和食盐水中,搅拌,盖紧瓶塞,插入溶氧传感器,检测食盐水中氧气含量的变化。

图1 检测铁腐蚀过程中氧气含量变化的装置图

图2 铁腐蚀过程中氧气含量的变化曲线

图3 检测锌与硫酸铜溶液反应产生的电流的装置图

图4 锌与硫酸铜溶液反应产生的电流的变化曲线
学生通过观察曲线的变化,看到了氧气含量不断下降,这样得出的结论真实可靠。
[教师] 在这个过程中铁元素和氧元素的化合价分别发生了怎样的变化? 铁粉和氧气分别发生了什么反应?
[学生]铁元素的化合价升高,氧元素的化合价降低。
[教师总结]铁粉发生了氧化反应,氧气发生了还原反应。引出氧化反应和还原反应的概念。
[过渡] 化合价升高或者降低的根本原因是什么呢? 请同学们根据前面所学的原子核外电子排布的知识解答。
[学生] 是因为核外电子的得失导致化合价的变化,在刚才铁粉生锈的实验中是铁的电子转移给了氧。
[学生提问]既然电子发生了转移,是不是会有电流产生呢?
[教师解答]确实能产生电流,接下来就以同学们熟悉的锌与硫酸铜的反应为例,检测反应过程中的电流。(学生还没有学习原电池的知识,如果不将锌片和铜片组成原电池,产生的电流较小,电流表无法检测,所以本节课使用了电流传感器。)
[实验]将锌片打磨光亮,用电流传感器的夹子夹住,插入硫酸铜溶液中,观察图线的变化。
在实验中检测到约6mA 左右的电流,证实了学生的猜测。
[概念讲解]氧化还原反应的定义:有电子发生转移的化学反应。
用示意图表示锌与硫酸铜溶液反应的过程:
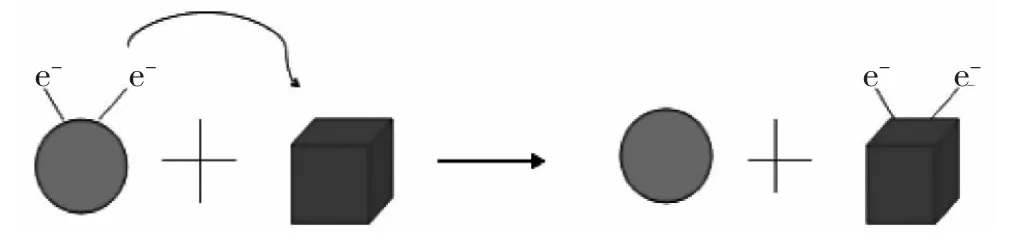
图5 锌与硫酸铜溶液反应的示意图
[教师]怎样用化学语言表示这个过程呢? (讲解双线桥的画法)

[概念讲解]
氧化剂:得到电子的物质。还原剂:失去电子的物质。
氧化产物:还原剂失去电子后的产物。还原产物:氧化剂得到电子后的产物。
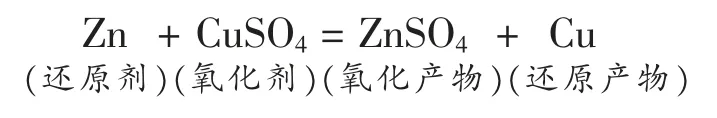
[师生共同总结]分析五步法:
1.标出化合价,判断是否是氧化还原反应;
2.找到得电子的物质(氧化剂)和失去电子的物质(还原剂);
3.找到对应的还原产物和氧化产物;
4.画出双线桥,标出电子得失;
5.检查电子得失是否相等。

情境 化学反应方程式CaCO3=高温CaO+CO2(非氧化还原反应)化学与工业:中国竖炉炼铁的化学史。CO2+C=高温2CO Fe2O3+3CO=高温2Fe+3CO2化学与生活:很多食品脱氧剂的主要成分是铁粉。2Fe + O2+ 2H2O=2Fe(OH)24Fe(OH)2+ O2+ 2H2O=4Fe(OH)3化学与技术:法医学中用鲁米诺试剂检测血迹,需用过氧化氢处理。化学与物理:神州九号发射升空的动力来源。2H2O2=催化剂O2+ 2H2O(氧化剂、还原剂是同一种物质)2H2+O2=2H2O (氧化产物、还原产物是同一种物质)形成过程。2H2S + SO2=3S +2H2O(氧化产物、还原产物是同一种物质)化学与地理:近期香港发现古代“超级火山”,火山喷发时硫磺的化学与生物:植物发电的原理。(光合作用是氧化还原反应,植物在光合作用的过程中有电子转移,经处理后可以发电。)[实验] 用传感器检测植物光合作用过程中产生的微电流。images/BZ_119_383_1297_960_1616.png图6 检测植物光合作用时产生的电流的装置图6CO2+ 6H2O= C6H12O6+ 6O2 0)(μA流电微-2-4-6-8-10images/BZ_119_397_1696_1006_1996.png0 10 20 30 40 50 60时间(s)图7 植物光合作用时产生的电流的变化曲线实验结果:检测到约7μA 的电流,学生进一步感受到氧化还原反应过程中有电子转移的事实。
[多角度链接]
(用不断变化的情境抓住注意力,拓展学生的视野,在情境中巩固新知。)
判断下列反应是否是氧化还原反应,若是氧化还原反应,请判断氧化剂、还原剂、氧化产物、还原产物。
[小组活动]
1.每组说出三种氧化还原反应,并且说明其存在或一种用途。
2.试着找出其中的氧化剂、还原剂、氧化产物、还原产物。
3.选择一个氧化还原反应,画出双线桥。
4.总结常见的氧化剂、还原剂有哪些。
[课后调查]
伊利诺斯大学细胞与发育生物学教授Martha Gillette 发表在Science 杂志上的最新研究成果:人体内的生物钟是受氧化还原反应控制的。请你课后借阅杂志或上网查阅,了解这项研究成果,并撰写一篇小论文。
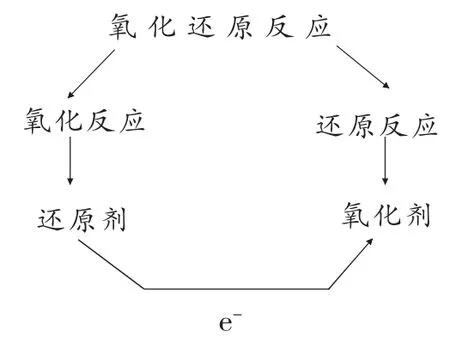
七、教学反思
本节课取得了较好的教学效果,手持技术给教学带来了如下便利:1.将模糊问题清晰化。钢铁腐蚀的过程中氧气是否真的参与,本来是难以证明的,往往是教师直接将答案告诉学生。利用溶氧传感器,可以让学生看到铁粉生锈的过程中,水中的含氧量不断减小的过程,清晰直观,更加可信。2.将微观问题可视化。如果不将锌片与铜片组成锌铜原电池,锌片与硫酸铜溶液反应时产生的电流是很小的,用普通电流表难以测出。但是使用锌铜原电池,学生以现有的知识又难以理解其中的原理。使用电流传感器直接测出电流,就无需使用锌铜原电池了。植物光合作用时产生的电流更小,如不使用电流传感器,根本无法测出电流。3.将传统问题现代化。原来做钢铁腐蚀的实验时,由于反应缓慢,需等待较长的时间,然后加入试剂检验产物,并且只能定性地说明问题。检验锌与硫酸铜反应的实验,必须将其组成锌铜原电池,形成较大的电流才能检测。使用传感器省去了这些麻烦,并且可导出数据或观察图线,将定性实验变成了定量实验,更加客观真实。
[1] 邓峰,钱扬义,钟映雪,谭显华,刘丽明,罗少娟.基于手持技术环境的化学课堂教学例析——冰醋酸电离过程实质的探究[J].化学教育,2009,(1):35
——以硫酸铜饱和溶液析出晶体的计算为例

