后“茶馆式”教学模式在元素周期表新课教学中的尝试——《元素周期表初探》教学设计
彭 捷
(上海市实验学校 上海 200125)
一、客观分析学情,寻找理论依托,明确教学思路
1. 设计思想
有学者曾做过实验,结论是:无论是什么学科,也无论是学科中的什么内容,总有一部分学生能自己学会并掌握。 只是学生不同、学科不同、内容不同、年级不同,学生能自己学会的比例会不一样,教师需要设计先学的时间、方式、方法也不一样。[1]笔者所在的是一所实验性示范性学校, 学生有较强的自学能力,加上两年多的化学学习,使得学生们对元素周期表已经有了不同程度的了解。
考虑到教学的高效性的,后茶馆式的教学模式主张“学生已经会的老师不用讲”,这就需要实施者确认哪些知识学生已经掌握那些还没有,同时解决部分人已掌握部分人不知道的知识应该怎样设计教学。 一种建议是把学生之间的差异作为资源[1],在集体的学习活动中达成既定的发展目标。
笔者在本课的设计中安排了学生高度参与的活动,一方面可以广泛激发学生兴趣,另一方面,灵活的信息给予方式诸如“坐席牌”“名片”为那些不怎么熟悉元素周期表的同学提供足够的支架性知识,包括元素的序号、名称、电子排布、相对原子量等。 此外,“元素找位置”活动中,参看邻座业已就座的元素也能获得不少新生成的支架性知识。
高度参与的学生活动可以促进学生头脑中相异构想的暴露。 教学前概念包含日常概念和错误概念,学生头脑中的科学前概念往往具有隐蔽性。 在日常教学中,相当一部分学生无法认识到课堂知识与他们自己观念间的差别, 不容易在新旧知识间重建认知结构,只能匆匆死记概念,应付考查。[2]
本课设计了日常生活化的教学情境,可以极大程度地调动学生的已有观念; 学生交流性质的活动,则能极大程度地暴露他们各自的相异构想;师生互动的话题讨论,更是着力于概念的转化与同化,利用复述和思辨实现短时记忆到长时记忆的转变,进而重建学生的认知结构。
2. 教学目标
知识与技能:初步掌握元素周期表的结构以及周期、族的概念;掌握同周期、主族元素的基本递变规律:核外电子排布、化合价、金属性非金属性的递变。
过程与方法:在扮演元素的过程中培养收集消化信息的能力;通过对元素原子结构、位置间的关系的推导,提升分析和推理能力。 分析、推断元素在周期表的位置、原子结构和元素典型化合价、金属非金属性之间的关系。
情感态度价值观:通过对元素周期律和元素周期表的关系的认识,应用辩证唯物主义观点分析现象和本质的关系。
3. 教学情境
“元素找位置”活动,学生“扮演”元素,桌椅构成元素周期表,元素在周期表中找到自己对应的座位。
4. 教学流程(见下图)
说明1:6 个话题重在复述与思辨,实现概念的转化与同化,完成三点规律性的理解掌握即可,具体实施时顺序可灵活调整。

注2:实际教学中,与6 个话题相似的话题也可由学生在讨论中提出,教师灵活引导,注意取舍。
二、 教学实施

图1 坐席牌示例

图2 元素“名片”示例

图3 镓和锗的“无名氏”名片
1. 课前准备
(1) 设计制作坐席牌,排放在每列第一桌。(图1)
(2) 根据1~20,31~36 号元素制作抽签用 “名片”(图2)。 31、32 号的镓和锗的名片制作成 “无名氏”(图3)。 37 至86 号的主族元素名牌直接摆放在桌上。
(3) 组织学生课前抽签,每人抽得一张预先设计好的“名片”。
(4) 根据元素周期表(主族元素)排布学生桌椅,其中He 对应座位的桌子用四轮小车代替(图4)。

图4 学生桌椅分布示意图
2. 引出主题
[开场白]今天我们以第一人称的方式学习元素周期表, 你们就是元素, 会思考的元素。
[宣布要求] 请同学们先研读自己的名片,扮演某一元素,在教室这个元素周期表中找到自己合理的座位。 可以参照列首的坐席牌,也可以参照周围已经就位的其他元素。
[学生活动]行动,推测、寻找自己的座位。
3. 话题讨论(按照规律编排元素周期表)
[话题1] 大家找到自己的位置一般参看了哪些信息?
[学生活动]议论:核外电子排布、左右元素的序号、相对原子质量、排头坐席牌的族序号、族俗称(氧族、碳族)……
[小结]同一行(列)的元素按原子序数从左到右(从上往下)递增;同一行的元素电子层数相同;同一列的元素最外层电子数相同。
[话题2]He 元素把自己放在了零族的第一个,大家觉得他的理由是什么? 如果放在Be 的前面有没道理呢?
[学生活动]回答:第一种形式中He 和Ne、Ar 排在一列,它们的性质相似。而第二种形式He 排在第二列,很显然He 和第二列的其它元素的性质截然不同。因此第一种形式更合理。
[话题3]有两张名片是“无名氏”的,它们在相当长一段时间里身份不明。 请问两位确定自己的位置了吗?
[学生回应]已经就坐,大家一起帮助判断坐的是否合理。 两个未知元素式量差不多! 氧化物化学式为R2O3的“无名氏”(图3 左)化合价和铝一样,应在Al下方,看式量应在As 之前。剩下的唯一空位则应安排另一位相对原子量为70 的“无名氏”(图3 右)。
[结合PPT 介绍]门捷列夫对类铝类硅的预言。展示:门捷列夫的手稿,用“? ”代替未知的镓和锗。
[学生活动]了解。 赞叹。
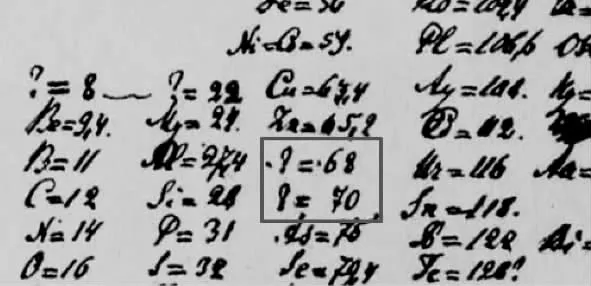
图5 门捷列夫手稿(框中为门捷列夫预测存在的镓和锗)
[话题4]20 号的Ca 右边坐着31 号的Ga, 从编号的连续性来看,中间还有10 个元素,我们 请 Ga、Ge、As、Se、Br、Kr 集 体 往 右 移 动十个位置, 把它们加进来怎么样?
[学生活动]反对,破坏了“同一列的元素最外层电子数相同”的结构。
[追问]两者兼顾,怎么操作?
[学生活动]议论、回答:前三行元素一并从中间分开。
[学生活动]参看课本附录《元素周期表》。
[讲解]行为周期,列为族。
[话题5] 大家根据化合价帮助Ga 找到了位置,已经就坐的所有元素, 你们的化合价有什么特点?
[学生活动]回答: 都等于排头坐席牌的族序数; 与最外层 电 子 数 有 关,1、2个的倾向于失电子,6、7 个的倾向于得电子。
[话题6]请在座的所有金属元素站起来。 有什么规律?
[学生活动]行动、观察、思考;描述:每一周期的左边是金属元素,右边是非金属元素,有的族都是金属元素,大多数族上面是非金属,下面是金属……
[实验视频]碱金属与水的反应。
[学生活动]感受:同族从上往下,金属性递增;同周期,金属性从左往右递减。
推断:金属性最强的元素位于周期表的左下角。
[分析] 我们的教室分为了两大阵营, 站着的金属,坐着的非金属,位于金属阵营腹地深处的Cs 拥有最强的金属性。
[提问]非金属性最强的元素是?
[学生活动]猜测:He? F?
确认:是F。 稀有气体化学性质惰性,不可能有强非金属性。
4. 师生共同总结归纳本课
门捷列夫编制了第一个元素周期表。
现代元素周期表行为周期,列为族。
元素周期律:
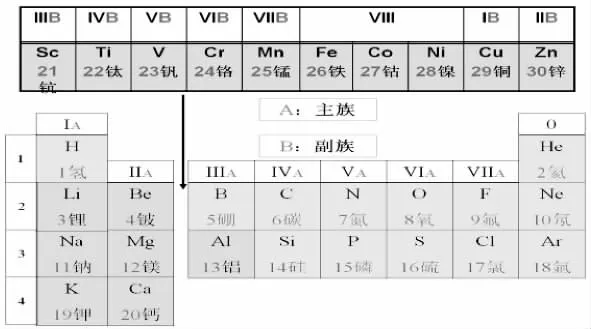
图6 21~30 号副族元素与主族元素的位置关系
(1) 元素周期表电子排布的特点:
同周期的元素电子层数相同;同族的元素最外层电子数相同;每一周期按照1~8 循环往复;
(2) 元素化合价的特点:
同族元素常见化合价基本相同,同周期元素的最高正价按照+1~+7 循环往复。
(3) 金属性非金属性的特点:
同族从上往下,金属性递增;同周期,金属性从左往右递减。
[拓展欣赏]其他形式的元素周期表
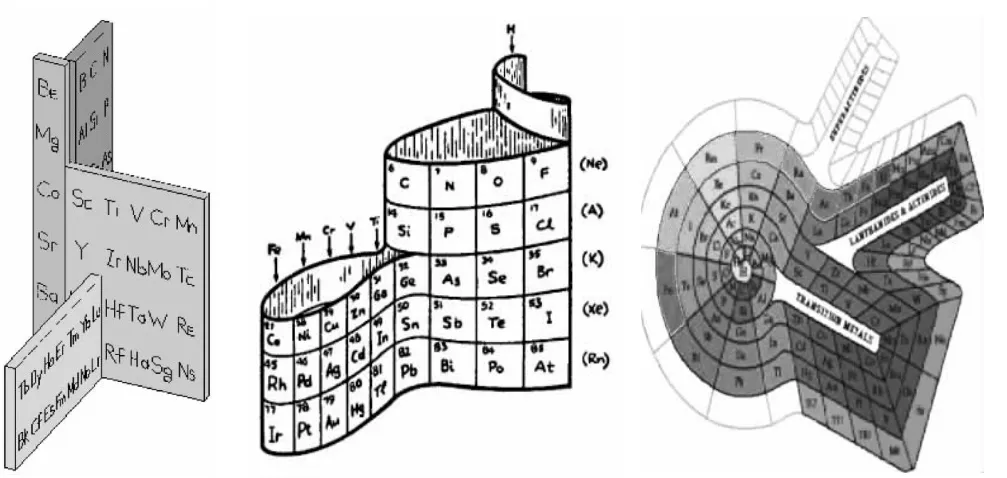
图7 其他形式的元素周期表
三、 教后感悟
学习者不是一张白纸, 化学概念原理类知识教学,不可忽视也无法回避学习者自身的前概念。 如果教师只是单向的展示正确概念,学生没有足够的机会联系相关前概念, 没有概念的顺应或同化过程发生,即便暂时记住了教师给予的正确概念,也极可能转眼忘掉,重归混乱,根本谈不上灵活运用。 概念教学总是需要不断暴露发现学生的前概念和相异构想,此时若能改变概念教学中高高在上的刻板形象,用贴近生活的活动放松学生心情,克服畏难情绪,必能获得学生的积极响应。
轻松的活动氛围,话题式的讨论互动,看似信马由缰,实则条分缕析。 实际教学时的轻快自由,离不开充分的准备和来自经验的预判。 6 个主要话题已经以教师导引的顺序预备好了, 但是无所谓最佳顺序,临时生成的话题,只要不偏离主题,往往效果更佳。 这就要求教师不能忘记本节课目标递变性规律的三个要点:核外电子排布、化合价、金属性非金属性的递变。最终由教师引导落实。 教师的身份:学习材料的准备者、活动的组织者、现场引导者。 课堂的主角是学生,由学生和学习材料发生相互作用。
[感谢浦东新区教育发展研究院郑胤飞老师给予笔者的悉心指导! ]
[1] 张人利. 后“茶馆式”教学(五)——另一种课堂教学的备课[J]. 现代教学,2011,(3):40~42
[2] 王祖浩等. 化学教育心理学[M]. 南宁:广西教育出版社,2007

