面向临床肿瘤诊疗决策的多模态医学影像融合
齐守良 岳 勇 辛 军 康 雁*(东北大学中荷生物医学与信息工程学院,沈阳 089)
2(中国医科大学附属盛京医院放射科,沈阳110004)
引言
恶性肿瘤是危害人类健康的严重疾病。目前,全世界患有恶性肿瘤的病人约1 400万,我国每年癌症发病人数约180 万至200 万,死亡140 万至150万,每死亡5 人中即有1 人死于癌症。据WHO 预测,2030 年癌症致死人数将达到1 310 万[1]。癌症已经成为新世纪人类健康的巨大威胁和全球最大的公共卫生问题。
早期诊断和准确疗效评估,可以显著降低肿瘤致死率。在1990 ~2008 年期间,美国的癌症死亡率男性降低了22.9%,女性降低了15.3%[2]。其中,乳腺癌、结肠癌和前列腺癌致死率降低的主要原因就是早期诊断和有效治疗[3-5]。
肿瘤生物机理复杂,种类繁多,使得“四定”(定位、定性、定量和定期)诊断时仍十分困难。肿瘤是一个多因素、多基因参与、多阶段的复杂渐进过程。多因素不仅包括外因,还有遗传因素、免疫状态等宿主因素[6]。肿瘤种类繁多,仅肝部就存在良性肝脏肿瘤、原发性肝脏恶性肿瘤和转移性肝癌。其中,良性肝脏病变又包括血管瘤、局灶性结节性增生(FNH)、肝腺瘤等;原发性肝脏恶性肿瘤可源自肝细胞、肝管上皮细胞、内皮细胞以及结缔组织[7]。一些肿瘤(如FNH 和肝腺瘤)在放射学检查上表现类似,常常难以分辨。然而,由于推荐治疗方式迥然不同,正确鉴别非常重要。
新抗癌药物的不断涌现,使得以前的治疗评估标准(response evaluation criteria in solid tumor,RECIST)面临挑战。RECIST 依靠肿瘤形态尺寸变化进行评估,而新药物(如抗血管生长因子)不主动破坏肿瘤细胞,不杀死细胞,而是抑制肿瘤生长,因而无法准确地早期评估疗效,也就无法有效治疗。
1 现代生物医学影像技术特点分析
现代生物医学影像技术具有实时、在体和无创(或微创)等优点,能够在时间和空间上多尺度地研究生理和病理过程,并以非常直观的方式(seeing is believing)展现出来[8]。其中,时间尺度从毫秒级的蛋白质结合到数年的癌症,空间尺度从分子到细胞、组织和器官[9],从而,现代生物医学影像技术被广泛应用于肿瘤管理的各个阶段,包括预防、筛查、活检导引、分级、预后、治疗方案规划、手术导引、治疗反映、复发和缓解等[10]。
目前,临床上存在多种模态的影像技术,主要包括计算机断层成像(computer tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、超声成像(ultrasonography,US)和正电子发射型断层成像(positron emission tomography,PET)等。
不同模态医学影像为肿瘤管理提供大量有价值的定量化信息。这些信息可以分成两类。
1.1 形态和结构信息
1)肿瘤几何形态,如体积大小、表面光滑度(曲率)、肿瘤区域的纹理特征等,主要医学影像模态有CT、MRI 和US[11-12]。
2)肿瘤血管形态,如分叉和直径等,据此判定狭窄和肿瘤良恶性,主要医学影像模态包括CT 血管 造 影 成 像(CTA)[13]、MR 血 管 造 影 成 像(MRA)[14]和超声造影成像(USA)。
1.2 代谢和功能信息
1)葡萄糖代谢,常使用18F-FDG PET[15],定量化参数是标准摄取值(standard uptake value,SUV)。
2)血流灌注,注入照影剂后对选定层面连续多次扫描,获得每一像素的时间密度曲线(time-density curve,TDC),以此为输入利用不同数学模型计算血流量(blood flow,BF)、血容量(blood volume,BV)、平均通过时间(mean transit time,MTT)和毛细血管通透性(Permeability surface,PS)等参数,常使用动态对比增强(dynamic contrast enhanced,DCE)CT、DCE-MRI 和DCE-PET[16]。
3)水分子扩散,MRI 扩散加权成像(diffusion weighted imaging,DWI)方法,即DWI-MRI,可以测量病灶的表观扩散系数(apparent diffusion coefficient,ADC)、相对扩散异性(relative anisotropy,RA)和各向扩散异性(fractional anisotropy,FA)[17-20]等,从而获得水分子的扩散信息。
4)弹性模量,成像方法包括MR 弹性成像(magnetic resonance elastography,MRE)[21-23]和超声弹性成像(ultrasonic elastography,UE)[24]。
上述信息均在一定程度上反映了Hanahan 和Weinberg[25]提出的肿瘤8 大标志,即复制失控、促血管生长、逃脱凋亡、自身有足够的生长信号、对生长控制剂不敏感、改变能量代谢模式和逃避免疫破坏。
遗憾的是,任何单一模态的成像方式也都存在自身的优点和缺陷。(1)CT 反映的是人体不同位置X 射线质量衰减系数,对密度差异较大的组织效果较好,空间和时间分辨率高(可达0.33 mm 各向同性和75 ms),扫描速度快(完成全胸扫描仅需0.6 s)[26];缺点在于有电离辐射,并且软组织对比差,良恶性肿瘤的特异性较差。(2)MRI 反映的是不同体素的磁学特性(如磁化强度、T2 和T1 时间、共振频率等),其优点在于无电离辐射、软组织对比高、可实现多参数的结构和功能成像;缺点是比CT 速度略慢、有时难以定量化。(3)US 利用声阻抗不同在界面上形成反射,具有成本低、无电离辐射、软组织对比高和血流速度测量准确方便等优势;缺点是对操作者技术水平依赖性强、可重复性差、空间分辨率低和对骨骼、脑部和肺部无法成像等。(4)PET采用正电子核素标记化合物作为示踪剂,通过病灶对示踪剂的摄取了解病灶功能代谢状态,它是一种功能分子成像,敏感度和特异性高;缺点在于空间分辨率差和成本高。
2 多模态医学影像融合
值得注意的是,即使拥有如此多模态的医学影像技术,如此大量的结构和功能信息,临床医生在实现肿瘤的“四定”诊断和疗效评估时仍十分困难。最根本的原因在于,所获取的信息都是孤立和分离的,而肿瘤是一种多因素的发展型疾病,单一时间点、单一模态的医学影像检查,无法揭示其本质、发生和发展过程。以肝部疾病为例(如图1),存在正常、肝部囊肿、血管瘤和肝细胞癌等多种状态需要鉴别,可利用CT、MRI、超声成像和PET 等多种模态的医学成像技术,从而获得病灶形态学参数、血管形态学参数、灌注参数、代谢参数、表观扩散系数、杨氏模量等参数。但是,这些信息参数之间是孤立和分离的,此时的诊断和疗效评估只能是基于先验知识的主观推测。不同模态医学图像信息融合,可以实现信息互补和交叉验证,因而成为揭示肿瘤机理、实现早期准确诊断和有效治疗的必然选择[9-10,27]。
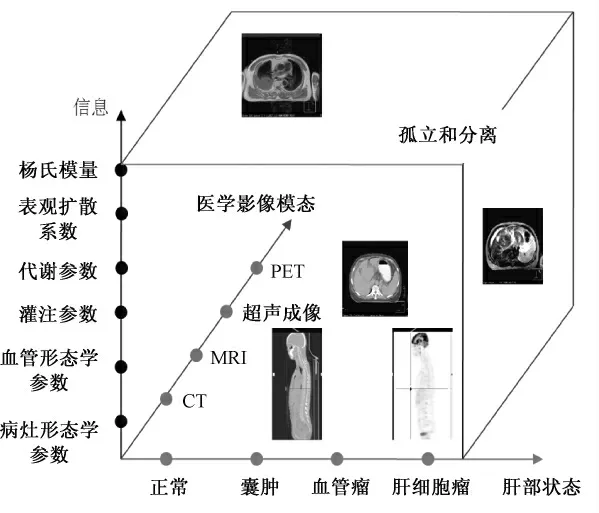
图1 孤立和分离的多模态医学影像信息(以肝部疾病为例)Fig. 1 Isolated and separated medical multimodalities image information (as an example by liver diseases)
多模态医学图像融合属于信息融合的范畴[28-29]。在肿瘤诊疗过程中,是将两种或几种图像信息检测、结合、相关、估计和组合,以达到对肿瘤状态(位置、良恶性、类别、分期和治疗反应)的定量化精确评估,从而指导临床决策。
图像融合的前提是它们已经在空间上相互对齐,即配准(Registration)或匹配完毕。所以,配准技术是图像融合过程中的一项关键步骤[30-31]。融合是方法和手段,最终目的是应用到临床,指导和帮助肿瘤诊疗过程中的决策。下面,针对配准、多模态医学图像融合方法及其在肿瘤诊疗中的应用,分别综述国内外研究现状及发展动态。
2.1 图像配准
本质上,医学图像配准属于一种病态的非线性(多参数、多峰值)最优化问题,即在各种变换空间中寻找一种特定的最优变换,使得一幅或多幅图像变换后与另一幅达到某种意义上的最佳匹配[32]。病态是指有些配准过程中重合区域小,这一点无法改变;非线性是指器官形变和运动一般都是非线性的。
配准的基本过程包括:特征空间、几何变换、相似度测量和最优化。提取图像特征信息构成特征空间,然后根据特征空间确定一种空间变换,使一幅图像经过该变化后能够达到所定义的相似度。在确定变化的过程中,需要采取一定的搜索策略,即优化措施,以使得相似性测度更快、更好地达到最优值。其中,特征空间可以是特征点、特征曲线或曲面、整幅图像的所有像素(如互信息方法[33]);几何变换有刚性变化、仿射变化、投影变化和非线性变化;相似性测度有距离测度、相似度和概率测度3 种;优化算法包括Powell 法、下山单纯形法、梯度下降法、遗传算法、模拟退火法、几何Hash 法、半穷尽搜索法等[34]。
刚性配准表达较为简单,但仅适用于如脑部等一些变形小的区域配准[35]。而非线性(或弹性)配准更适用大变形的情况,如胸部等[36]。Holden[37]综述了非刚性配准方法,将它们分成3 类:(1)基于物理模型(利用连续性机理微分方程描述)的,包括线弹性、粘性流体和光流方法;(2)基于基函数扩展的,包括径向基函数、B-样条曲线、小波方法;(3)基于变换限制的,包括可逆一致性、拓扑保存和微分元胞变换方法。
目前,非刚性配准仍然是国内外研究的热点。国内,李雄飞等[38]全面综述了2010 年前的配准研究。最近,张少敏等[39]提出了融合梯度信息的最小生成树医学图像配准算法,王安娜等改进了光流算法[40],李文龙等实现了自由变形3D 非刚性配准[41],文献[42-43]将有限元和多目标交叉变异粒子群算法用于非线性配准。国际上,空间编码互信息、熵相似性、双树复小波变换也已用于非线性配准[44-46]。
目前研究中存在的主要问题:(1)配准准确性(或精度)不够;(2)局部最优化问题使得配准失败;(3)鲁棒性不强(普适性差);(4)速度慢。其背后的原因在于初始位置差,这主要是由两点导致的:(1)对大致位置没有先验知识;(2)重合区域小。非线性配准面临的主要困难:(1)选择合适的形变模型;(2)非线性配准算法的验证;(3)计算成本高。
2.2 图像融合方法
图像融合一般可分成3 个层次:像素级、特征级和决策级图像融合[30-31,47-48]。
2.2.1 像素级图像融合
像素级图像融合是在基础数据层次上的融合,准确性高。它可分为基于空间域和变换域的图像融合,后者是研究热点[47-49]。空间域方法包括加权融合和主成分分析、假彩色图像融合(如图2 所示的PET-CT 和PET-MRI 图像融合)、基于调制的图像融合、基于统计的图像融合和基于神经网络的图像融合。变换域主要是基于多尺度分解的图像融合算法,包括传统的金字塔变换的图像融合和基于离散小波变换(discrete wavelet transform,DWT)的图像融合[50]。文献[51]全面综述了2006 年前的融合研究工作。国内也有一些基于小波变换的融合和硬件加速的研究工作[52-55]。
2.2.2 特征级融合
特征级融合是对预处理和特征提取后的信息(如边缘、形状、纹理和区域)进行综合和处理。这一层次的研究工作较少,仅有文献[56-57]。特征级融合实际上是使得信息降维,帮助医生将不同感兴趣区域提取出来,在同一图像上显示。
2.2.3 决策级图像融合
决策级融合是最高层次的信息融合。主要基于认知模型的方法,需要大型数据库和专家决策系统进行分析、推理、识别和判决。目前,仅限于少量研究[58-59]。
可见,目前几乎所有融合都是像素级的。但是,这种方法需要考虑待融合医学图像的本质,否则融合结果在信息上有意义,但在医学上无意义。它起到的作用仅限于便于医生观察,提供定性而非定量的诊断。如果配准不正确或存在大变形时,往往制造混乱。所以,临床医生更加需要特征级和决策级融合,从而降低信息维度和复杂度,获取更多先验知识,拓展诊断能力。这里,特征级参数既包括提取的结构特征(如肿瘤体积、表面积和生长速率等),又包括功能特性(如灌注、ADC、弹性模量和SUV 等),并且它们都是定量化的。这些参数组成一个特征向量,发现特征向量的分类函数即可形成治疗过程中的决策模型。
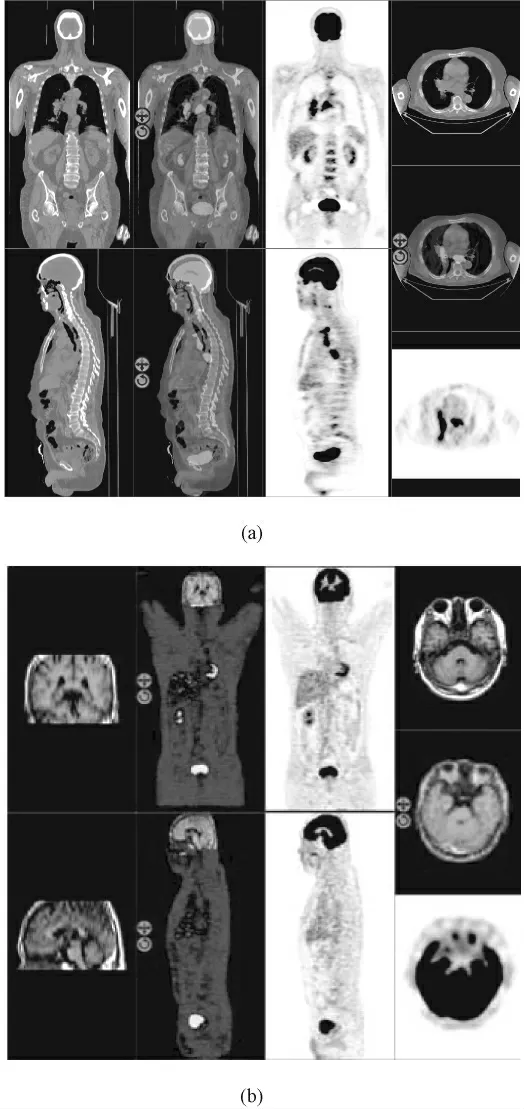
图2 像素级图像融合结果[49]。(a)PET/CT 融合;(b)PET/MRI 融合Fig. 2 Image fusion results at the pixel level[49]. (a)PET/CT fusion;(b)PET/MRI fusion
2.3 临床肿瘤诊疗应用
目前,多模态医学影像融合在临床肿瘤诊疗过程中最典型的应用是PET/CT 融合。PET/CT 最初由Pittsburgh 大 学 于1998 引 入[60],紧 接 着 由GE、CTI、Siemens 和Phillips 等公司推出商用机[61]。至2007 年,共有1 700 多台PET/CT 在全世界运行,2006 年美国的PET/CT 或PET 扫描人数高达150万人[62]。Czernin 等总结了包括1 960 名病人的30项研究,结果表明PET/CT 的平均诊断准确率比单独使用PET 和CT 提高了约10%[63]。通过整合功能和结构信息,PET/CT 在肿瘤诊断、分级、化疗方案规划和治疗反映监测等方面正发挥重大作用[62]。
2011 年6 月美国FDA 批准了第一台PET/MRI系统(Siemens)。并且,已经被证实在某些方面准确度高于PET/CT[64]。PET/CT 和PET/MRI 一体机的出现和迅猛发展,充分说明多模态图像融合在临床上有强烈的需求。
在检测肿瘤治疗反映时,需要MRI-DWI 和MRI-T2 的融合、ADC 和灌注的融合[24-25]。图像导引手术(IGS)也需要图像的配准和融合[65-66]。
在肿瘤放疗方面,据国际原子能机构报告,先进的III 级3D 适形放疗,即精度最高的强度调制放疗或立体放疗,应采用包含CT/MRI 或PET 配准的图像系统[67]。当CT/MRI 图像配准后,即可将MRI软组织对比优势与CT 几何安全性和电子密度信息结合起来[68]。
3 结语与展望
综上所述,不同模态医学图像信息融合,可以实现信息互补和交叉验证,是揭示肿瘤机理、实现早期准确诊断和有效治疗的必然选择。对此领域的研究不仅具有重大科学意义,也具有非常重要的临床应用价值。
另外,就国内外研究的现状分析可知,对于肿瘤诊疗过程中多模态医学影像融合的研究刚刚开始。存在以下几个方面的重要问题亟待回答:(1)各种模态医学影像信息之间的关系是怎样的?是相互独立和互补的,还是相互关联的?如果存在关联,那么关联规则是什么?为什么?(2)在肿瘤诊断和治疗反映评估过程中,哪两种或几种图像信息的融合,能提供最高的诊断精确度和特异性?即肿瘤状态的分类函数是什么?(3)可否将上述信息融合,建立一个疾病诊断模型,为临床决策提供支持和指导?综合利用信息融合[69]、知识发现[70]和临床决策[71]的理论和方法,是一种回答上述问题的可行思路。
因此,面向临床诊疗中的决策支持,综合利用影像科学、医学、信息融合和知识发现的理论与方法,研究多模态医学影像中结构和功能信息之间的融合问题具有重要意义。从多模态医学影像中提取病灶的结构和功能信息,构建特征参数数据库。在此基础上利用相关性分析,挖掘不同信息间的关联规则,通过分类方法得出疾病的分类模型。最后,将上述过程中发现的知识融合,建立面向临床决策的疾病诊断模型。经验证后内嵌到一个多模态医学影像融合平台中,用于前期临床。以期综合利用融合信息,全面揭示肿瘤的发生和发展过程,帮助实现肿瘤的早期诊断和有效治疗。
[1] Ferlay J,Shin HR,Bray F,et al. Globocan 2008:Cancer incidence and mortality worldwide[EB/OL]. http://globocan.iarc.fr/ 2011 -12 -14/2013 -04 -10.
[2] Siegel R,Naishadham D,Jemal A. Cancer statistics 2012[J].CA:A Cancer Journal for Clinicians,2012,62(1):10 -29.
[3] Berry DA,Cronin KA,Plevritis SK,et al. Effect of screening and adjuvant therapy on mortality from breast cancer [J],The New England Journal of Medicine,2005,353(17):1784 -1792.
[4] Edwards BK,Ward E,Kohler BA,et al. Annual report to the nation on the status of cancer,1975 -2006,featuring colorectal cancer trends and impact of interventions (risk factors,screening,and treatment)to reduce future rates[J]. Cancer,2010,116(3):544 -573.
[5] Etzioni R,Tsodikov A,Mariotto A,et al. Quantifying the role of PSA screening in the US prostate cancer mortality decline[J].Cancer Causes Control,2008,19(2):175 -181.
[6] 汤钊猷,现代肿瘤学[M]. (第3 版). 上海:复旦大学出版社,2011:1 -11.
[7] 赵平,蔡坚强,主译,肝胆肿瘤[M]. 北京:中国医药科技出版社,2010:1 -75.
[8] Willyard C. Imaging:seeing is believing [J]. Nature,2011,480(7377):52 -53.
[9] Ehman RL,Hendee WR,Welch MJ. Blueprint for imaging in biomedical research[J],Radiology,2007,244(1):12 -27.
[10] Fass L. Imaging and cancer:a review[J]. Molecular Oncology,2008,2(2):115 -152.
[11] Asselin MC,O’Connor JPB,Boellaard R,et al. Quantifying heterogeneity in human tumors using MRI and PET [J].European Journal of Cancer,2012,48(4):447 -455.
[12] Waldman AD,Jackson A,Price SJ,et al. Quantitative imaging biomarkers in neuro-oncology [J]. Nature Review Clinical Oncology,2009,6(8):445 -454.
[13] Pannu HK,Jacobs JE,Lai S,et al. Coronary CT angiography with 64 MDCT:assessment of vessel visibility [J]. AJR American Journal of Roentgenology,2006,187(1):119 -126.
[14] Lee MW,Lee JM,Lee JY,et al. Preoperative evaluation of the hepatic vascular anatomy in living liver donors:comparison of CT angiography and MR angiography [J]. Journal of Magnetic Resonance Imaging,2006,24(5):1081 -1087.
[15] Hoh CK. Clinical use of FDG PET[J.]Nuclear Medicine and Biology,2007,34(7):737 -742.
[16] Marcus CD,Marcus VL,Cucu C,et al. Imaging techniques to evaluate the response to treatment in oncology:current standards and perspectives[J]. Critical Reviews in Oncology/Hematology,2009,72(3):217 -238.
[17] Bihan DL,Mangin JF,Poupon C,et al. Diffusion tensor imaging:concepts and applications [J]. Journal of Magnetic Resonance Imaging,2001,13(4):534 -546.
[18] Koh DM,Collins DJ. Diffusion - weighted MRI in the body:applications and challenges in oncology[J]. America Journal of Radiology,2007,188(6):1622 -1635.
[19] Patterson DM,Padhani AR,Collins D. Technology insight:water diffusion MRI-a potential new biomarker of response of cancer therapy[J]. Nature Clinical Practice Oncology,2008,5(4):220 -233.
[20] Chandarana H,Taouli B. Diffusion and perfusion imaging of the liver[J]. European Journal of Radiology,2010,76(3):348 -358.
[21] Mariappan YK,Glaser KJ,Ehman RL. Magnetic resonance elastography:a review [J]. Clinical anatomy,2010,23(5):497 -511.
[22] Ieva AD, Grizzi F, Rognone E. Magnetic resonance elastography:a general overview of its current and future applications in brain imaging[J]. Neurosurgery Review,2010,33(2):137 -145.
[23] Hines CDG,Bley TA,Lindstrom MJ. Repeatability of magnetic resonance elastography for quantification of hepatic stiffness[J].Journal of Magnetic Resonance Imaging,2010,31(3):725 -731.
[24] Li YY,Wang XM,Zhang YX,et al. Ultrasonic elastography in clinical quantitative assessment of fatty liver[J]. World Journal of Gastroenterolgy,2010,16(37):4733 -4737.
[25] Hanahan D,Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell,2011,144(3):646 -674.
[26] www.siemens.com/healthcare
[27] 陈武凡,秦安,姜少峰,等. 医学图像分析的现状与展望[J].中国生物医学工程学报,2008,27(2):175 -181.
[28] 何友,信息融合理论及应用[M]. 北京:电子工业出版社,2010:1 -19.
[29] 韩崇昭,朱洪艳,段战胜,等. 多源信息融合[M]. 北京:清华大学出版社,2010:1 -14.
[30] 田捷,包尚联,周明全. 医学影像处理与分析[M]. 北京:电子工业出版社,2003:96 -114.
[31] 康晓东. 医学影像图像处理[M]. 北京:人民卫生出版社,2009:169 -195.
[32] Pluim JPW,Maintz JBA,Viergever MA. Mutual-informationbased registration of medical images:a survey [J]. IEEE Transaction on Medical Imaging,2003,22(8):986 -1004.
[33] Zitova B,Flusser J. Image registration methods:a survey[J].Image and Vision Computing,2003,21(11):997 -1000.
[34] Slomak PJ,Baum RP. Multimodality image registration with software:state-of-the-art [J]. European Journal of Nuclear Medicine Imaging,2009,36(S1):44 -55.
[35] Mattes D,Haynor DR,Vesselle H,et al. PET-CT image registration in the chest using free-form deformations[J]. IEEE Transaction on Medical Imaging,2003,22(1):120 -128.
[36] Holden M. A review of geometric transformations for nonrigid body registration [J]. IEEE Transaction on Medical Imaging,2008,27(1):111 -127.
[37] Rueckert D,Aljabar P. Nonrigid registration of medical images:theory,methods,and applications[J]. IEEE Signal Processing Magazine,2010,27(4):113 -119.
[38] 李雄飞,张存利,李鸿鹏. 医学图像配准技术进展[J]. 计算机科学,2010,37(7):27 -33.
[39] 张少敏,支力佳,赵大哲. 融合梯度信息的最小生成树医学图像配准[J]. 东北大学学报(自然科学版),2010,31(10):1393 -1396.
[40] 王安娜,薛嗣麟,俞跃. 基于改进光流场模型的医学图像配准方法[J].中国图象图形学报,2010,15(2):328 -333.
[41] 李文龙,程流泉,李军. 基于自由形变的3D 非线性医学图像配准[J]. 中国医学影像技术,2011,27(12):2536 -2540.
[42] 党建武,孙滕,王阳萍. 互信息驱动的有限元医学图像配准方法[J]. 计算机应用,2011,31(3):733 -736.
[43] 许鸿奎,江铭炎,杨明强. 基于多目标交叉变异粒子群算法的多模医学图像非刚性配准[J]. 中国生物医学工程学报,2011,30(2):232 -239.
[44] Zhang XH,Arridge S,Hawkes DJ,et al. A nonrigid registration framework using spatially encoded mutual information and freeform deformations[J]. IEEE Transaction on Medical Imaging,2011,30(10):1819 -1828.
[45] Khader M,Hamza AB. Nonrigid Image registration using an entropic similarity [J]. IEEE Transaction on Information Technology in Biomedicine,2011,15(5):681 -690.
[46] Chen HZ,Kingsbury N. Efficient registration of nonrigid 3-D bodies[J]. IEEE Transaction on Image Processing,2012,21(1):262 -272.
[47] 敬忠良,肖刚,李振华. 图像融合-理论与应用[M]. 北京:高等教育出版社,2007:47 -96.
[48] 那彦,焦李成,基于多分辨率分析理论的图像融合方法[M].西安:西安电子科技大学出版社,2007:83 -93.
[49] Pan XG,Wang MY,Liu JR,et al. An automatic registration approach for whole body PET images and head MR images[C]// Chuo KC.,eds. The 5th International Conference on Bioinformatics and Biomedical Engineering,New York:Curran Associates,2011:1 -4.
[50] Pajares G,Cruz JM. A wavelet-based image fusion tutorial[J].Pattern Recognition,2004,37:1855 -1872.
[51] Goshtasby AA,Nikolov S. Image fusion:advances in the state of the art[J]. Information Fusion,2007,8:114 -118.
[52] 陈爽,姜威. 基于DT-2DWT 的医学图像融合算法[J]. 山东大学学报(工学版),2008,38(1):33 -35.
[53] 胡俊峰,唐鹤云,钱建生. 基于小波变换医学图像融合算法的对比分析[J]. 中国生物医学工程学报,2011,30(2):196 -205.
[54] 王安娜,吴洁,张新华. 一种基于正交小波包分解和2v-SVM的医学图像融合新方法[J]. 小型微型计算机系统,2007,28(12):2268 -2271.
[55] 徐显,杨杰. 基于图形处理器硬件加速的高精度医学图像融合算法[J]. 上海交通大学学报,2010,44(2):248 -251.
[56] Piella G. A general framework for multiresolution image fusion:from pixels to regions [J]. Information Fusion,2003,4(4):259 -280.
[57] Lewis JJ,Callaghan RJO,Nikolov SG.,et al. Pixel-and regionbased image fusion with complex wavelets [J]. Information Fusion,2007,8(2):119 -130.
[58] Shapiro LG,Haralick RM. Organization of relational models for scene analysis [J]. IEEE Transaction on Pattern Analysis Machine Intelligence,1982,4(6):595 -602.
[59] Williams ML,Wilson RC,Hancock ER. Deterministic search for relational graph matching [J]. Pattern Recognition,1999,32(7):1255 -1516.
[60] Beyer T,Townsend DW,Brun T,et al. A combined PET/CT scanner for clinical oncology[J]. Journal of Nuclear Medicine,2001,41(8):1369 -1379.
[61] Townsend DW,Carney JPJ,Yap JT,et al. PET/CT today and tomorrow[J]. Journal of Nuclear Medicine,2004,45(S1):4-14.
[62] Weber WA,Crosu AL,Czernin J. Technology insight:advances in molecular imaging and an appraisal of PET/CT scanning[J].Nature Clinical Practice Oncology,2007,5(3):220 -233.
[63] Czernin J,Auerbach MA,Schelbert HR. Improvement in cancer staging with PET/CT:literature-based evidence as of September 2006[J]. Journal of Nuclear Medicine,2007,48(S1):78 -88.
[64] Antoch G,Bockisch A. Combined PET/MRI:a new dimension in whole-body oncology imaging?[J]. European Journal of Nuclear Medicine Molecular Imaging,2009,36(S1):113 -120.
[65] Raabe A. Laser surface scanning for patient registration in intracranial image-guided surgery[J]. Neurosurgery,2002,54(4):797 -803.
[66] Audette MA,Siddiqi K,Ferrie FP,et al. An integrated rangesensing, segmentation and registration framework for the characterization of intra-surgical brain deformation in imageguided surgery [J]. Computer Vision Image Understanding,2003,89(2 -3):226 -251.
[67] Huq S, Mayles P, Besa C, et al. Transition from 2-D radiotherapy to 3-D conformal and intensity-modulated radiotherapy,IAEA-TECDOC-1588,International Atomic Energy Agency,2008.
[68] Brunt JN. Computer Tomography- Magnetic Resonance Image registration in radiotherapy treatment planning [J]. Clinical Oncology,2010,22(8):688 -697.
[69] Demongeot J,Wendling JB,Mattes J,et al. Multiscale modeling and imaging:the challenges of biocomplexity [J]. Proceedings of the IEEE,2003,91(10):1723 -1737.
[70] 史忠植. 知识发现[M]. 北京:清华大学出版社,2011. 1 -19.
[71] 曹建文. 临床决策分析-哈佛版[M]. 上海:复旦大学出版社,2005:1 -10.

