N'-取代苯基-2 -苯并噻唑磺酰脲类化合物的合成
贾心语,苗 娜,马丽娟,钱 宇,巴俊杰* ,程卯生
(1. 内蒙古医科大学 药学院,内蒙古 呼和浩特010110;2. 沈阳药科大学 制药工程学院,辽宁 沈阳110016;3. 内蒙古巴彦淖尔市医院,内蒙古 临河015002)
磺酰脲类化合物是一类具有很高生物活性的化合物,在农药和医药领域都有非常广泛的应用。在农药领域,磺酰脲类化合物是一类超高效、绿色环保、高选择性的除草剂,如氯磺隆、甲磺隆、烟嘧磺隆等。在医药领域,磺酰脲类药物广泛用于非胰岛素依赖型糖尿病的治疗,如甲苯磺丁脲、格列美脲、格列吡嗪等[1-2]。近年来,国外研究者发现二芳基磺酰脲类化合物在治疗恶性肿瘤中,不论是在体外还是在体内都表现出强的抗肿瘤活性,尤其适用于结肠癌、卵巢癌、肺癌等实体肿瘤的治疗,而且无明显的多药耐药性。目前,已有磺氯苯脲(sulofenur)和LY295501 两个药物(图1)进入临床研究。二芳基磺酰脲类化合物的抗肿瘤活性研究正在成为抗肿瘤药物研究的热点之一[3-5]。此类药物的作用机制是:药物与微管蛋白的位点结合,阻止微管蛋白的聚合反应,抑制有丝分裂过程,最后导致细胞死亡[6]。本合成研究保留具有抗肿瘤活性的二芳基磺酰脲类化合物的基本结构(即一个芳环磺酰基、一个脲桥和一个取代芳基),依据文献[7 -8]报道的在脲基芳环上连接中性的、亲脂性的、体积较小的基团(如Cl、Br、F、Me、Et 等)能增强抗肿瘤活性,又依据苯并噻唑衍生物具有抗肿瘤活性[9-10],设计、合成了一系列N'-取代苯基-2-苯并噻唑磺酰脲类化合物,以期从中筛选出活性更好的抗肿瘤化合物。

Figure 1 The structures of sulofenur and LY295501
1 合成路线
首先,2-巯基苯并噻唑的钠盐,经次氯酸钠和氨水的弱氧化、氨化得到2-苯并噻唑次磺酰胺,2-苯并噻唑次磺酰胺再经高锰酸钾氧化得到2-苯并噻唑磺酰胺;其次,各种取代苯胺与三光气(BTC)反应制得一系列取代苯异氰酸酯;最后,2-苯并噻唑磺酰胺与各种取代苯异氰酸酯反应,得到N'-取代苯基-2-苯并噻唑磺酰脲类化合物6a-6o。目标化合物的合成路线见图2。
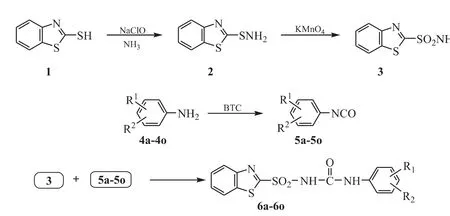
Figure 2 The synthetic route to target compounds 6a-6o
2 合成实验
熔点采用XT4A 型数字显微熔点仪测定,温度未经校正;pH 值采用E -201 -C 型酸度计测定;1H-NMR 采用Bruker 500 型核磁共振仪测定;IR 采用Nicolet Impact 410 型红外光谱仪测定;MS 采用Finnigan Lcq Advantage Max 型质谱仪测定。所用试剂均为分析纯。
2.1 2-苯并噻唑次磺酰胺(2)的合成[11]
将装有搅拌子、滴液漏斗和温度计的三口烧瓶置于冰盐浴中,加入浓氨水112 mL。将氢氧化钠2 g(0.05 mol)溶于28 mL 蒸馏水中,再将2-巯基苯并噻唑7 g(0.042 mol)溶于上述氢氧化钠溶液中,置于其中一个滴液漏斗中。另一个滴液漏斗中加入有效氯含量大于100 g·L-1的次氯酸钠溶液48 mL。在0 ~5 ℃下,两个滴液漏斗中的溶液同时滴加到浓氨水中,1 h 内滴加完毕,继续搅拌1 h。减压抽滤,蒸馏水洗涤,干燥,得浅黄色固体,用1,2-二氯乙烷重结晶,得无色晶体5.7 g,收率74.6%,mp 137 ~138 ℃。
2.2 2-苯并噻唑磺酰胺(3)的合成[11]
在装有搅拌子、滴液漏斗、温度计和pH 计电极的四口烧瓶中加入2-苯并噻唑次磺酰胺(2)6.8 g(0.037 mol)、丙酮83 mL 和蒸馏水40 mL,搅拌均匀。在一个滴液漏斗中加入50 g·L-1高锰酸钾溶液155 mL。在另一个滴液漏斗中加入0.5 mol·L-1的硫酸溶液48 mL。于28 ~30 ℃下,滴加高锰酸钾溶液,同时适当滴加硫酸溶液使pH 值保持在8.0 ~8.1,在2 h 内滴加完毕,继续搅拌反应1 h。加入活性炭0.5 g 和0.5 mol·L-1的氢氧化钠溶液11 mL,再搅拌0.5 h。反应完毕,减压抽滤,除去二氧化锰和活性炭,滤液旋蒸,除去丙酮,剩余液用盐酸酸化,即有固体析出,减压抽滤,干燥,得浅黄色固体,用1,2-二氯乙烷重结晶,得无色晶体6.4 g,收率80.8%,mp 176 ~177 ℃。
2.3 取代苯异氰酸酯(5a ~5o)的合成通法[12]
在装有搅拌子、滴液漏斗、温度计、回流冷凝管和尾气吸收装置的三口烧瓶中加入三光气5.92 g(0.02 mol)、甲苯20 mL,搅拌使溶解,置于冰水浴中。向滴液漏斗中加入取代苯胺0.04 mol、甲苯10 mL 和三乙胺3 ~5 滴,混合均匀,将其滴入三光气的甲苯溶液中,0.5 h 滴完。移去冰水浴,室温下搅拌反应1 h,再加热回流至反应液变澄清。常压蒸出甲苯,减压蒸馏得各种取代苯异氰酸酯。苯异氰酸酯(5a):无色液体3.7 g,收率77.7%,bp 70 ℃/1995 Pa;对氯苯异氰酸酯(5b):浅黄色液体4.8 g,收率78.4%,bp 94 ℃/2660 Pa;邻氯苯异氰酸酯(5c):浅黄色液体4.4 g,收率71.9%,bp 102 ℃/3325 Pa;间氯苯异氰酸酯(5d):浅黄色液体4.1 g,收率67.0%,bp 94 ℃/1995 Pa;3,4-二氯苯异氰酸酯(5e):浅黄色液体5.5 g,收率73.1%,bp 131 ℃/1995 Pa;2,4-二氯苯异氰酸酯(5f):浅黄色液体5.6 g,收率74.5%,bp 126 ℃/1596 Pa;2,5-二氯苯异氰酸酯(5g):浅黄色液体5.3 g,收率70.5%,bp 122 ℃/1995 Pa;对甲基苯异氰酸酯(5h):无色液体3.9 g,收率73.3%,bp 94 ℃/1995 Pa;邻甲基苯异氰酸酯(5i):无色液体3.6 g,收率67.7%,bp 84 ℃/3990 Pa;间甲基苯异氰酸酯(5j):无色液体3.8 g,收率71.4%,bp 92 ℃/2660 Pa;对溴苯异氰酸酯(5k):浅黄色液体5.7 g,收率72.3%,bp 110 ℃/1995 Pa;邻溴苯异氰酸酯(5l):浅黄色液体5.4 g,收率68.5%,bp 106 ℃/1995 Pa;间溴苯异氰酸酯(5m):浅黄色液体6.0 g,收率76.1%,bp 101 ℃/1330 Pa;对甲氧基苯异氰酸酯(5n):浅黄色液体4.4 g,收率73.8%,bp 128 ℃/1330 Pa;3-氯-4-甲基苯异氰酸酯(5o):浅黄色液体5.1 g,收率76.3%,bp 114 ℃/1330 Pa。
2.4 N'-取代苯基-2-苯并噻唑磺酰脲类化合物(6a ~6o)的合成通法[13]
在装有搅拌子、滴液漏斗、回流冷凝管的三口烧瓶中加入2-苯并噻唑磺酰胺(3)0.6 g(3 mmol)和丙酮20 mL,室温下搅拌1 h。加入碳酸钾1.25 g(9 mmol),加热回流1 h,再滴加由取代苯异氰酸酯4.5 mmol 和丙酮10 mL 组成的溶液,约0.5 h 滴加完毕,回流至TLC 显示2-苯并噻唑磺酰胺(3)完全消失,反应约6 h。冷却,抽滤得固体,烘干后加水25 mL 溶解,再抽滤得滤液,冰水冷却下用盐酸酸化至pH≈1,得固体,用蒸馏水洗涤至中性,干燥,得相应产物6a ~6o(除6b 外其余为未见文献报道的新化合物)。合成的15 个目标化合物的结构、熔点、收率和波谱数据见表1。
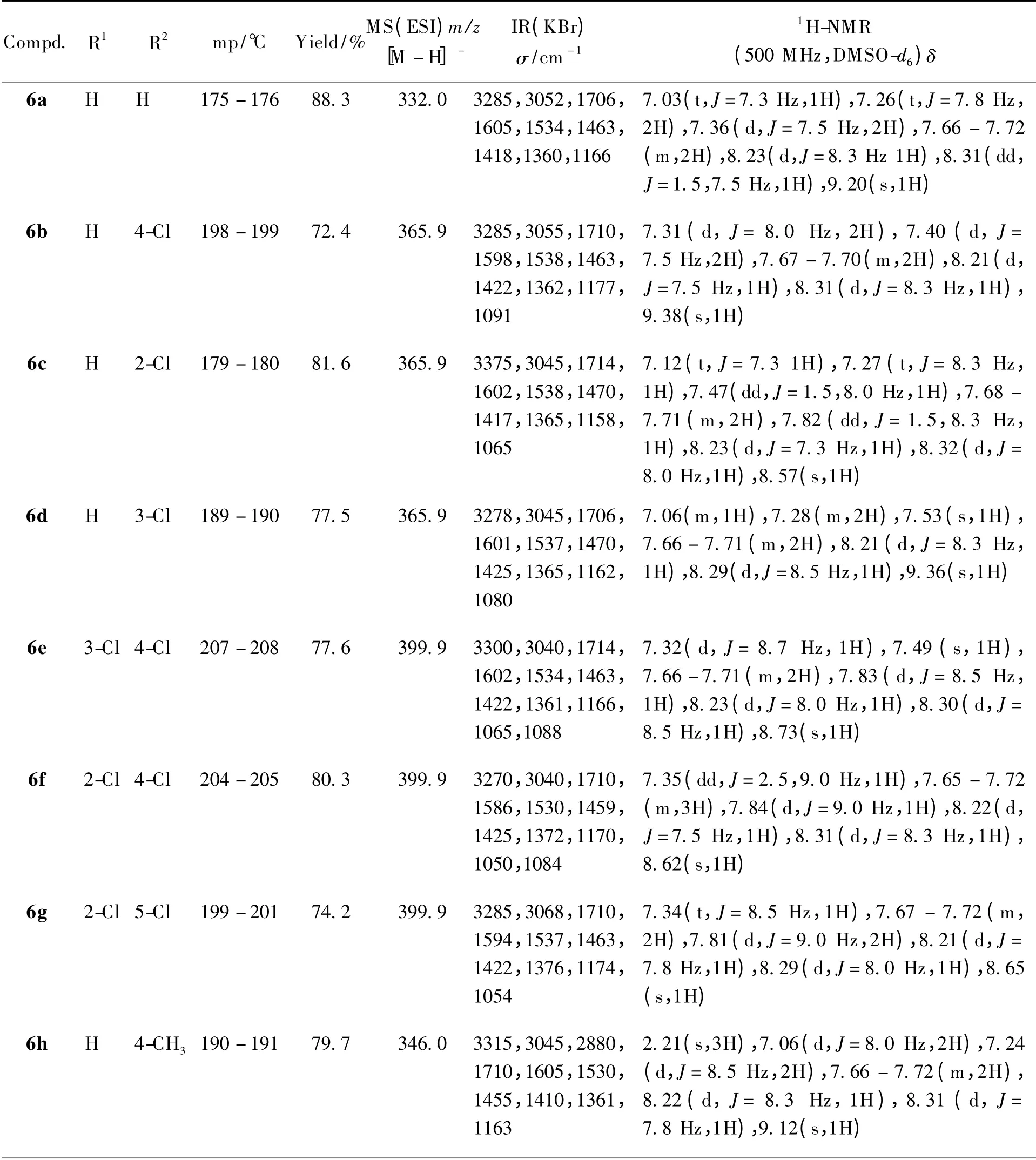
Table 1 The structures,physical properties and spectral data of target compounds
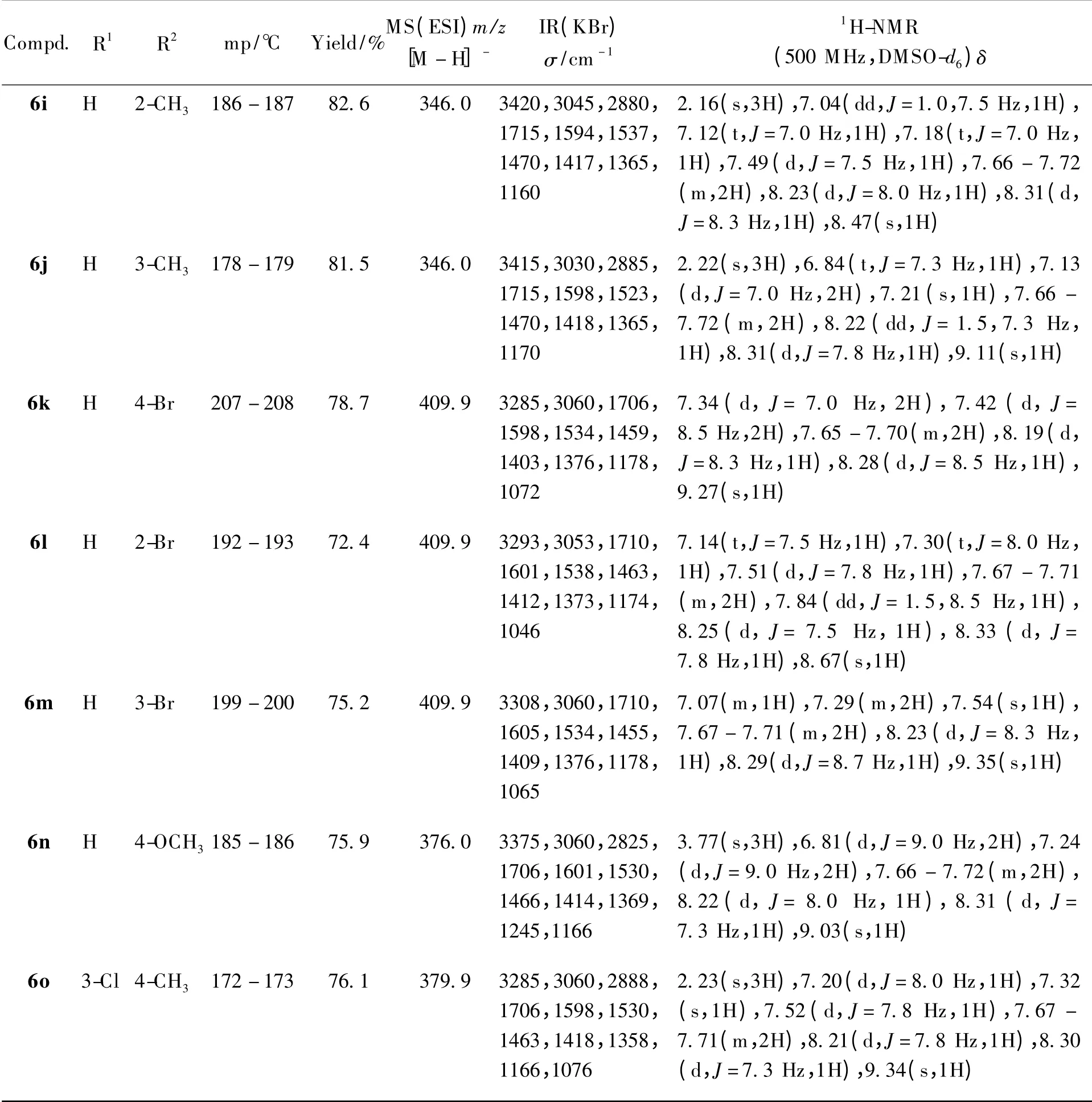
Continued Table 1
3 讨论
在制备目标化合物时,尝试了多种方法。方法一,先是2-苯并噻唑磺酰胺与氯甲酸甲酯反应,制备2-苯并噻唑磺酰胺甲酸甲酯,然后再与各种取代苯胺反应得目标化合物。方法二则与方法一相反,先是各种取代苯胺与氯甲酸甲酯反应,制备相应的取代苯胺甲酸甲酯,然后再与2-苯并噻唑磺酰胺反应得目标化合物。这两种方法的结果都是副产物多,纯化时需先后用制备型薄层色谱和凝胶柱色谱,且产率也低,只能达到10%左右。方法三,先将2-苯并噻唑磺酰胺与三光气反应制成2-苯并噻唑磺酰胺异氰酸酯,然后再与各种取代苯胺反应制得目标化合物,该方法反应的第一步很难进行。方法四则与方法三相反,先是各种取代苯胺与三光气反应制备各种取代苯胺异氰酸酯,然后与2-苯并噻唑磺酰胺反应制得目标化合物,该方法虽然反应第一步纯化时需减压蒸馏,操作比较繁琐,但副产物少,收率高,一般能达到70%以上,故本文最终采用方法四进行合成。
制备取代苯胺异氰酸酯时,滴液方式有两种,一种是三光气滴加到取代苯胺中,另一种则相反。按前者操作,异氰酸酯的收率低,产生大量不溶性的副产物取代二苯脲。因此本实验采用了后一种滴液方式,保证苯胺始终以稀浓度参与反应,从而减少二苯脲的生成。另外,为防止光气中毒,虽然采用固体光气与取代苯胺反应,但反应中还是会有少量光气逸出,所以要安装好气体吸收装置,以防光气中毒。
本文作者采用MTT 法,以人非小细胞肺癌A-549 细胞为测试细胞株,对所合成的化合物进行了初步抗肿瘤活性试验。筛选结果显示,与阳性对照顺铂(IC50=117 μmol·L-1)相比较,目标化合物6b(IC50=135 μmol·L-1)、6e(IC50=216 μmol·L-1)和6n(IC50=184 μmol·L-1)具有一定的抗肿瘤活性。进一步的活性测试正在进行中。
[1] 张敏恒.磺酰脲类除草剂的发展现状、市场与未来趋势[J].农药,2010,49(4):235 -240.
[2] 衣淑珍.磺酰脲类降糖药进展[J]. 齐齐哈尔医学院学报,1993,11(2):21 -24.
[3] MAHINDROO N,LIOU J P,CHANG J Y,et al.Antitubulin agents for the treatment of cancer a medicinal chemistry update[J]. Exp Opin Ther Patents,2006,16(5):647 -691.
[4] HOUGHTON P J,HOUGHTON J A.Antitumor diarylsulfonylureas:novel agents with unfulfilled promise[J].Invest New Drugs,1996,14(3):271 -280.
[5] MOHAMADI F,SPEES M M,GRINDEY G B.Sulfonlureas:a new class of anticancer agents[J].J Med Chem,1992,35(16):3012 -3016.
[6] WENHUA P Y,JEMAN K L,DUG H H,et al. Induction of G2/M phase arrest and apoptosis by a new synthetic anticancer agent DW2282,in promyelocytic leukemia(HL-60)cells[J]. Biochem Pharmacol,2001,62(11):1439 -1447.
[7] JEFFRY HOWBERT J,SUE GROSSMAN C.Novel agents effective against solid tumors:the diarylsulfonylureas:synthesis,activities,and analysis of quantitative structure-activity relationships[J]. J Med Chem,1990,33(9):2393 -2407.
[8] GARVITA C,KARTHIEYAN C. Quantitative structure activity relationship analysis of some diarysulphonylurea derivatives as tubulin agents[J]. Int J Cancer Res,2008,4(1):1 -11.
[9] YOSHIDA M,HAYAKAWA I,HAYASHI N,et al.Synthesis and biological evaluation of benzothiazole derivatives as potent antitumor agents[J]. Bioorg Med Chem Lett,2005,15(14):3328 -3332.
[10] HAVRYLYUK D,MOSULA L,ZIMENKOVSKY B,et al. Synthesis and anticancer activity evaluation of 4-thiazolidinones containing benzothiazole moiety[J].Eur J Med Chem,2010,45(11):5012 -5021.
[11] WOLTERSDORF O W,Jr SCHWAM H,BICKING J B,et al.Topically active carbonic anhydrase inhibitors. 1.O-Acyl derivatives of 6-hydroxybenzot hiazole-2-sulfonamide[J]. J Med Chem,1989,32(11):2486 -2492.
[12] 王向辉,贺永宁,盘茂东,等.三光气法合成取代苯异氰酸酯[J].应用化工,2008,37(9):1019-1021.
[13] 韩莹,屠树滋.香豆素磺酰脲类化合物的合成研究[J].中国药科大学学报,2002,33(2):93 -97.