实时荧光PCR法检测耐甲氧西林金黄色葡萄球菌的研究
方 莉,龙思琪,许 媛,唐 中,赵维皎,黄义山,廖 涛△
(1.川北医学院附属医院检验科,四川南充637000;2.川北医学院医学检验系,四川南充637000)
由于抗菌药物的广泛使用,近年来耐甲氧西林金黄色葡萄球菌(MRSA)的检出率不断增高,MRSA不仅只对甲氧西林耐药,对β-内酰胺类、氨基糖苷类、大环内酯类等多种抗菌药物均耐药,表现出多重耐药性[1-2]。快速、准确的检出 MRSA,对临床选用合适的抗菌药物具有重要的意义[3],也有利于控制MRSA的流行传播。本文旨在使用实时荧光PCR法检测临床标本中的mecA基因和nuc基因,为临床检测MRSA提供了一种快速、有效的方法,有效减少MRSA的医院感染。
1 材料与方法
1.1 材料
1.1.1 标本来源 收集2012年1~6月川北医学院附属医院新生儿科、皮肤科、烧伤科、脑外科、骨科、ICU等科室的45例患者的痰液和脓液标本,保存在-40℃冰箱中备用。其中40份临床标本被检验科微生物室分离鉴定为MRSA,2份标本被鉴定为甲氧西林敏感的金黄色葡萄球菌(MSSA),3份标本被鉴定为耐甲氧西林的表皮葡萄球菌。
1.1.2 菌株来源 40株检验科微生物室分离鉴定为 MRSA的菌株,来源于上述临床标本的分离培养,并经血浆凝固酶实验及vitek2-compact细菌快速培养和药敏检测系统鉴定为MRSA,菌株保存于-40℃冰箱中。
1.1.3 主要试剂及仪器 实时荧光定量PCR仪(ROCHE Lightcycler480Ⅱ)、vitek2-compact细菌快速培养和药敏检测系统(法国生物梅里埃)、MRSA基因检测试剂盒(上海之江生物)、MRSA鉴定培养基(法国生物梅里埃)。
1.2 方法
1.2.1 细菌培养鉴定药敏实验 将40份痰液和脓液标本按微生物室标准化操作规程进行处理,分离培养后对于形似葡萄球菌的菌落作革兰染色,触酶实验,血浆凝固酶实验,然后利用GP鉴定卡及AST-GP药敏卡作细菌的鉴定及药敏实验。
1.2.2 MRSA培养基鉴定实验 将40份痰液和脓液标本接种于MRSA鉴定培养基上,于37℃有氧条件下孵育18~24h后观察结果。18h后,若培养基上呈典型的绿色菌落则为阳性,但是如果培养基上无细菌生长或无任何颜色必须再孵育24h方可确定为阴性。
1.2.3 实时荧光PCR法检测mecA基因及nuc基因 按上海之江生物科技提供的MRSA耐药基因检测试剂盒说明书,分别对40份含有MRSA菌的临床标本和对应的MRSA分离菌株进行mecA基因和nuc基因的检测。2份含有MSSA的临床标本作为nuc基因的阳性对照和mecA基因的阴性对照;3份含有耐甲氧西林的表皮葡萄球菌的临床标本作为nuc基因的阴性对照和mecA基因的阳性对照。
1.2.4 临床标本预处理 痰液:标本中加入等体积的4%NaOH溶液,放于37℃条件下处理30min,使其充分液化。脓液:标本若采用一次性棉拭子送检,加入1mL无菌生理盐水,振荡混匀,形成混悬液,于13 000r/min离心10min后保留沉淀备用。标本若为黏稠状,应加入等体积的4%NaOH溶液,放于37℃条件下处理30min,使其充分液化。将液化完全的标本4 000r/min离心10min弃上清液后加入1mL无菌生理盐水,于13 000r/min离心10min。重复以上操作3次后保留沉淀备用。
1.2.5 菌株的预处理 将菌株置入预先装有生理盐水的离心管中形成0.5麦氏单位的混悬液后,取1mL菌悬液13 000r/min离心10min后保留沉淀备用。
1.2.6 核酸提取 向1.2.4和1.2.5的沉淀中加入 DNA 提取液50μL,充分混匀,放入100℃干浴10min,13 000r/min离心5min,保留上清液作为模板DNA。
1.2.7 反应体系 总反应体系20μL,包含17.6μL PCR反应液、0.4μL Taq酶、2μL模板DNA。
1.2.8 PCR反应条件 37℃2min,94℃2min,94℃15s,60℃60s,40个循环;单点检测荧光在60℃。荧光通道检测选择FAM通道和HEX通道。
1.2.9 结果判断 mecA基因、nuc基因检测同时为阳性,判断为MRSA;mecA基因阴性、nuc基因阳性,判断为 MSSA;mecA基因阳性、nuc基因阴性,判断为耐甲氧西林菌株(非金黄色葡萄球菌)。
1.3 统计学处理 采用SPSS软件进行统计学分析,各方法间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 实时荧光PCR法检测临床标本的结果 实时荧光PCR法检测vitek2-compact细菌鉴定的40份含有MRSA菌的临床送检标本,结果见表1。3份耐甲氧西林的表皮葡萄球菌的临床标本的检测结果均为mecA基因阳性、nuc基因阴性。2份MSSA临床标本的检测结果为mecA基因阴性、nuc基因阳性,检测结果符合质控要求。

表1 含有MRSA的临床标本的mecA基因、nuc基因检测结果[n(%)]
2.2 实时荧光PCR法检测临床分离的MRSA菌株 PCR检测临床分离的MRSA菌株,40株菌株均检测出mecA基因、nuc基因阳性。PCR检测纯培养的菌株,MRSA检出率为100%。
2.3 实时荧光PCR法与vitek2-compact细菌鉴定药敏法、MRSA鉴定培养基实验结果比较 实时荧光PCR法检测临床标本,与vitek2-compact细菌培养药敏检测系统鉴定结果的符合率为90%;检测MRSA菌株,与vitek2-compact细菌培养药敏检测系统鉴定结果的符合率为100%。MRSA鉴定培养基鉴定出38株MRSA阳性,2株MRSA阴性,与vitek2-compact细菌培养药敏检测系统鉴定比较,MRSA鉴定培养基的假阴性率为5% 。3种方法经χ2检验无显著性差异(χ2=7.62,P>0.05)。见表2。
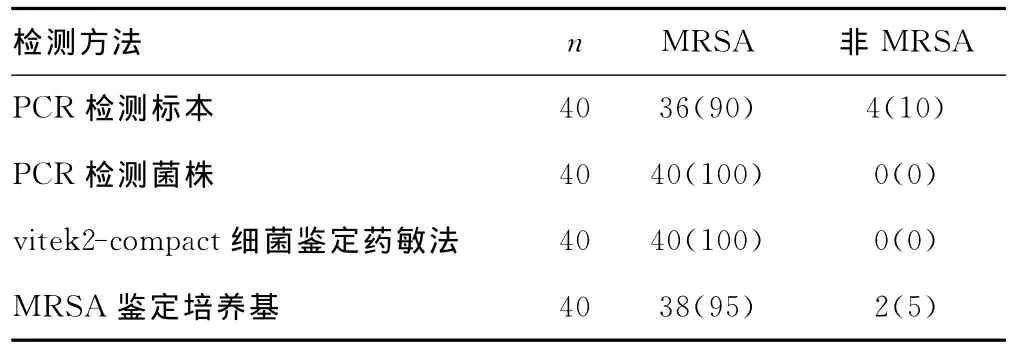
表2 3种方法检测结果[n(%)]
3 讨 论
MRSA是导致医院感染和社区感染的重要病原菌之一。目前临床分离的MRSA呈现不断上升的趋势。2008年全国细菌耐药性监测网对所有三级甲等医院的监测结果显示,MRSA占金黄色葡萄球菌的60%以上[4],MRSA的危害性在于对多种药物的多重耐药,耐药率较高,MRSA的多重耐药是因为获得了编码青霉素结合蛋白2a(PBP2a)的mecA基因,PBP2a与β-内酰胺类抗菌药物结合力较低,该类抗菌药物不能抑制细菌细胞壁的合成,从而引起耐药[5]。mecA基因目前已作为耐甲氧西林葡萄球菌的分子学标志[6]。有研究认为[7],根据金黄色葡萄球菌的nuc基因设计特异引物,可以通过PCR快速鉴别金黄色葡萄球菌,nuc基因是金黄色葡萄球菌特有的基因,具有较高的种族特异度。mecA基因和nuc基因联合检测MRSA具有较高的特异度和准确度。对于高度耐药和多重耐药的MRSA,早期检测不仅是控制其感染的关键,也是临床上决定是否用抗MRSA最后一线抗菌药物如糖肽类和噁唑烷酮类抗菌药物的关键[8]。
本实验采用实时荧光PCR法检测2份分离出MSSA的临床标本,结果显示:nuc基因阳性、mecA基因阴性;3份分离出耐甲氧西林的表皮葡萄球菌的临床标本,检测结果显示:nuc基因阴性、mecA基因阳性。结果表明:金黄色葡萄球菌nuc基因阳性而表皮葡萄球菌nuc基因阴性,只有耐甲氧西林的表皮葡萄球菌mecA基因阳性。本研究结果与nuc基因是金黄色葡萄球菌的特有基因、mecA基因是耐甲氧西林葡萄球菌的分子学标志的结论一致。
与其他检测MRSA研究不同的是,本实验采用临床标本直接进行实时荧光PCR法检测。实时荧光PCR法检测mecA基因与nuc基因同为阴性的4份临床标本,经提取分离MRSA菌的DNA后,检测其mecA基因、nuc基因均为阳性。说明实时荧光PCR法检测MRSA纯培养细菌的敏感性高,但PCR检测临床标本中MRSA的敏感性还需要改进。分析其原因可能为:(1)由于痰标本、各类拭子中存在着影响细菌裂解释放DNA的因素,简单的煮沸法可导致假阴性结果的出现[9];(2)使用4%NaOH液化标本后,未充分洗涤干净,pH过高可抑制PCR反应,造成假阴性结果;(3)在标本洗涤、冻存、提取DNA模板过程中,原始标本中的MRSA菌含量极低,可能不能有效提取到MRSA的DNA模板,造成PCR结果的假阴性。实时荧光PCR法检测临床标本与细菌培养鉴定的符合率为90%,说明直接用标本提取DNA模板的技术有待提高[9]。实时荧光PCR法检测临床标本分离的MRSA菌株与vitek2-compact细菌培养鉴定药敏检测系统鉴定结果的符合率100%,去除了用标本提取DNA模板的影响因素,用MRSA菌株进行PCR检测,实验的准确度明显的提高。
实时荧光PCR法检测临床标本中的MRSA,与vitek2-compact细菌鉴定药敏法、MRSA鉴定培养基实验结果比较,差异无统计学意义(χ2=7.62,P>0.05)。实时荧光PCR法的灵敏度高、特异度强,检测方便简单、快捷,可以在标本接收的2~3h内出结果,免去其他两种方法的培养时间,可以满足医院感染防控24h内检测患者入院时是否携带MRSA的要求。本研究提示条件成熟的实验室可以开展实时荧光PCR法检测MRSA,能更加快速准确地为临床提供实验室数据,有效控制MRSA的医院感染传播。
[1]姜海涛.矽肺患者金黄色葡萄球菌的临床耐药性分析[J].实用预防医学,2010,17(5):1003-1004.
[2]石宏云,冯伟,肖勇健,等.新生儿血培养常见病原菌的分布及药物敏感率分析[J].南华大学学报:医学版,2008,36(2):223-224.
[3]Chambers HF,Deleo FR.Waves of resistance:Staphylococcus aureus in the antibiotic era[J].Nat Rev Microbiol,2009,7(9):629-641.
[4]汪复,朱德妹,胡付品,等.2008年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2009,9(5):321-329.
[5]Franklin GF,Bal AM,McKenzie H.Phlebotomy tourniquets and MRSA[J].J Hosp Infect,2007,65(2):173-175.
[6]黄辉,陈颖,安如俊,等.MRSA中mecA及fem B基因的检测与耐药相关性[J].微生物学杂志,2009,29(1):54-56.
[7]阳志强,郭兆彪,宋亚军,等.用双重聚合酶链快速鉴别葡萄球菌及其甲氧西林耐药性[J].中华医院感染学杂志,2003,13(10):916-918.
[8]Bamberger DM,Boyd SE.Management of Staphylococcus aureus infections[J].Am Fam Physician,2005,72(12):2474-2481.
[9]江凌晓,刘思平,龙军,等.耐甲氧西林葡萄球菌荧光定量PCR检测方法的实验研究[J].热带医学杂志,2007,7(9):866-868.

