血液透析滤过联合小剂量骨化三醇对维持性血液透析患者高转运骨营养不良的影响
罗 成,张 辉,胡尽香
(1.广东省东莞市塘厦医院肾内科 523710;2.广东省南方医科大学北滘医院肾内科,广州528311)
肾性骨营养不良(renal osteodystrophy,ROD)又称肾性骨病,是维持性血液透析(maintenance hemodialysis,MHD)的终末期肾病(ESRD)患者常见的一种代谢性骨病,因患者体内1,25-二羟维生素 D3[1,25(OH)2D3]减少、钙磷代谢紊乱、继发性甲状旁腺功能亢进等原因引起,临床表现为骨痛、骨质疏松、皮肤瘙痒等,严重影响患者的生活质量[1]。针对ROD的治疗目前主要使用大剂量活性维生素D3联合磷结合剂,国内磷结合剂尚未能推广使用,大剂量活性维生素D3常导致再生不良性骨病、血管、软组织的钙化、高钙血症、高磷血症等严重的不良反应[2],通过减少活性维生素D3的剂量及提高透析效率增加甲状旁腺激素(PTH)的清除,有可能在获得相同疗效的同时减少不良反应的发生。
1 资料与方法
1.1 一般资料 本院血液净化中心MHD 6个月以上,具有ROD临床症状,全段甲状旁腺激素(iPTH)>50pmol/L,骨源性碱性磷酸酶(BAP)>100IU/L,同意签署知情同意书的患者。排除标准:伴有严重心、脑、肝、肺等脏器疾病者;肿瘤患者;预计短期内将退出血液透析无法完成实验者;不愿或无法签署知情同意书者。经过检查和告知后有25例患者纳入实验观察。将25例患者随机分成在线血液透析滤过(HDF)联合小剂量骨化三醇组(HDF组)13例和高通量血液透析联合大剂量骨化三醇组(VitD组)12例。
1.2 方法
1.2.1 干预方法 透析处方:HDF组、VitD组均使用国产郎生聚砜膜血液滤过器(LSL140),日本原装TORAY-TR8000血液透析滤过机,双反渗水处理系统,提供细菌克隆数小于0.1 CFU/mL、内毒素水平小于0.03EU/mL的超纯透析用水。透析液使用广州白云山郎兴制药有限公司生产的血液透析及相关治疗浓缩A、B液,由透析机自动配置标准碳酸氢盐透析液,配比后透析液最终离子浓度约为:钠138mmol/L,钾2.0 mmol/L,钙1.5mmol/L,镁0.5mmol/L,氯100mmol/L,碳酸氢盐32mmol/L,pH7.0~7.8,根据患者病情调整钠138~148mmol/L。透析液流速500mL/min,透析血液流速250 mL/min。HDF采用后置换,每次置换量为患者体质量的30%。每组分别进行相应的治疗,3次/周,透析充分性评估单室尿素清除指数(spKt/V)必须大于1.2。HDF组在每次透析后口服骨化三醇(罗钙全,即活性维生素D3,0.25μg/粒,上海罗氏制药有限公司)0.5μg;VitD组在每次透析后口服骨化三醇1.0μg。两组均使用碳酸钙1 200mg/d,整个实验过程中未再用其他磷结合剂。两组在观察期间均要求每天进行相近的运动锻炼及日照。临床干预维持16周。
1.2.2 药物减停方法 干预开始后每4周根据血钙水平进行调整1次,血钙小于2.10mmol/L增加、血钙大于2.54mmol/L减少,每次增加或减少骨化三醇0.25μg,当血钙大于2.60 mmol/L时,立即停用骨化三醇,后每周复查1次血钙,当血钙小于2.37mmol/L,再次给予停药前剂量半量口服,继续按前法调整。目标血钙值为2.10~2.37mmol/L。
1.2.3 标本及检测 透析间期早上空腹静脉采血,采血前避免激烈运动,使用EDTA2Na抗凝管采血后20min内离心留取上清液-20℃保存,由本院检验中心统一检测,西门子发光免疫分析仪化学发光法测定iPTH(正常参考值1.3~6.8 pmol/L);分离胶管上述时间采血,凝固后取上清液,本院检验中心干化学法检测BAP(正常参考值小于或等于100IU/L);全自动生化分析仪自动检测血清钙、血清磷、血肌酐(SCr)、尿素氮(BUN)、血清清蛋白(ALB)等,并根据ALB水平将钙进行校正。上述指标在临床观察第1周连续测定3次,取其平均值为初始数据。在观察结束的最后1周,同上法连续测定3次,取其平均值为实验结果数据。在临床干预4周后一次血液透析的前后分别分离胶管采血,全自动生化分析仪测定透析前后BUN,计算spKt/V。每4周透析间期早上分离胶管单次空腹静脉采血测定钙、磷,根据钙、磷的水平调整VitD组骨化三醇剂量。
1.2.4 临床症状评分方法 骨痛:无疼痛0分;轻度间歇可以忍受者1分;中度影响休息者2分;持续重度疼痛必须使用止痛药者3分;严重疼痛伴有血压脉搏等变化者4分。疼痛部位:单部位疼痛1分;2~3部位疼痛2分;3处以上部位疼痛3分。皮肤瘙痒:无0分;轻度间歇可以忍受者1分;中度影响休息者2分;持续重度难以忍受者3分。在观察开始和结束时分别进行临床症状评分。
1.3 统计学处理 使用SPSS13.0统计软件进行数据分析。计量资料采用±s表示,同组数据前后比较使用配对样本t检验(Paired-sample T-test);组间数据比较:计量资料方差齐者选择单因素方差分析(one-way ANOVA),方差不齐者先进行数据转换使方差齐后再用前法统计,转换后方差仍不齐者选择单因素方差分析近似方法Welch检验;计数资料采用χ2检验(Chi-Square test)或两独立样本非参数检验(2Independent Sample Tests)。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较 干预前两组患者性别比、年龄、透析时间、原发肾病病因、spKt/V、SCr、BUN、ALB以及症状评分均差异无统计学意义(P>0.05)。干预后两组SCr、BUN、ALB以及症状评分差异无统计学意义(P>0.05),但两组骨化三醇剂量差异有统计学意义(P=0.000);干预后两组症状均显著改善,症状评分均较前明显减少(P<0.01)。全部干预过程中两组均未出现血钙大于2.60mmol/L停药的情况。见表1。
表1 两组干预前后比较(±s)
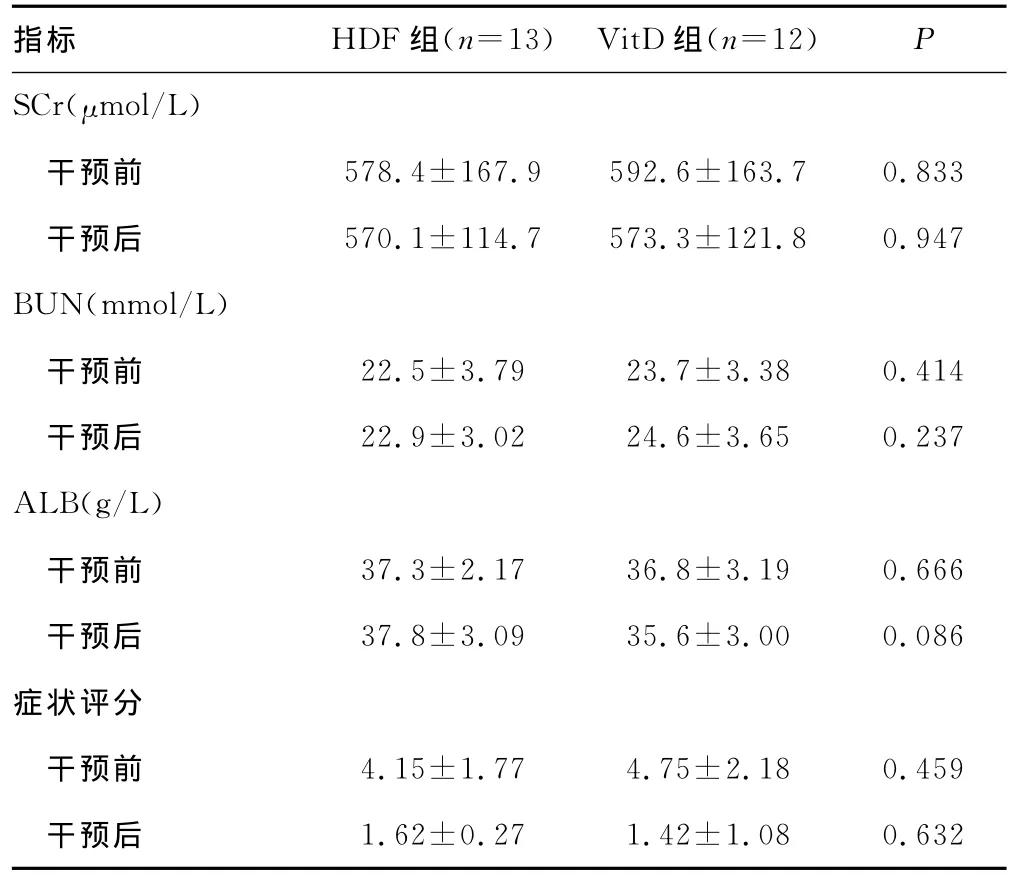
表1 两组干预前后比较(±s)
指标 HDF组(n=13) VitD组(n=12)P SCr(μmol/L)干预前 578.4±167.9 592.6±163.7 0.833干预后 570.1±114.7 573.3±121.8 0.947 BUN(mmol/L)干预前 22.5±3.79 23.7±3.38 0.414干预后 22.9±3.02 24.6±3.65 0.237 ALB(g/L)干预前 37.3±2.17 36.8±3.19 0.666干预后 37.8±3.09 35.6±3.00 0.086症状评分干预前 4.15±1.77 4.75±2.18 0.459干预后1.62±0.27 1.42±1.08 0.632
表2 两组干预前后观察指标的比较(±s)
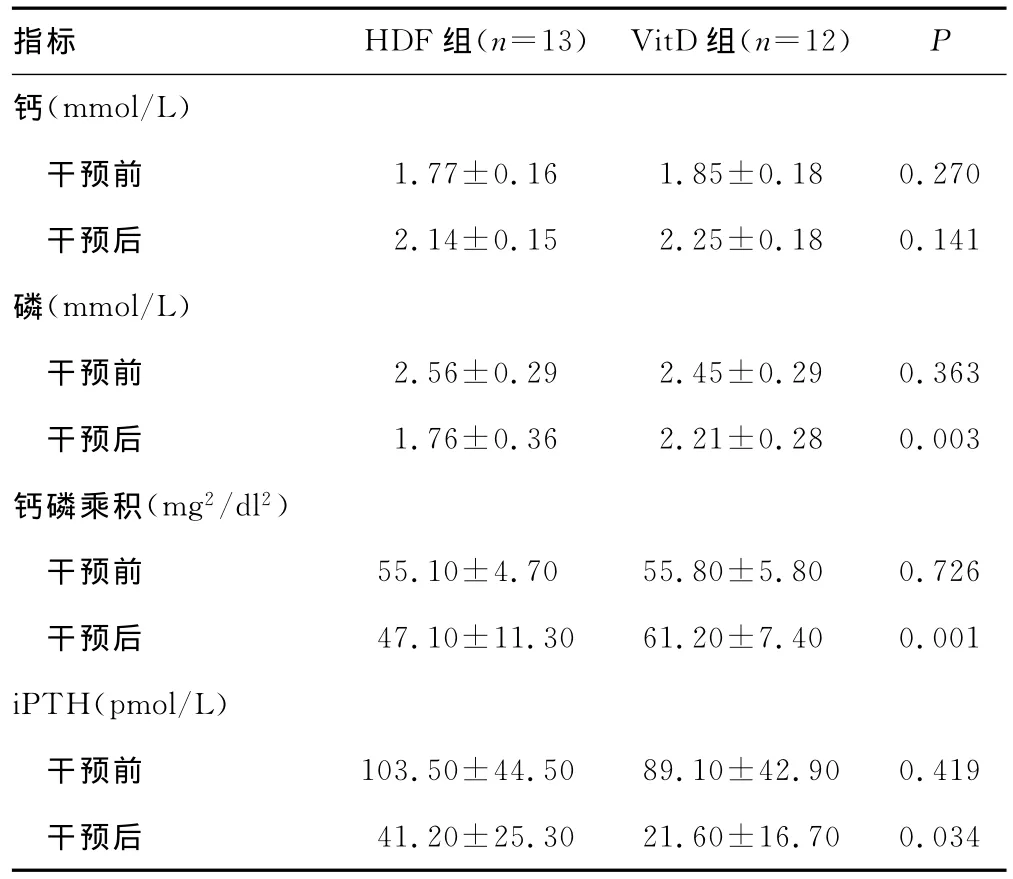
表2 两组干预前后观察指标的比较(±s)
指标 HDF组(n=13) VitD组(n=12)P钙(mmol/L)干预前 1.77±0.16 1.85±0.18 0.270干预后 2.14±0.15 2.25±0.18 0.141磷(mmol/L)干预前 2.56±0.29 2.45±0.29 0.363干预后 1.76±0.36 2.21±0.28 0.003钙磷乘积(mg2/dl 2)干预前 55.10±4.70 55.80±5.80 0.726干预后 47.10±11.30 61.20±7.40 0.001 iPTH(pmol/L)干预前 103.50±44.50 89.10±42.90 0.419干预后41.20±25.30 21.60±16.70 0.034
2.2 两组患者干预前后血钙、磷、钙磷乘积和iPTH比较 干预前两组血钙、磷、钙磷乘积和iPTH比较,差异无统计学意义(P>0.05)。干预后HDF组和VitD组血钙均显著升高(P=0.000),两组间差异无统计学意义(P>0.05);两组血磷均显著降低(P=0.000、0.048),其中 HDF组血磷降低更为明显,两组差异有统计学意义(P<0.05);血钙磷乘积在HDF组显著降低(P=0.031),但在 VitD组却明显升高(P=0.037),两组间差异有统计学意义(P<0.05);干预后HDF组和VitD组iPTH均显著降低(P=0.000),其中VitD组降低更为明显,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者干预前后BAP的比较 干预前两组BAP比较,差异无统计学意义(P>0.05);干预后两组比较,差异有统计学意义(P<0.05),见表3。
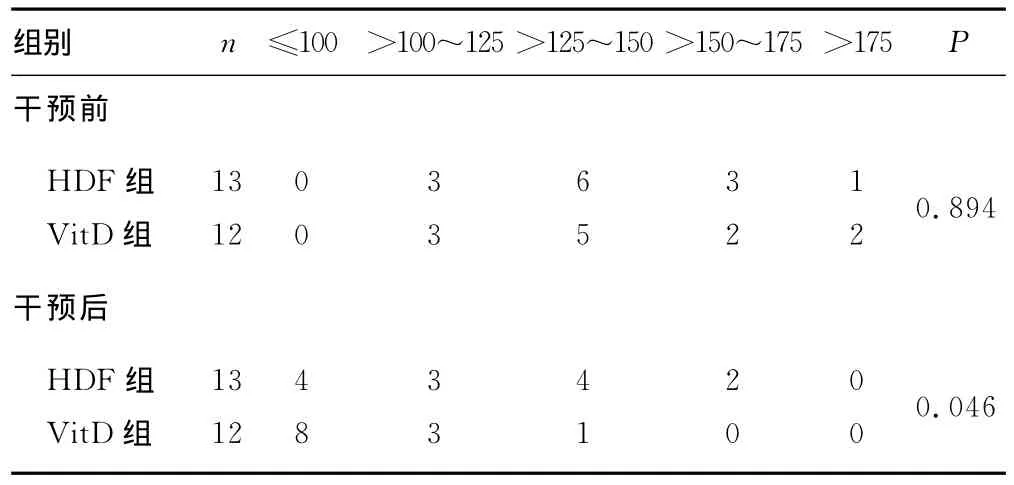
表3 两组BAP的比较(IU/L)
3 讨 论
慢性肾脏疾病(CKD)患者在病情发展至Ⅲ期以后就开始因为1,25(OH)2D3缺乏和(或)低钙血症导致甲状旁腺继发性增生,引起体内PTH水平升高,继而发生矿物质和骨代谢异常,部分患者开始出现ROD[3]。随着病情的进展肾功能持续下降,1,25(OH)2D3进一步减少、甲状旁腺维生素D受体和钙敏感受体下调和高磷血症等,导致继发性甲状旁腺功能亢进进一步加重,患者体内钙磷和骨代谢异常加重,ROD的发生率逐步增加,当病情进展至终末期并行血液透析等肾替代治疗时,所有的患者都已经发生不同程度的ROD,而且随着透析时间的延长病变逐步加重[4]。根据病变程度的不同,患者临床可从无症状到骨痛、皮肤瘙痒、异位钙化,甚至出现骨骼畸形、骨折等。ROD的临床确诊多依赖于骨活检,根据活检所见的骨转化状态及组织结构学的不同可将ROD分成:高转运骨病、低转运骨病和混合型骨病[5]。但因医疗条件和成本的限制,骨活检难以大范围开展,其在骨病的诊断中的实际应用受到限制。由于高转运骨病组织学是由严重继发性甲状旁腺功能亢进所引起,病变严重程度与患者血清PTH的水平密切相关[6],在骨的高转运状态下BAP产生增加,所以研究发现可以根据iPTH和BAP的水平来诊断高转运和低转运骨病,当iPTH>400pg/mL和BAP>20ng/mL时,高转运骨病诊断的灵敏度、特异度都接近100%[7-9],而当iPTH<60pg/mL和BAP<12.9ng/mL时,低转运骨病诊断的灵敏度、特异度都在90%以上[10]。
高转运骨病的主要治疗手段是骨化三醇和磷结合剂,通过提高血钙,降低血磷和iPTH达到治疗目的[10]。但是长期服用骨化三醇在升高血钙同时可以升高血磷,可能导致高血钙和高血磷,钙磷乘积增大,引起软组织钙化加重导致不良预后增加。同时由于1,25(OH)2D3含量增加、血钙升高导致iPTH水平显著降低,并因CKD发生后骨骼对iPTH出现抵抗,所以当iPTH水平显著降低引起骨的转化动力缺失,大部分患者病情可转化为低转运骨病的动力缺失性骨病[11],患者病理性骨折的发生率增加。骨化三醇虽然是高转运骨病的有效治疗手段,但可能导致严重的不良反应,所以适度减少骨化三醇的剂量同时增加患者血磷和iPTH的清除可能是一种有效的解决方法。在ESRD的多种血液净化治疗方法中,研究已经确认HDF在血磷和iPTH的清除上优于常规HD[12-13],并可以有效提高机体对骨化三醇的反应性[14],所以HDF联合小剂量骨化三醇有可能在获得相同疗效的情况下减少骨化三醇的各种不良反应。
本研究发现HDF联合使用小剂量骨化三醇与高通量血液透析联合大剂量骨化三醇在干预16周后,两组患者血钙水平均较前明显升高,而且两组之间未见显著差异。两组患者临床症状明显缓解,且症状缓解水平相同,组间未见显著性差异。上述结果提示两种治疗方案获得了基本相同的治疗效果。在其他各项指标上可以看到明显的不同。两组血磷水平治疗后均显著降低,但HDF组降低的更加明显,而且钙磷乘积也显著下降,明显低于55mg2/dl2,降低了软组织钙化的可能[15]。然而在VitD组虽血磷也显著降低,但钙磷乘积却明显增高,显著高于推荐水平,有可能增加软组织钙化发生。两组患者治疗后iPTH和BAP水平均显著降低,两组间差异显著,VitD组降低的更为明显,已有患者iPTH<60pg/mL,同时大部分患者BAP水平恢复正常,提示本组患者骨骼转化率降低,出现动力缺失性骨营养不良有可能显著增加。
研究证实在高转运骨病的治疗上,HDF联合使用小剂量骨化三醇可以获得与高通量血液透析联合大剂量骨化三醇相同的疗效,并可以有效地减少骨化三醇不良反应的发生,而且不需要频繁的实验室检查监测血钙磷水平,是一种有效的高转运骨病的治疗方法。
但是本研究在持续16周后,HDF组患者血磷和iPTH还没有完全达到所推荐的水平,所以需要进一步的研究观察。
[1]Malluche HH,Mawad HW,Monier-Faugere MC.Renal osteodystrophy in the first decade of the new millennium:analysis of 630bone biopsies in black and white patients[J].J Bone Miner Res,2011,26(6):1368-1376.
[2]Moorthi RN,Moe SM.CKD-mineral and bone disorder:core curriculum 2011[J].Am J Kidney Dis,2011,58(6):1022-1036.
[3]Moorthi RN,Moe SM.Recent advances in the noninvasive diagnosis of renal osteodystrophy[J].Kidney Int,2013,180(30):1300-1305.
[4]Malluche HH,Porter DS,Monier-Faugere MC,et al.Differences in bone quality in low-and high-turnover renal osteodystrophy[J].J Am Soc Nephrol,2012,23(3):525-532.
[5]Christov M,Pereira R,Wesseling-Perry K.Bone biopsy in renal osteodystrophy:continued insights into a complex disease[J].Curr Opin Nephrol Hypertens,2013,22(2):210-215.
[6]朱建民.肾性骨营养不良的组织学分型及其与临床的联系[J].中华内科杂志,1997(1):4-5.
[7]Urena P,Hruby M,Ferreira A,et al.Plasma total versus bone alkaline phosphatase as markers of bone turnover in hemodialysis patients[J].J Am Soc Nephrol,1996,7(3):506-512.
[8]Ates F,Koken T,Demir S,et al.Comparison of three different immunoassay methods for the evaluation of intact parathyroid hormone levels in hemodialysis patients[J].Scand J Clin Lab Invest,2011,71(3):227-231.
[9]De PL,Coppolino G,Bolignano D,et al.Parathyroid hormone variability parameters for identifying high turnover osteodystrophy disease in hemodialysis patients:an observational retrospective cohort study[J].Ther Apher Dial,2010,14(6):566-571.
[10]Fournier A,Ghitu S,Bako G,et al.Bone markers in the diagnosis of low turnover osteodystrophy in haemodialysis patients[J].Nephrol Dial Transplant,1999,14(11):2772-2774.
[11]Malluche HH,Mawad H,Monier-Faugere MC.Effects of treatment of renal osteodystrophy on bone histology[J].Clin J Am Soc Nephrol,2008,3(suppl 3):S157-163.
[12]王成,娄探奇,唐骅,等.常用血液净化方法对维持性血液透析患者血清甲状旁腺素的清除效果[J].中华急诊医学杂志,2005,14(1):61-63.
[13]Movilli E,Camerini C,Gaggia P,et al.Effect of post-dilutional on-line haemodiafiltration on serum calcium,phosphate and parathyroid hormone concentrations in uraemic patients[J].Nephrol Dial Transplant,2011,26(12):4032-4037.
[14]Perez-Garcia R,Albalate M,de Sequera P,et al.On-line haemodiafiltration improves response to calcifediol treatment[J].Nefrologia,2012,32(4):459-466.
[15]贺海东,张汝忠.维持性血液透析患者透析充分性与血浆脑钠肽水平关系[J].中华肾脏病杂志,2010,21(6):459-460.

