观察建立不同经皮肾通道对猪肾脏的影响*
邱 明,龙平华,杨秀江
(重庆市大足区人民医院泌尿外科 402360)
近年来,由于B超引导下经皮肾穿刺造口术的推广及腔内碎石清石技术的发展,经皮肾镜取石术(percutaneous nephrolithotomy,PCNL)逐渐取代开放手术[1-4]。成功建立经皮肾通道是PCNL的关键,文献报道,临床上PCNL常常采用16F、24F和30F通道[5-7]。对于如何选择合适的经皮肾通道以及不同大小的通道对猪肾脏的影响等问题,目前尚不清楚。本研究拟用活体猪为动物模型,比较不同经皮肾通道对猪肾脏的影响,探讨工作通道大小对肾脏损害的可能机制及预防措施,为临床更好开展PCNL提供指导。
1 材料与方法
1.1 仪器与试剂 盐酸氯胺酮(福建古田),咪达唑仑、舒芬太尼(宜昌人福),硫酸阿托品(天津金耀),膀胱镜、输尿管镜(德国WOLF),经皮肾镜、套叠式金属扩张器(瑞士EMS),成像系统(日本三星),液体灌注泵(成都新兴),穿刺针、斑马导丝、剥皮鞘(德国莱凯),输尿管导管(上海上医康鸽),超声系统(深圳迈瑞)等。
1.2 实验动物 32只雌性荣昌小猪,体质量30~50kg,由重庆市畜牧科学院提供,实验动物使用许可证号:SYXK(渝)2011-0001。实验前先对动物进行适应性喂养1周。手术开始前5min,给予盐酸氯胺酮12mg/kg和阿托品0.5mg肌肉注射麻醉后,静脉泵入舒芬太尼3~4μg·kg-1·h-1、咪达唑仑0.15mg·kg-1·h-1和氯胺酮15~20mg·kg-1·h-1维持麻醉。
1.3 实验分组及经皮肾通道建立 分为:对照组、16F组、24F组、30F组,每组8只。小猪先取俯卧位,完成膀胱插管、输尿管插管。再改左侧卧位,行右输尿管逆行插管建立人工肾积水,18G穿刺针在B超引导下穿刺进入右肾盏,有落空感或有尿液溢出证实穿刺成功。尖刀切开皮肤后使用套叠式筋膜扩张器顺导丝逐号扩张通道至16F、24F和30F,置入相应大小镜鞘,插入肾镜,连接体外灌注系统,设定恒定工作条件,平均灌注流量300mL/min,平均灌注压250cm H2O(1cm H2O=0.098kPa),持时间60min,后退出肾镜留置14F肾造瘘管。对照组动物模拟PCNL过程,穿刺成功后置入导丝,切开皮肤后不作扩张,保留60min后将导丝和穿刺针退出,丝线缝合皮肤切口。
1.4 经皮肾通道建立时间及出血量 记录16F组、24F组、30F组采用膀胱插管、输尿管插管、肾脏穿刺扩张三步法建立猪经皮肾通道所需时间。同时,采用碱性羟基高铁血红素(AHD-575)法:术前在冲洗液收集桶中加入5U肝素钠,以防止血凝块形成,术后充分搅拌冲洗液,取5mL标本,用分光光度计进行比色,在波长575nm下测得吸光度数值,计算出冲洗液中的血红蛋白浓度及术中出血量。冲洗液中的血红蛋白浓度计算公式:冲洗液中血红蛋白浓度(g/L)=测定管吸光度×K(34.90)或查工作曲线得到。出血量计算公式:出血量(mL)=冲洗液中的血红蛋白浓度(g/L)×收集的冲洗液量(mL)/术前猪血红蛋白浓度(g/L)。
1.5 肾盂内压力测定 在输尿管镜下行右侧输尿管插管至右肾盂,输尿管导管体外连接压力感受器,监测在整个手术过程中右肾盂内压力变化,取平均值。
1.6 肾脏组织学检测 术后1周,麻醉小猪,将右肾切除,修剪除去肾周围脂肪及肾门处结缔组织。各组穿刺通道旁组织块用10%的甲醛溶液固定,脱水,包埋,垂直于穿刺通道方向5 μm厚切片后,分别予以苏木精-伊红(HE)染色,在显微镜下观察各组HE染色切片炎症损伤情况。
1.7 统计学处理 使用SPSS13.0统计学软件进行统计分析,所有计量资料采用±s进行统计学描述,多组间比较采用方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 经皮肾通道建立时间和术中出血量 16F组、24F组、30F组分别进行膀胱插管、输尿管插管、肾脏穿刺扩张建立猪经皮肾通道(对照组未行肾穿刺通道扩张),其完成时间分别为(95.00±8.06)、(99.60±5.55)、(103.17±7.99)min,差异无统计学意义(P>0.05);其术中出血量分别为:(22.40±4.56)、(25.00±5.24)、(20.50±7.87)mL,差异无统计学意义(P>0.05)。
2.2 肾盂内压力 术中对照组、16F组、24F组、30F组肾盂内压力分别为:(8.84±0.57)、(23.54±0.89)、(16.86±1.06)、(13.30±0.76)cm H2O,各组之间肾盂内压力差异有统计学意义(P<0.05)。见表1。
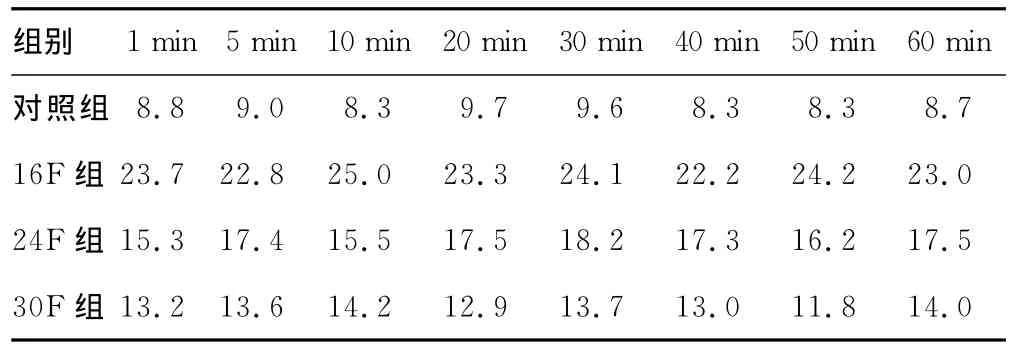
表1 各组术中各时间点肾盂内压力(n=8,cm H2O)
2.3 组织学检测 术后1周,行肾脏切除时未发现肾周血肿及切开肾盂时未见肾盂内血凝块等情况。对照组、16F组、24F组、30F组标本行HE染色后,在光学显微镜下见经皮肾通道口组织无明显炎症细胞渗出及纤维组织增生。
3 讨 论
准确建立经皮肾工作通道是PCNL的关键,其依赖于较好的定位方式[8]。目前国内外常用的定位方式有C臂、X线片、B超、CT和MRI[9-12]。随着B超的普及和技术的发展,采用B超引导建立工作通道是国内最常用的定位方式。超声引导穿刺可以为术者提供实时、安全、准确的工作通道,对PCNL具有重要的应用价值,并突显出其清石率高、创伤小、手术风险低的优越性,加强并发症的防治,有利于此项技术的广泛开展。
临床上行PCNL时,偶尔遇到术中出血较多,甚至需输血的患者。王声兴等[13]对微通道PCNL出血的发生原因及处理方法进行研究,结果表明:穿刺及皮肾通道扩张时造成出血14例,经过压迫止血后治愈,碎石过程中大出血4例,压迫止血或在肾镜直视下用电钩止血后治愈。术中大出血是PCNL最常见和最严重的并发症,其主要原因是建立肾穿刺通道时选择穿刺部位不正确、碎石过程中镜鞘过度摆动撕破肾实质、肾盏,损伤肾脏节段性血管或叶间血管所致。本研究发现:16F组、24F组、30F 组术中出血量分别为:(22.40±4.56)、(25.00±5.24)、(20.50±7.87)mL,差异无统计学意义(P>0.05),术中建立不同大小经皮肾通道对肾脏损伤致出血无明显差异。再次证实,PCNL术中出血与所建经皮肾通道大小无明显直接关系。
术后出血多见于术后1周内,多发生于肾脏假性动脉瘤、动静脉瘘的形成。如出血经局部压迫、夹闭肾造瘘管或输血等保守处理后无好转或出现失血性休克,应行超选择性肾动脉栓塞术止血。钱冲等[14]报道14例PCNL术后肾出血经保守治疗无效,采用超选择性肾动脉栓塞后1~2d肉眼血尿消失,随访1~24个月无肾出血复发,尿素氮、肌酐正常。本研究发现:术后1周,行肾脏切除时未发现肾周血肿及切开肾盂时未见肾盂内血凝块等情况;对照组、16F组、24F组、30F组标本行HE染色后,在光学显微镜下见经皮肾通道口组织无明显炎症细胞渗出及纤维组织增生。表明PCNL术后出血及炎症损伤与所建经皮肾通道大小无明显直接关系。
术后尿源性脓毒血症也是PCNL术后常见且严重的并发症之一。Vorrakitpokatorn等[15]报道,PCNL术感染性休克的发生率为4.7%(6/128),病死率为0.78%(1/128)。多数上尿路结石常并发感染,术中击碎结石后释放出的细菌、致热源、内毒素可随冲洗液吸收进入血液并引发菌血症或脓毒血症,严重者出现术后全身炎症反应综合征。本研究发现:对照组、16F组、24F 组、30F 组 肾 盂 内 压 力 分 别 为:(8.84±0.57)、(23.54±0.89)、(16.86±1.06)、(13.30±0.76)cm H2O,各组之间术中肾盂内压力差异有统计学意义(P<0.05)。肾盂内压力越高,导致细菌、致热源、内毒素随冲洗液吸收进入血液并引发菌血症或脓毒血症的概率越高。PCNL选择合适的工作通道,可以有效降低术中肾盂内压力,保持肾盂内压力处于低压状态,有效预防感染的吸收扩散。
通过本研究可推测B超定位下对肾脏进行穿刺扩张所致损伤与通道大小无明显关系,可能与术中穿刺部位、术中摆动镜鞘、灌注压力、灌注时间、肾盂内压力变化等有关。下一步有必要对临床病例进行研究,观察不同灌注流量对肾盂内压力的影响,以及与PCNL并发症之间的关系。
[1]Resorlu B,Kara C,Oguz U,et al.Percutaneous nephrolithotomy for complex caliceal and staghorn stones in patients with solitary kidney[J].Urol Res,2011,39(3):171-176.
[2]崔振宇,杨文增,周洪月,等.超声在经皮肾镜取石术中的价值与操作技巧[J].临床泌尿外科杂志,2012,27(7):535-537,539.
[3]肖汝涛.超声引导在经皮肾镜取石术中的应用价值[J].航空航天医学杂志,2012,23(4):441-442.
[4]贡雪灏,刘伟宗,李泉水,等.超声引导下经皮肾镜碎石术治疗复杂性肾结石[J].中国介入影像与治疗学,2010,7(3):260-263.
[5]沙文,潘运高,王静.标准通道和微通道经皮肾镜取石术对血生化指标的影响[J/CD].中华腔镜泌尿外科杂志:电子版,2012,6(5):357-361.
[6]彭国辉,魏强,曹满超,等.两步法建立标准通道经皮肾镜取石术治疗上尿路结石:附208例报告[J/CD].中华腔镜泌尿外科杂志:电子版,2012,6(1):34-37.
[7]Zhu Z,Xi Q,Wang S,et al.Percutaneous nephrolithotomy for proximal ureteral calculi with severe hydronephrosis:assessment of different lithotriptors[J].J Endourol,2010,24(2):201-205.
[8]龙平华,杨秀江,阮定红,等.B超引导下猪经皮肾镜通道的建立[J].重医医学,2012,41(2):158-159,162.
[9]Matlaga BR,Shah OD,Zagoria RJ,et al.Computerized tomography guided access for percutaneous nephrostolithotomy[J].J Urol,2003,170(1):45-47.
[10]Gu Z,Qi J,Shen H,et al.Percutaneous nephroscopic with holmium laset and ultrasound lithotripsy for complicated renal calculi[J].Lasers Med Sci,2010,25(4):577-580.
[11]Basiri A,Naijaran TV,Mohammadi SM,et al.Spontaneous resolution of severe hemorrhagic intrarenal pseudoaneurysm after percutaneous nephrolithotomy[J].Urol J,2010,7(1):10-11.
[12]Rastinehad AR,Andonian S,Smith AD,et al.Management of hemorrhagic complications associated with percutaneous nephrolithotomy[J].J Endourol,2009,23(10):1763-1767.
[13]王声兴,梁培养,许海波,等.微通道经皮肾镜取石术的出血及其治疗[J].海南医学,2008,19(1):44-45.
[14]钱冲,黎显瑞,刘成倍.超选择性肾动脉栓塞对微创经皮肾镜取石术后肾出血的应用价值:附14例报告[J].山西医科大学学报,2010,41(5):465-467.
[15]Vorrakitpokatorn P,Permtongchuchai K,Raksamani EO,et al.Perioperatibe complications and risk factors of percutaneous nephrolithotomy[J].J Med Assoc Thai,2006,89(6):826-833.

