赖氨酰氧化酶与乳腺癌侵袭转移相关因子的研究*
杨华伟,刘剑仑,李景涛,刘起鹏,韦 薇,唐 玮,蒋 奕
(广西医科大学附属肿瘤医院乳腺科,南宁530021)
乳腺癌是女性最常见的恶性肿瘤之一,其复发转移是乳腺癌死亡的最主要原因[1]。近年来的研究发现,赖氨酰氧化酶(lysyl oxidase,LOX)的表达异常与乳腺癌的侵袭转移密切相关[2]。但LOX在乳腺癌侵袭转移中的作用机制尚不清楚。本研究组前期结果提示,LOX可以促进乳腺癌的侵袭转移,LOX基因在高侵袭潜能的乳腺癌细胞MDA-MB-231中高表达,在低侵袭性MCF-7细胞中低表达[3]。本研究通过构建LOX慢病毒干扰载体(LOX-RNAi-LV),抑制高侵袭转移乳腺癌细胞MDA-MB-231中LOX基因表达,并检测LOX、基质金属蛋白酶-2(matrixmetalloproteinases-2,MMP-2)、基质金属蛋白酶-9(MMP-9)和 低 氧 诱 导 因 子-1α(hypoxia-inducible factor-1α(HIF-1α)的表达变化,通过乳腺癌裸鼠移植瘤模型分析LOX蛋白与MMP-2、MMP-9及HIF-1α蛋白相关性,探讨LOX在乳腺癌侵袭转移中可能的作用机制。
1 材料与方法
1.1 材料与试剂 人乳腺癌细胞MDA-MB-231购于南京凯基生物技术有限公司;人乳腺癌MCF-7细胞由广西医科大学基础实验室馈赠;LOX-RNAi-LV由上海吉凯基因化学技术有限公司构建包装;Trizol Reagent购自美国Invitrogen公司;Quant SYBR Green PCR试剂盒为北京TianGen公司产品;PCR引物由上海生工生物工程有限公司合成;荧光定量PCR为美国Bio-Rad,iQTM5Multicolor;LOX兔抗人多克隆抗体购自美国Novus生物公司;病理图像分析仪DMR+550为德国莱卡公司。
1.2 LOX-RNAi-LV的构建 由Ambition公司设计、合成针对人LOX基因的siRNA,序列如下,上游引物:GGA ACU UUA GUG AAA CAU AAU,下游引物:UAU GUU UCA CUA AAG UUC CAG。合成含干扰序列的双链DNA oligo,其两端含酶切位点粘端,直接连入酶切后的载体pGCL-GFP(含U6启动子)上。验证后进行病毒包装,检测滴度和复感染指数后进行细胞转染干扰实验。
1.3 细胞培养及转染 人乳腺癌细胞MDA-MB-231培养于含10%胎牛血清的高糖DMEM培养基中,37℃、5%CO2的恒温箱中培养。将处于对数生长期的3×105个细胞/孔接种于6孔板中,待细胞覆盖率达70%时进行转染,干扰组加入1.5×108TU/mL病毒液LOX-RNAi-LV 30μL,阴性对照组加入1.5×108TU/mL GFP-NC-LV 30μL,空白对照组除不作转染外其余处理与以上各组相同。每组设3个平行孔,分别于感染24、48、72、96h后,观察荧光表达情况。
1.4 转染72h后实时荧光定量PCR检测LOX mRNA,MMP-2mRNA,MMP-9mRNA及HIF-1αmRNA表达 Trizol法提取各组细胞总RNA,检测细胞总RNA浓度,取2μg总RNA逆转录合成cDNA。引物序列:MMP-2上游引物:TGC CCA AGA ATA GAT GCT GAC,下游引物:GAA AGG AGA AGA GCC TGA AGT G,长度160bp;MMP-9上游引物:CTT CTG CCC GGA CCA AGG ATA C,下游引物:TTC AGG GCG AGG ACC ATA GAG G,长度187bp;HIF-1α,上游引物:CCA GTT ACG TTC CTT CGA TCA GT,下游引物:TTT GAG GAC TTG CGC TTT CA,长度74bp;LOX上游引物:CAG GCA CCG ACC TGG ATA TGG,下游引物:CGT ACG TGG ATG CCT GGA TGT AGT,长度193bp;β-actin上游引物:AGT TGC GTT ACA CCC TTT CTT G,下游引物:CAC CTT CAC CGT TCC AGT TTT,长度148bp。Real-time PCR按Quant SYBR Green PCR试剂盒说明书操作,每例样品各做3个平行管,在实时荧光定量基因扩增仪进行扩增。反应条件:MMP-2:预变性95℃2min,变性95℃30s,退火58℃30s,40个循环,延伸72℃31s。MMP-9:预变性95℃5min,变性95℃45s,退火59℃30s,40个循环,延伸72℃31s。HIF-1α:预变性95℃3min,变性95℃30s,退火57℃30s,40个循环,延伸72℃31s。LOX:预变性94℃3min,变性94℃30s,退火59℃30s,40个循环,72℃31s。读取Ct值,参照文献比较阈值法计算[4]:首先按公式“△Ct=CT平均值(LOX)-CT平均值(β-actin)”分别计算对照组和干扰组的△CT,再按公式“ΔΔCT=ΔCT干扰组-ΔCT对照组”得到“2-ΔΔCT”代 表目 的 基 因 相 对 表达 量。(1-2-ΔΔCT)×100% 为LOX基因表达抑制率。
1.5 转染72h后 Western blot检测LOX蛋白表达 提取MDA-MB-231细胞总蛋白,操作步骤按照RIPA裂解液使用说明进行,并用BCA法测定蛋白浓度。取10μL约30μg的总蛋白进行10%SDS-PAGE电泳后,湿法转至PVDF膜上,一抗、二抗标记,电化学发光法显影。LOX蛋白与β-actin蛋白条带的灰度比值反映LOX蛋白的相对表达水平。
1.6 乳腺癌裸鼠原位移植瘤模型的建立 实验裸鼠随机分为3组,每组20只,分别接种MDA-MB-231、MCF-7及干扰LOX基因表达的MDA-MB-231细胞[3]。取对数生长的上述3种细胞,细胞浓度为1.0×108/mL。抽取3种细胞悬液各0.1mL分别注入60只祼鼠的乳腺脂肪垫内。接种后6周,裸鼠颈椎脱位致死做后续试验。
1.7 免疫组织化学法检测LOX、MMP-2、MMP-9及 HIF-1α蛋白表达 免疫组织化学采用标记的链霉素抗生物素蛋白-生物素免疫染色(streptavidin peroxidase,SP)方法,实验步骤按说明书进行。以已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.8 免疫组织化学染色结果判断 LOX、MMP-2及 MMP-9染色以细胞浆出现棕黄色颗粒为阳性,HIF-1α蛋白的表达部位主要在细胞核,呈棕黄色颗粒为阳性。随机选择10个高倍(×400)视野,根据肿瘤细胞着色数量多少,半定量分为4级:无着色为阴性(-),阳性细胞小于25%为弱阳性,阳性细胞25%~50%为中度阳性(++),阳性细胞大于50%为强阳性(+++)。
1.9 统计学处理 应用SPSS13.0软件对数据进行统计学分析,数据均以±s表示。采用配对样本t检验、Spearman等级相关、两独立样本比较的Wilcoxon秩和检验、多个独立样本比较Kruskal-Wallis H秩和检验进行分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒转染效率的检测 LOX-RNAi-LV转染乳腺癌细胞株MDA-MB-231,60h后有GFP荧光表达,72h后表达明显增强,荧光表达率达90%。
2.2 实时荧光定量PCR检测各组LOX mRNA、MMP-2mRNA、MMP-9mRNA及HIF-1αmRNA表达 样品mRNA经逆转录,实时荧光定量PCR仪分析获得目的基因和内参β-actin扩增片段的Ct值、扩增曲线和融解曲线。转染72h后,转染组LOX mRNA相对表达量与空白组比较,干扰组的LOX mRNA被抑制,抑制率达89.2%,经方差分析,差异有统计学意义(P<0.05)。实时荧光定量PCR结果显示,干扰组MMP-2、MMP-9mRNA相对表达量均明显低于阴性组和空白组,差异有统计学意义(P=0.000)。

图1 Western blot检测转染LOX-RNAi-LV后各组LOX蛋白的表达情况
表1 各组LOX蛋白表达水平(±s)

表1 各组LOX蛋白表达水平(±s)
*:P<0.05,与阴性对照组及空白组比较。
组别 条带光密度相对比值LOX/β-actin转染组 0.156±0.004*空白组 0.916±0.007阴性对照组0.696±0.020
2.3 Western blot检测各组LOX蛋白表达 转染72h后,干扰组的LOX蛋白水平与空白组和阴性对照组比较明显被抑制,抑制率达82.97%(图1、表1)。
2.4 免疫组织化学法检测LOX及相关因子的蛋白表达 取体内裸鼠移植瘤标本,用免疫组织化学法分别检测MDA-MB-231组、MDA-MB-23(LOX干扰)组、MCF-7组中LOX、MMP-2、MMP-9及HIF-1α蛋白的表达情况。
2.4.1 LOX蛋白在裸鼠移植瘤组织中的表达 LOX蛋白主要表达于胞核、胞浆中出现棕色颗粒为阳性(图2),LOX蛋白在 MDA-MB-231组、MDA-MB-231(LOX干扰)组、MCF-7组中表达情况,见表2。

表2 LOX、MMP-2、MMP-9、HIF-1а蛋白在3组的表达情况 比较
2.4.2 MMP-2蛋白在裸鼠移植瘤组织中的表达 MMP-2蛋白主要表达在细胞浆(图3)。MMP-2蛋白在 MDA-MB-231组、MDA-MB-231(LOX干扰)组、MCF-7组中的表达情况,见表2。
2.4.3 MMP-9蛋白在裸鼠移植瘤组织中的表达 MMP-9蛋白主要表达在细胞浆。MMP-9蛋白在MDA-MB-231组、MDA-MB-231(LOX干扰)组、MCF-7组中的表达情况,见表2。

图2 裸鼠移植瘤LOX(+++)阳性表达免疫组织化学影像学表现(SP,×400)
2.4.4 HIF-1α蛋白在裸鼠移植瘤组织中的表达 HIF-1α蛋白的表达部位主要在细胞核。HIF-1α蛋白在 MDA-MB-231组、MDA-MB-231(LOX干扰)组、MCF-7组中的表达情况,见表2。
2.5 LOX蛋白与 MMP-2、MMP-9及HIF-1α蛋白的相关性 Spearman相关分析显示LOX蛋白与 MMP-2(r=0.696,P=0.000)、MMP-9(r=0.735,P=0.000)、HIF-1α(r=0.737,P=0.000)蛋白呈显著正相关。
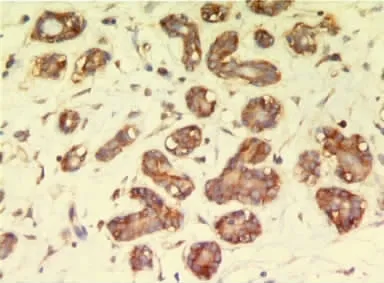
图3 裸鼠移植瘤MMP-2(+++)阳性表达免疫组织化学影像学表现(SP,×400)
3 讨 论
LOX是一种铜依赖性氧化酶,是细胞外基质中胶原与弹性蛋白聚合起始阶段并稳定细胞外基质(extracellular matrix,ECM)的关键酶[5]。研究表明LOX表达与乳腺癌的复发转移有关[6],在乳腺癌、食管癌、头颈部恶性肿瘤和黑色素瘤中高表达[7-9]。肿瘤细胞中表达上调的LOX,能够促进肿瘤细胞扩散到其他组织器官,肿瘤组织缺氧提示癌细胞的生长和分裂速度快,HIF-1可诱导LOX mRNA活性增高,可能是导致癌细胞侵袭转移的主要原因[10]。肿瘤细胞实现其侵袭转移必须解除细胞外基质的束缚,这有赖于基质金属蛋白酶(matrix metallo-proteinases,MMPs)、组 织 蛋 白 酶 (cathepsins)等,MMP-2、MMP-9能降解Ⅳ型胶原,MMPs促进乳腺癌浸润和转移的机制与降解细胞外基质、促进血管生成及调节细胞黏附有关,而MMP-2和MMP-9蛋白的高表达使其相应的特异性抑制剂的表达失去平衡,导致基底膜的主要成分(Ⅳ型、Ⅶ型、Ⅹ型胶原和明胶)被降解[11-12]。Erler等[13-14]不但发现侵袭转移性乳腺癌细胞株中LOX表达上调,LOX反义寡聚核苷酸或LOX小分子抑制剂能抑制乳腺癌细胞株的侵袭能力,还发现LOX不仅介导了侵袭转移性乳腺癌细胞株MDA-MB-231对胶原Ⅰ基质的侵袭作用,而且引起MMPs的活性增强,同时发现乳腺癌、头颈癌患者肿瘤组织的低氧状况与LOX表达水平明显相关,认为LOX mRNA通过LOX启动子中功能性低氧反应元件受到HIF-1α的调控。LOX可能是一个低氧反应基因[15]。
本研究采用LOX-RNAi-LV稳定转染MDA-MB-231细胞后,干扰组LOX mRNA和LOX蛋白与阴性对照组和空白对照组比较差异有统计学意义,说明LOX-RNAi-LV转染后MDA-MB-231细胞LOX mRNA和LOX蛋白表达受到显著抑制。同时,实时荧光定量PCR检测结果显示,干扰组MMP-2、MMP-9及HIF-1α及基因表达与空白组和阴性对照组比较差异有统计学意义(P<0.05),说明抑制了LOX的表达其MMP-2及MMP-9、HIF-1α及Ki-67的表达同时也受到了明显的抑制;乳腺癌细胞MDA-MB-231、MCF-7和LOX基因干扰的裸鼠移植瘤模型中 MDA-MB-231组LOX、MMP-2、MMP-9及HIF-1α蛋白表达水平明显高于LOX基因干扰组及MCF-7组,而且LOX的表达与 MMP-2、MMP-9及HIF-1α成显著正相关。
作者推测可能是由于MMPs水解ECM,松解了致密的胶原基质结构,促进肿瘤细胞移行,而LOX的过表达改变了肿瘤细胞外基质的结构,激活某些特定信号传导通路,上调了MMPs的表达,MMPs通过降解基底膜,去除了肿瘤细胞侵蚀和转移的物理屏障,破坏了血管壁的完整性,同时增加了微血管的通透性,介导内皮细胞迁移和侵蚀,诱导新生血管形成,从而促进了乳腺癌的侵袭转移;而且低氧环境影响下上调LOX的表达,刺激乳腺癌细胞发生侵袭转移。LOX和 MMP-2、MMP-9及HIF-1α转移因子可能具有协同促进作用,促进了乳腺癌的侵袭转移。因此,进一步探索LOX在乳腺癌侵袭转移中的可能作用机制,将有助于更好地阐述乳腺癌的生物学行为。
[1]Coughlin SS,Ekwueme DU.Breast cancer as a global health concern[J].Cancer Epidemiol,2009,33(5):315-318.
[2]Patani N,Jiang W,Newbold R,et al.Prognostic implications of carboxyl-terminus of Hsc70interacting protein and lysyl-oxidase expression in human breast cancer[J].J Carcinog,2010,12(9):975-978.
[3]杨华伟,刘剑仑,耿莹,等.siRNA干扰LOX基因对乳腺癌细胞株侵袭性影响的研究[J].山东医药,2010,50(1):8-9.
[4]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[5]Rodríguez C,Rodríguez-Sinovas A,Martínez-González J.Lysyl oxidase as a potential therapeutic target[J].Drug News Perspect,2008,21(4):218-224.
[6]Bondareva A,Downey CM,Ayres F,et al.The lysyl oxidase inhibitor,beta-aminopropionitrile,diminishes the metastatic colonization potential of circulating breast cancer cells[J].PLoS One,2009,4(1):56-20.
[7]Le QT,Harris J,Magliocco AM,et al.Validation of lysyl oxidase as a prognostic marker for metastasis and survival in head and neck squamous cell carcinoma:Radiation Therapy Oncology Group trial 90-03[J].J Clin Oncol,2009,27(26):4281-4286.
[8]Sakai M,Kato H,Sano A,et al.Expression of lysyl oxidase is correlated with lymph node metastasis and poor prognosis in esophageal squamous cell carcinoma[J].Ann Surg Oncol,2009,16(9):2494-2501.
[9]Abourbih DA,Di Cesare S,Orellana ME,et al.Lysyl oxidase expression and inhibition in uveal melanoma[J].Melanoma Res,2010,20(2):97-106.
[10]Choi JY,Jana YS,Min SY,et al.Overexpression of MMP-9 and HIF-1αin breast cancer cells under hypoxic conditions[J].J Breast Cancer,2011,14(2):88-95.
[11]Barker HE,Chang J,Cox TR,et al.LOXL2-mediated matrix remodeling in metastasis and mammary gland involution[J].Cancer Res,2011,71(5):1561-1572.
[12]Levental KR,Yu H,Kass L,et al.Matrix crosslinking forces tumor progression by enhancing integrin signaling[J].Cell,2009,25(5):891-906.
[13]Erler JT,Giaccia AJ.Lysyl oxidase mediates hypoxic control of metastasis[J].Cancer Res,2006,66(11):1238-1241.
[14]Erler JT,Bennewith KL,Nicolau M,et al.Lysyl oxidase is essential for hypoxia-induced metastasis[J].Nature,2006,440(10):1222-1226.
[15]Pez F,Dayan F,Durivault J,et al.The HIF-1-inducible lysyl oxidase activates HIF-1via the akt pathway in a positive regulation loop and synergizes with HIF-1in promoting tumor cell growth[J].Cancer Res,2011,71(5):1647-1657.

