人参皂苷Rbl对大鼠脑缺血再灌注JAK2/STAT3信号转导通路的影响*
余 录,胡光强,陈碧琼,涂 华,杨朝鲜
(泸州医学院:1.基础医学院;2.神经生物研究室,四川泸州646000)
脑卒中为目前世界上致死率和致残率排名第2位的疾病[1],缺血性脑卒中占卒中病例的70%~80%,是脑卒中的主要类型,严重威胁人类健康与生命安全。因此,开发安全、有效的治疗药物、寻找确切的治疗靶点已是当前迫切需要。人参是中国传统中药之精品,人参皂苷(ginsenoside,GR)是人参的主要有效成分,在临床上尤其是神经科得到广泛的应用。GR按苷元的不同分多种类型,其中,GRbl含量最为丰富。研究表明,GRbl能通过抗炎、抗氧化、抗凋亡等保护脑缺血再灌注损伤。Janus激酶/信号转导和转录激活因子(Janus kinases/signal transducers and activators of transcription,JAKs/STATs)是细胞因子及氧化应激的一条重要的胞内信号转导途径,与脑缺血等中枢神经系统疾病的病理生理过程密切相关[2]。本实验通过建立大鼠大脑中动脉缺血再灌注(MCAO/R)模型,探讨GRbl对JAK2/STAT 3胞内信号通路的影响,明确其保护机制。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 GRbl(纯度大于或等于98%,白色粉末,批号:ZL20100705A),由南京泽朗植提技术有限公司提供。磷酸化JAK2多克隆抗体,磷酸化STAT3单克隆抗体(Santa Cruz公司产品)。SABC试剂盒(武汉博士德生物工程有限公司),TNF-α、IL-6ELISA试剂盒(北京环亚泰克生物医学技术有限公司);考马斯亮兰蛋白测定试剂盒(南京建成生物工程研究所),其他试剂均为国产分析纯。
1.1.2 实验动物及分组 雄性SD大鼠,体质量250~300g,购自第三军医大学动物饲养中心。随机分为4组:假手术组、溶媒组、GRbl高剂量组(40mg/kg)、GRbl低剂量组(20mg/kg)。假手术组和溶媒组给予等量的生理盐水,药物和溶媒均在再灌时立即腹腔注射。
1.2 方法
1.2.1 MCAO/R模型的建立 大鼠用10%水合氯醛(350 mg/kg)腹腔注射麻醉后,将其仰卧固定于手术台上,从颈部正中切口,依次小心分离右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),结扎并剪断ECA,在ECA近分叉处用眼科手术剪剪一小口,从ECA往ICA插入制备好的栓线,栓线头端圆润,直径约0.34mm,插入深度为18~20mm,感到有阻力时停止插入,然后将栓线尾端固定于ECA上,逐层缝合肌肉皮肤。缺血2h后,将栓线头端拉出实现再灌注。术中由红外灯照射使大鼠体温维持在37℃。假手术组除不插入线栓外,其余步骤相同。
1.2.2 神经行为学评分 缺血后2h,参照Longa等[3]方法对大鼠进行神经功能缺失评分。0分:无任何神经功能缺损;1分:右前肢不能完全伸展;2分:向左侧转圈;3分:行走或静止时向左侧倾倒;4分:不能自主活动;5分:死亡。在初次评分后满足1~3分的大鼠纳入后继的实验组。再灌注后24h,再次对大鼠进行神经行为学评分并进行统计学处理。
1.2.3 TNF-α、IL-6的含量测定 每组8只大鼠,再灌24h后,将大鼠麻醉,剖开胸腔,剪破右心耳,用生理盐水从左心室灌流至流出液为澄清,取出大脑缺血侧-80℃保存,测定前称重,以1∶10比例加入冰生理盐水匀浆,3 500r/min离心15min,取出上清液,严格按照ELISA试剂盒说明书检测TNF-α、IL-6的含量。
1.2.4 p-JAK2和p-STAT3免疫组织化学的检测 每组4只大鼠,再灌注24h后,先用冰冻的PBS溶液(pH为7.2~7.4)约200mL快速灌流,再用4%的多聚甲醛溶液灌流。然后迅速剪开颅骨,取出大脑,用10%中性甲醛固定24~48h,从大脑前囟-2.3mm处向后切取厚约3mm的冠状脑组织,用石蜡包埋,制作厚度约5μm的脑部冠状切片,用于免疫组织化学染色。免疫组织化学采用SABC法。将石蜡切片脱蜡、复水,3%的H2O2灭活内源性过氧化物酶,然后用微波进行抗原修复、5%BSA液封闭,清洗后加一抗(p-JAK2和p-STAT3),37℃孵育2h,移置于4℃冰箱过夜。加二抗孵育1h,清洗后滴加SABC,37℃孵育1h后,清洗。DAB显色,苏木素复染,盐酸乙醇分化、氨水返蓝、脱水封片。
1.3 统计学处理 免疫组织化学染色后,取缺血侧皮层额叶4个不重叠的区域采图,然后用Image Pro-plus5.0软件分析免疫组织化学阳性表达的累积光密度值(IOD)并计算每组平均值。所有实验数据以±s表示,实验结果采用SPSS16.0软件进行统计分析,组间比较采用单因素方差分析的方法进行,以P<0.05为差异有统计学意义。
2 结 果
2.1 GRbl对缺血再灌注大鼠神经行为学评分的影响 再灌24 h后,大鼠出现明显的神经运动功能障碍,其主要表现为Horner综合征即右侧瞳孔缩小、眼睑下垂、眼裂狭小甚至眼底出血呈红肿,肢体障碍即提尾时左前肢内收、肩内旋、肌张力明显降低,爬行时向右侧划圈、追尾,甚至倾倒或不能自行行走。与溶媒组比较,GRbl高剂量组神经行为学评分明显降低(P<0.05),GRbl低剂量组评分也有所降低,但差异无统计学意义,见表1。
2.2 GRbl对脑缺血再灌注大鼠脑组织中TNF-α和IL-6的影响 缺血2h再灌注24h后,溶媒组TNF-α、IL-6含量明显增高。与溶媒组比较,GRbl低剂量组、高剂量组TNF-α含量均显著降低(P<0.05或P<0.01),IL-6的含量也有所降低,其中,高剂组显示差异有统计学意义(P<0.05),结果见表2。
表1 GRbl对脑缺血再灌注大鼠神经功能评分的影响(±s,n=12)

表1 GRbl对脑缺血再灌注大鼠神经功能评分的影响(±s,n=12)
*:P<0.05,与溶媒组比较。
组别 神经行为学评分假手术组0.00±0.00溶媒组 2.75±0.96 GRbl低剂量组 2.28±0.51 GRbl高剂量组 1.66±0.65*
表2 各组大鼠脑组织中TNF-α、IL-6的含量比较(±s,n=8)
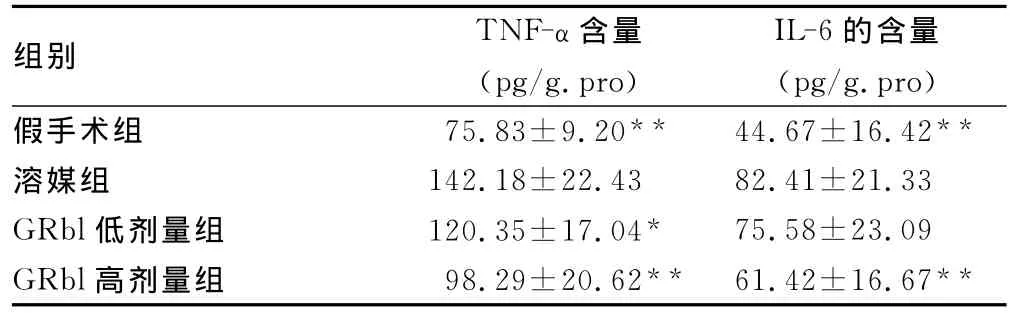
表2 各组大鼠脑组织中TNF-α、IL-6的含量比较(±s,n=8)
*:P<0.05,**:P<0.01,与溶媒组比较。
组别 TNF-α含量(pg/g.pro)IL-6的含量(pg/g.pro)假手术组 75.83±9.20** 44.67±16.42**溶媒组 142.18±22.43 82.41±21.33 GRbl低剂量组 120.35±17.04* 75.58±23.09 GRbl高剂量组 98.29±20.62** 61.42±16.67**

图1 p-JAK2和p-STAT3免疫组织化学染色影像学表现(×400)
2.3 GRbl对大鼠脑缺血再灌注损伤后p-JAK2,p-STAT3表达的影响 假手术组未见p-JAK2和p-STAT3免疫阳性细胞的表达,而在溶媒组可见到缺血侧大量的深棕色阳性细胞的表达,主要集中在缺血半暗带,在缺血核心区也有少量表达。GRbl高剂量组、低剂量组p-JAK2和p-STAT3蛋白表达量明显减少(P<0.05或P<0.01),结果见图1~2。
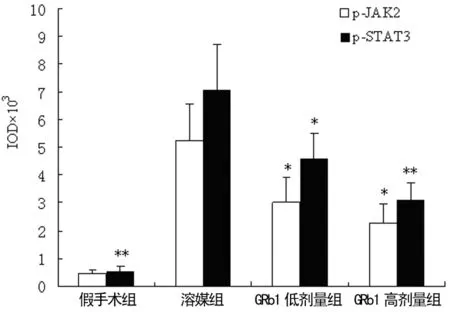
图2 p-JAK2和p-STAT3免疫组织化学染色阳性表达累积光密度值
3 讨 论
缺血性卒中损伤涉及的病理机制极为复杂。诸多证据显示,炎症事件介导缺血再灌注损伤的病理进程[4]。炎症级联反应中,细胞因子、转录因子等扮演着重要角色,最终导致神经损伤与功能障碍。JAKs/STATs是细胞因子、氧化应激等介导的重要胞内信号转导途径[5]。JAKs蛋白家族包括JAK1、JAK2、JAK3、TYK2,而 STATs 蛋 白 家 族 包 括 STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6。其中JAK2/STAT3与脑缺血密切相关。脑缺血及再灌注损伤导致大量炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6),生长因子以及活性氧的产生和释放,这些因子与特异受体结合激活JAKs使其酪氨酸残基磷酸化,识别STATs的SH2区域并转移至细胞核,调节靶基因的表达,引起白细胞聚集于梗死外周区域,进一步参与迟发性炎性反应,导致神经毒性作用,造成恶性循环。
人参是珍贵的多年生草本植物,具有补气生血、安神益智、生津止渴之功效。GR是人参、三七等中药材的主要有效成分,在临床上尤其是神经科得到广泛的应用。GR按二元的结构可分为齐墩果酸型、原人参二醇型(如Rb1、R3)和原人参三醇型(Rg1),GRbl是其中含量最丰富的人参皂苷单体之一,其具有广泛的药理学活性,作用于中枢神经系统、心血管系统、免疫系统等[6]。研究表明,GRbl能通过抗凋亡等保护脑缺血再灌注损伤[7-8],而缺血后JAK2/STAT3信号通路异常激活导致神经元凋亡的发生,应用JAK2特异性抑制剂AG490阻断JAK2和STAT3的磷酸化,而且具有抗细胞凋亡作用[9]。GRbl能抑制缺血再灌注炎性反应[10],而IL-6、活性氧是选择性激活JAK2/STAT1、STAT3的细胞因子。有研究发现,GRbl通过JNK/p38MAPK信号途径减轻神经元tau蛋白的过度磷酸化,而阻断MAPK的作用后,STAT的转录活性明显降低,表明 MAPK可能激活STAT的转录活性[11]。因此,GRbl有可能作用于脑缺血损伤中的JAK2/STAT3信号通路。
本实验研究发现,大脑缺血2h再灌24h后,大鼠有明显的神经行为学缺失症状,缺血侧脑组织可见明显的水肿以及苍白色的梗死灶,脑组织中细胞因子TNF-α、IL-6的含量明显增加。Acalovschi等[12]研究表明,IL-6加重脑缺血损伤,其水平与脑梗死体积相关,是神经功能恶化的预警器。本实验免疫组织化学染色发现,缺血侧皮层p-JAK2和p-STAT3免疫阳性表达提高,而先前文献报道,缺血再灌注24h,磷酸化STAT3蛋白在缺血半暗带区达高峰。本实验在给予人参皂苷处理后,大鼠神经功能障碍减轻,脑组织中炎性细胞因子TNF-α、IL-6含量降低,p-JAK2和p-STAT3的表达也明显减少,表明GRbl可能通过抑制细胞因子介导的JAK2/STAT3信号途径保护脑缺血再灌注损伤。
[1]Liu M,Wu B,Wang WZ,et al.Stroke in China:epidemiology,prevention,and management strategies[J].Lancet Neural,2007,6(5):456-458.
[2]Satriotomo I,Bowen KK,Vemuganti R.JAK2and STAT 3 activation contributes to neuronal damage following transient focal cerebral ischemia[J].Neurochem,2006,98(5):1353-1356.
[3]Longa E,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-86.
[4]Muir KW,Tyrrell P,Sattar N,et al.Inflammation and ischaemic stroke[J].Curr Opin Neurol,2007,20(3):334-336.
[5]Campbell IL.Cytokine-mediated inflammation,tumorigenesis,and disease-associated JAK/STAT/SOCS signaling circuits in the CNS[J].Brain Res Rev,2005,48(2):166-168.
[6]杨艳萍.人参皂苷Rbl药理作用的研究概述[J].中国药师,2010,13(2):280-282.
[7]Gao XQ,Yang CX,Chen GJ,et al.Ginsenoside Rb1regulates the expressions of brain-derived neurotrophic factor and caspase-3and induces neurogenesis in rats with experimental cerebral ischemia[J].J Ethnopharmacology,2010,132(2):393-395.
[8]杨朝鲜,周玲,袁琼兰,等.大鼠局灶性脑缺血时人参皂苷Rbl抑制细胞凋亡和调控凋亡基因的表达[J].中风与神经疾病杂志,2008,5(1):135-137.
[9]谢惠芳,徐如祥,魏继鹏.JAK2/STAT3信号转导通路在缺血性脑损伤中作用机制的研究[J].中风与神经疾病杂志,2008,25(2):135-137.
[10]Zhu J,Jiang Y,Wu L,et al.Suppression of local inflammation contributes to the neuroprotective effect of ginsenoside Rb1[J].Neuroscience,2012,202(3):342-344.
[11]Finbloom DS,Larner AC.Regulation of the Jak/STAT signalling pathway[J].Cell Signal,1995,7(8):739-742.
[12]Acalovschi D,Wiest T,Hartmann M,et al.Multiple levels of regulation of the interleukin-6system in stroke[J].Stroke,2003,34(8):1864-1866.

