FolFox方案新辅助化疗对Ⅱ、Ⅲ期大肠癌手术患者血T- 细胞亚群的影响*
朱其勇,黄海宁,吴 可,梁建明,韦京君,尹 刚,周 莎,蒋荣刚,陈 博,吴 峰
(广西壮族自治区桂林市中西医结合医院:1.肿瘤科;2.肛肠外科;3.检验科 541004)
大肠癌的发病率随着国人的生活水平的提高而快速增高,而大肠癌的临床治疗效果仍未能明显提高。目前,根治性手术治疗仍是大肠癌的最佳治疗手段,围术期以奥沙利铂为主的FolFox新辅助治疗手段越来越得到广大临床医生的认可,对于FolFox新辅助化疗方案在大肠癌不同分期中有效治疗的同时,其对机体的免疫功能影响的程度,目前尚未见报道。本文对此进行了研究分析,现报道如下。
1 资料与方法
1.1 入组标准 参加本试验的患者均为临床诊断为Ⅱ、Ⅲ期大肠癌患者,包括升结肠癌、横结肠癌、降结肠癌,乙状结肠癌及直肠癌,有根治性手术适应证。治疗前肝肾功能、血常规及心电图均正常,未经任何治疗、首诊的病理确诊患者。
1.2 排除标准 大肠癌为患者就诊时的惟一疾病,排除合并包括严重肺结核、肝炎等传染性疾病、慢性阻塞性肺病、结缔组织病等损害免疫系统的病患,并排除艾滋病、过敏性疾病等明显影响免疫功能的疾病,无贫血及低蛋白血症。
1.3 一般资料 2009年1月至2012年1月在本院住院的大肠癌患者65例,其中,男40例,女25例,年龄24~68岁,平均54.5岁,患者生活质量状态评分(KPS)≥80分;经术前临床检查确诊为大肠癌患者,全部患者均进行FolFox方案新辅助化疗,化疗结束后1周行大肠癌根治性手术,术后根据国际TNM分期标准将患者进行临床病理分期[1],其中Ⅱ期组36例,Ⅲ期组29例。两组患者在年龄、性别、肿瘤原发部位及KPS评分等方面比较差异均无统计学意义(P>0.05),具有可比性。见表1。
1.4 治疗方法
1.4.1 新辅助化疗方法 两组均采用FolFox方案:首先作锁骨下深静脉穿刺置管,建立静脉通道,并常规进行保肝、护胃、止吐等辅助治疗,未配合任何免疫制剂的治疗:第1天静脉注射奥沙利铂针145mg/m2,2h,亚叶酸钙针 500mg/m2,2h;接着5-Fu 3.5g/m2,持续静脉滴注(CIV)48h。在新辅助化疗后1周监测血象及肝、肾功能、电解质,并记录卡氏评分,如Karnofsky评分大于或等于80分则进入标准开放式大肠癌根治术。
1.4.2 手术方式 根据肿瘤所在大肠部位决定手术方式,均为标准开放式根治术。包括左半结肠切除术23例、右半结肠切除术11例、横结肠切除术5例、乙状结肠切除术20例、高位直肠癌保肛术手术6例。围手术期不输血。
1.4.3 检测方法 在新辅助化疗前1d、手术后第7天、手术后第14天晨起空腹分别采集肘静脉血2mL,常规肝素抗凝送检,采用流式细胞术检测 T-细胞亚群水平(CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+)。同时检测30例健康体检人群的外周血T-细胞亚群水平作为健康组并分别与Ⅱ期组及Ⅲ期组进行对比。
1.5 统计学处理 采用SPSS13.0软件对数据进行统计学分析处理,数据采用±s表示,两样本均数采用t检验,多组比较采用单因素方差分析,多组间比较采用LSD法,以P<0.05为差异有统计学意义。
2 结 果
65例入组病例均按正常途径完成治疗,FolFox方案新辅助化疗对Ⅱ、Ⅲ期大肠癌手术患者外周血T-细胞亚群的影响以及与正常健康组的比较如下(表2~4)。
表1 Ⅱ期组及Ⅲ期组一般临床资料比较(±s)
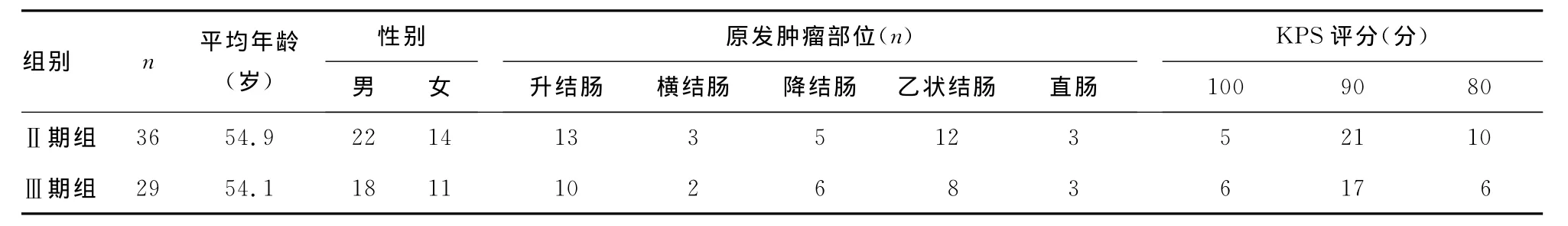
表1 Ⅱ期组及Ⅲ期组一般临床资料比较(±s)
组别 n 平均年龄(岁)性别男 女原发肿瘤部位(n)升结肠 横结肠 降结肠 乙状结肠 直肠KPS评分(分)100 90 80 36 54.9 22 14 13 3 5 12 3 5 21 10Ⅲ期组Ⅱ期组29 54.1 18 11 10 2 6 8 3 6 17 6
表2 新辅助化疗前各组间免疫指标比较(±s)

表2 新辅助化疗前各组间免疫指标比较(±s)
*:P>0.05,与健康组比较;△:P>0.05,与Ⅲ期组比较。
组别 n CD3+ CD3+CD4+ CD3+CD8+ CD4+/CD8+健康组 30 1 022.65±164.22 623.45±91.05 337.12±100.52 1.943 3±0.410 6Ⅱ期组 36 1 021.81±188.72*△ 623.35±122.15*△ 338.67±105.47*△ 1.951 4±0.455 9*△Ⅲ期组 29 1 018.34±191.33 620.16±120.12 341.39±102.72 1.960 1±0.491 1 F 0.021 0.014 0.011 0.009 P 0.945 0.967 0.946 0.985
表3 大肠癌根治术后1周各组间免疫指标比较(±s)

表3 大肠癌根治术后1周各组间免疫指标比较(±s)
组别 n CD3+ CD3+CD4+ CD3+CD8+ CD4+/CD8+健康组 30 1 022.65±164.22 623.45±91.05 337.12±100.52 1.943 3±0.410 6Ⅱ期组 36 986.25±132.16*△ 562.41±70.89*△ 381.53±87.18*△ 1.654 2±0.301 4*△Ⅲ期组 29 920.31±139.47 467.21±76.76 348.22±94.22 1.024 8±0.223 3 F 3.442 25.329 7.967 52.137 P 0.048 0.042 0.045 0.041
表4 大肠癌根治术后2周各组间免疫指标比较(±s)

表4 大肠癌根治术后2周各组间免疫指标比较(±s)
*:P>0.05,与健康组比较;△:P<0.05,与Ⅲ期组比较。
组别 n CD3+ CD3+CD4+ CD3+CD8+ CD4+/CD8+健康组 30 1 022.65±164.22 623.45±91.05 337.12±100.52 1.943 3±0.410 6Ⅱ期组 36 1 016.25±169.58*△ 614.51±120.83*△ 338.24±105.53*△ 1.912 2±0.434 7*△Ⅲ期组 29 964.14±175.32 566.52±101.78 301.17±112.75 1.692 4±0.485 9 F 0.197 0.093 0.082 0.501 P 0.045 0.048 0.047 0.042
3 讨 论
随着循证医学的发展,多学科综合治疗大肠癌显得愈来愈重要[2],尤其是近年来以奥沙利铂为主的FolFox新辅助化疗结合外科根治性手术为主的方案成为目前临床大肠癌常用的较有效的个体化的治疗方案之一。
FolFox新辅助化疗方案中的奥沙利铂是第三代铂类抗癌药,是目前临床一线常用的化疗药,抗癌机制是通过与DNA上的G点共价结合,形成内交联、链间交联使DNA损伤,影响DNA复制,促使癌细胞凋亡[3]。5-氟脲密啶以抗代谢物而起作用,是目前临床上应用最广的抗嘧啶类药物,对消化道癌及其他实体瘤有良好疗效,通过阻断脱氧核糖尿苷酸细胞内胸苷酸合成酶转化为胸苷酸,而干扰DNA的合成,主要作用于S期,而连续静脉注射达24h以上时则不良反应明显下降[4]。亚叶酸钙能增强5-氟尿嘧啶的抗肿瘤作用,奥沙利铂与5-氟脲密啶有协同效应,能明显抑制大肠癌细胞株的生长[5]。而化疗有效杀死肿瘤的同时,也会明显损害患者的免疫功能[6],在治疗过程中应掌握患者免疫损害的规律。对于恶性肿瘤根治术后,由于机体的保瘤负荷消失,机体的免疫功能则在短期内会明显增强[7]。由于结直肠癌手术对机体是一个较大伤害,不可避免在一定时间内造成对患者免疫功能的抑制[8],但本研究两组患者的临床资料比较差异无统计学意义,故手术对两组患者免疫力的抑制并不影响新辅助化疗对其血清T-细胞亚群水平的进一步对比研究。
大量的临床研究表明,经综合治疗后癌症患者的免疫功能,尤其是细胞免疫功能对患者的发展和预后有着重要的影响[9-10]。血清T-细胞亚群水平(CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+)代表细胞免疫功能,是肿瘤免疫的主要力量,CD3+代表成熟T细胞,反映机体免疫功能,按其表面标志和功能不同分为CD4+、CD8+两大亚群。正常情况下,T细胞亚群的数目处于相对平衡状态,免疫功能稳定,若T细胞总数或者CD4+/CD8+细胞比值发生异常时,机体即发生免疫调节紊乱,宿主免疫功能低下或受抑制[11],为肿瘤的复发和转移提供了有利的内环境,从而影响临床治疗肿瘤的效果。
本研究发现,Ⅱ期组与Ⅲ期大肠癌患者新辅助化疗前外周血T-细胞亚群水平与健康组对比,虽然细胞免疫功能有所下降,但差异无统计学意义(P>0.05),提示早中期大肠癌的免疫功能并没有明显受抑制,与部分临床研究结果不尽相同[12],对于以后的新辅助化疗及根治性手术对大肠癌的免疫功能的影响亦存在可比性;Ⅱ期组与Ⅲ期组患者手术后7d外周血T-细胞亚群免疫水平均下降,差异有统计学意义(P<0.05),Ⅲ期组较Ⅱ期组患者受到的免疫抑制更明显,与文献报道结果相符[13];Ⅱ期组与Ⅲ期组患者手术后14d外周血T-细胞亚群水平均有所恢复,且Ⅱ期组与健康组对比差异无统计学意义(P>0.05),而Ⅱ期组与Ⅲ期组间对比差异有统计学意义(P<0.05),表示Ⅱ期大肠癌患者经FolFox新辅助化疗及根治性手术后免疫功能较快恢复,在患者经济较困难的情况下可不使用免疫增强剂,为临床其他必要的治疗提供经济条件,而Ⅲ期患者的免疫抑制较Ⅱ期患者重,且在有效治疗后恢复更慢,应考虑尽快使用免疫增强剂来增强综合治疗效果。但与健康正常人的免疫功能相比,无论是Ⅱ期组患者还是Ⅲ期组患者均下降,若患者的经济许可,仍应常规结合术后的免疫治疗[14]。如果免疫功能持续抑制,则肿瘤复发和转移的机会将明显增加[15]。故临床上应适当加强大肠癌术后的免疫治疗,尤其是Ⅲ期以上的大肠癌患者将会明显获益。
[1]Castinglione F,Taddei A,Buccoliero AM,et al.TNM stanging and T-cell receptor gamma expression in colon adenocarinoma.Correlation with disease progression?[J].Tumori,2008,94(3):384-388.
[2]江陈,常家聪.大肠癌的治疗方法研究进展[J].安徽医药,2012,16(2):247-249.
[3]Kim DY,Kim JH,Lee SH,et al.PhaseⅡ study of oxaliplatin,5-fluorouracil and leucovorin in previoiusly-treated patients with advanced gastric cancer[J].Ann Oncol,2003,14(3):383-385.
[4]Chan I,Cunningham D.Adjuvant therapy in colon cancerwhat,when and hour[J].Ann Oncol,2006,17(9):1347-1359.
[5]林万隆,陈强.奥沙利铂的药理作用及临床应用[J].中国肿瘤临床,2000,27(11):872-874.
[6]蒋一玲,万宇,方红明.a-胸腺肽对晚期结直肠癌化疗患者的免疫功能及生存时间的影响[J].肿瘤学杂志,2009,15(10):900-902.
[7]Nichols PH,Ramsden CW,Ward U,et al.Peri-operative modulation of cellular immunity in patients with colorectal cancer[J].Clin Exp Immunol,1993,94(1):4-10.
[8]曹其彬,胡三元.腹腔镜与开腹结直肠癌手术对机体免疫功能的比较[J].中国普通外科杂志,2006,15(8):615-618.
[9]Yoshimura K,Laird LS,Chia CY,et al.Live attennated Listeria monocy to genus effectively treats hepatic colorecta cancer metastases and strongly enhanced by depletion of regulatory T cells[J].Cancer Res,2007,67(20):10058-10062.
[10]Kitayama J,Yasuda K,Kawai K,et al.Circulating lymphocyte number has a positive association with tumor response in neoadjuvant chemoradiotherapy for advanced rectal cancer[J].Radiat Oncol,2010,5(1):47-52.
[11]王娴,黄建瑾,李旭芬,等.化疗对晚期胃癌患者细胞免疫功能的影响[J].实用癌症杂志,2001,13(3):313-314.
[12]邱海波,伍小军,周志伟,等.结直肠癌患者外周血T-淋巴细胞亚群和NK细胞数目的变化及其临床意义[J].广东医学,2009,30(3):447-449.
[13]Wood AH,Zhang X,Farber DL,et al.CD8+memory T-lymphocytes from bone marrow-immune function and therapertic potential[J].Crit Rev Immunol,2007,27(6):527-536.
[14]肖秀英,于宝华,杨晓燕,等.FolFox方案化疗对结直肠癌患者免疫细胞数的影响[J].中国癌症杂志,2009,19(10):770-773.
[15]Wei S,Shreimev AB,Take shita W,et al.Tumor-induced immune suppression of invivo effector T-cell primming is mediated by the B7-H1/PD-1axis and transformming growth factor beta[J].Cancer Res,2008,68(33):5432-5437.

