单甘酯对棉籽油和棕榈硬脂酯交换体系结晶性质的影响
王瑛瑶,CHEONG Ling-zhi,栾 霞,段章群,魏翠平,张 帆
(1.国家粮食局科学研究院,北京 100037;2.Aarhus University农业生物技术学科,丹麦 奥胡斯 DK-8000)
单甘酯对棉籽油和棕榈硬脂酯交换体系结晶性质的影响
王瑛瑶1,2,CHEONG Ling-zhi2,栾 霞1,段章群1,魏翠平1,张 帆1
(1.国家粮食局科学研究院,北京 100037;2.Aarhus University农业生物技术学科,丹麦 奥胡斯 DK-8000)
研究不同油酸单甘酯添加量对棉籽油和棕榈硬脂(质量比50:50)酶催化酯交换产物结晶性质的影响。结果表明:添加2%和5%的油酸甘油酯,酯交换产物的固体脂肪含量(SFC)与熔点基本不发生变化,添加量增大到10%,体系的SFC与熔点略有下降;添加不同量的油酸甘油酯,均使酯交换产物结晶温度发生变化,其中低熔点组分对应的峰温度随添加量增加而增大,高熔点组分对应的峰温度随添加量增大而下降;添加2%的油酸单甘酯对酯交换产物的成核速率和结晶速率不存在影响;添加不同量的油酸单甘酯后,酯交换产物中β′晶形比例下降,下降程度与添加量成负相关。
棉籽油;棕榈硬脂;酯交换产物;油酸单甘酯;结晶性质
众多学者开展了酶催化改性制备人造奶油和起酥油基料油的底物配比[1-2]、工艺参数优化[2]探索以及与部分氢化的商品化专用油脂的微观结构(晶核形成、晶形成长和晶形形态)和宏观性质[3](后熟化、流变性质和感官性质)对比研究。人造奶油等配方中,需要添加一定量的乳化剂,以改变或者影响脂肪和油的结晶率,从而提高产品的品质和货架期。除了油脂本身外,人造奶油和起酥油中的其他微量组分(比如单甘酯、甘二酯等乳化剂,以及体系含有的游离脂肪酸、磷脂等)也会对最终产品的结晶性质产生影响。Amir等[4]研究了甘二酯对制作涂抹脂的棕榈仁液油和葵花籽油混合体系熔化和结晶性质的影响。
棉籽油是我国四大油料之一,2010年我国棉籽油产量150万t,精炼棉籽油是制备人造奶油、起酥油等的理想原料。目前,还未见单甘酯组分对棉籽油和棕榈硬脂酯交换体系结晶性质影响的研究。本实验以棉籽油和棕榈硬脂为原料,在其酶催化酯交换后的产物中添加不同比例的油酸单甘酯,研究油酸单甘酯对体系熔点、固体脂肪指数、结晶速率以及晶形结构的影响,以期进一步明确酶催化体系作为氢化油脂替代品时的应用性质。
1 材料与方法
1.1 材料与试剂
棉籽油 美国Wilmar公司;棕榈硬脂 马来西亚森达美公司;油酸单甘酯 丹尼斯克公司;Lipozyme TL RM 诺维信酶制剂公司;3Å分子筛 美国Sigma公司。
1.2 仪器与设备
Mettler FP90 英国梅特勒公司;差示扫描量热仪美国PE公司;Minispec脉冲核磁共振仪、D8 Advance X射线衍射仪分析 德国Bruker公司;spTM 2340气相色谱仪 美国热电公司。
1.3 棉籽油与棕榈硬脂混合物的制备
使用前将棕榈硬脂加热至65℃熔化,并与棉籽油以质量比50:50混合。在上述棉籽油(CO)与棕榈硬脂(PS)混合物中加入底物质量5%的Lipozyme TL RM酶,65℃条件下恒温搅拌24h,转速400r/min,反应中加入一定量的经活化处理的3Å分子筛。反应结束,离心除去酶和分子筛,得到酯交换产物。在酯交换产物中分别添加2%、5%、10%的油酸单甘酯,混匀备用。
1.4 表征方法
1.4.1 脂肪酸组成分析
油脂用BF3-甲醇溶液甲酯化后进气相色谱分析,进样量1μL,样品进入装有自动进样器的气相色谱仪,硅胶毛细管柱(30m×0.25mm,0.2μm),分流比1:50,进样口和检测器温度200℃,炉温以10℃/min的速率从110℃加热到180℃,并保持30min。脂肪酸含量采用归一化法计算。
PS、CO-PS50/50、R50/50、R50/50(2%)、R50/50(5%)和R50/50(10%)分别代表棕榈硬脂、50%的棉籽油与50%的棕榈硬脂混合物、50%的棉籽油与50%的棕榈硬脂混合物的酯交换产物及添加2%油酸单甘酯、添加5%油酸单甘酯、添加10%油酸单甘酯的酯交换产物。
1.4.2 滑动熔点(SMP)[5]
熔点采用Mettler FP90进行测定,样品置于样品杯中,—4℃放置15min后立即放入仪器,并以2℃/min的速率升温,样品从样品杯中熔化滴下的温度即为熔点。
1.4.3 差示扫描量热(DSC)分析[6]
样品的结晶与熔化曲线采用Pyric 8000差示扫描量热仪测定。精确称7~10mg,加热到80℃保持10min,以10℃/min的速率冷却到—60℃保持10min,然后以5℃/min升温到80℃得到熔化曲线。
1.4.4 固体脂肪含量(SFC)
SFC按照AOCS Cd10-57[7]方法测定,样品在65℃放置30min以充分消除原有结晶行为,然后在所需测定温度放置15min后立即用PC/20 Series Minispec脉冲核磁共振仪测定SFC。
1.4.5 X射线衍射
样品65℃熔化后,室温放置1d,用D8 Advance X射线衍射仪分析。室温条件下,采集2θ在5°~30°范围内信号,其中,β’含量以短程3.8、4.2Å处的峰强度计算,β含量以短程4.6Å处的峰强度计算[8]。
1.5 数据处理
测定过程中每个样品重复测定2次,取平均值。
2 结果与分析
2.1 脂肪酸组成分析
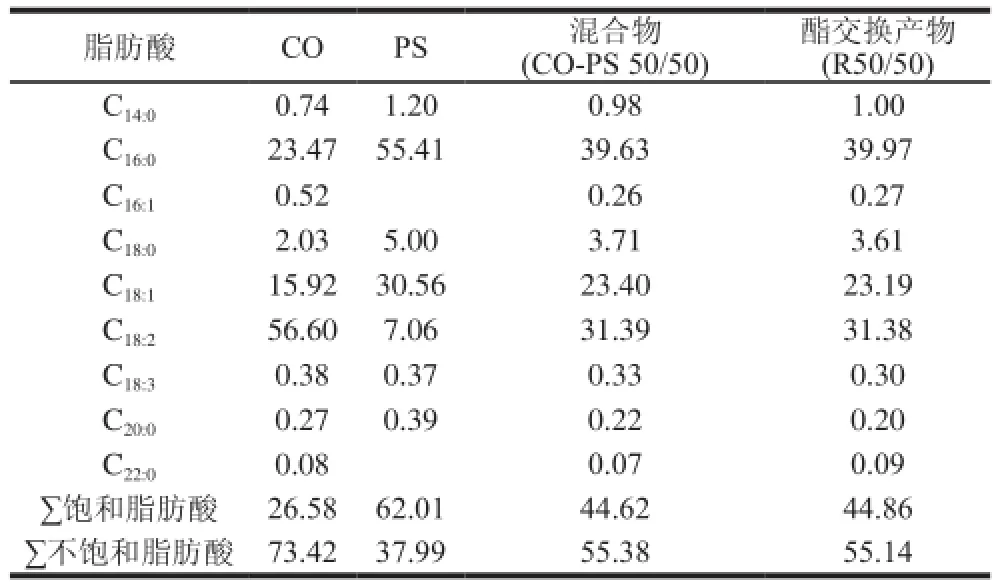
表1 不同物质的脂肪酸组成Table1 Fatty acid composition of raw materials and interesterified products %
表1是棉籽油、棕榈硬脂(PS)、棉籽油(CO)与棕榈硬脂混合物(CO-PS50/50)及其酯交换产物(R50/50)的脂肪酸组成。可以看出,棉籽油脂肪酸以亚油酸、棕榈酸和油酸为主,其中不饱和脂肪酸含量为73.42%;棕榈硬脂以棕榈酸、油酸为主,其中饱和脂肪酸含量为62.01%。酶催化并不会改变混合体系的脂肪酸组成,因此酯交换产物与初始混合物的脂肪酸组成十分接近,是棕榈酸、油酸和亚油酸为主的。
Fredrick等[9]研究表明,单甘酯中脂肪酸与被添加体系中脂肪酸越相似,单甘酯对体系结晶性质影响越明显。为此,选用油酸单甘酯,研究其对棉籽油与棕榈硬脂酯交换产物的结晶性质影响。
2.2 油酸单甘酯对体系固体脂肪含量与熔点的影响
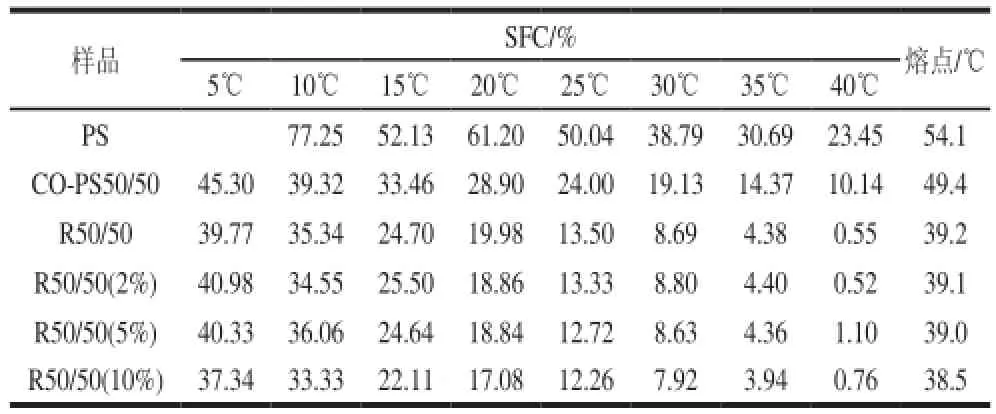
表2 不同体系的固体脂肪含量与熔点Table2 Solid fat contents and melting points of different systems
从表2可知,相同温度下,酯交换产物的SFC低于物理混合物。35℃时的SFC下降到5以下;20℃时,酯交换产物的固体脂肪含量为19.98%。烘焙和糖果用的起酥油不仅需要具备形成稳定乳状液的能力,而且需要良好的搅打起泡性质使之具有乳滑感[10],满足上述特性需要的体系,要求20℃时的固体脂肪含量在15%~20%范围内。因此,所得棉籽油与棕榈硬脂的酯交换产物适合作为烘焙或者糖果加工中的起酥油基料。
酶催化酯交换产物的SFC、熔点比物理混合物低。体系熔点由反应前的49.4℃下降到反应后的39.2℃。酯交换产物中添加2%和5%的油酸单甘酯,对体系SFC与熔点基本无影响,当油酸单甘酯的添加量增大到10%,体系的固体脂肪含量与熔点略有下降。
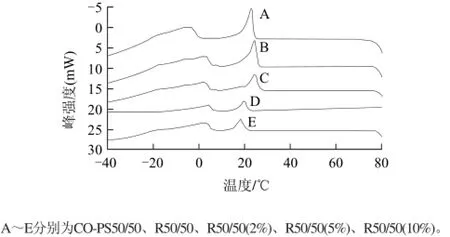
图1 不同样品的结晶曲线Fig.1 Crystallization thermograms of different samples
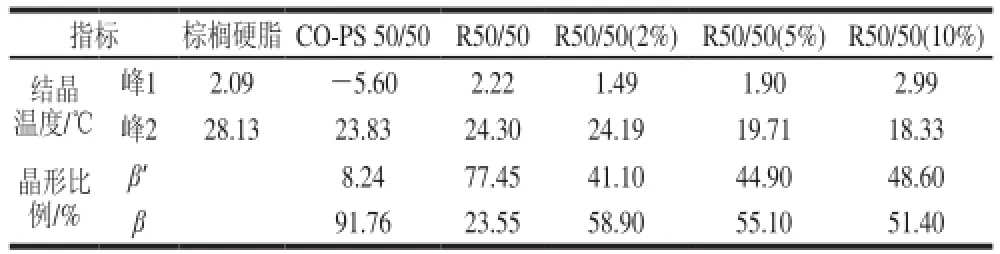
表3 不同样品结晶曲线对应的结晶峰温度Table3 Peak crystallization temperatures of different samples
样品的DSC结晶曲线中不同的放热峰对应于油脂中不同的甘三酯类型,峰温度代表液体中比例最高的组分结晶中时的最大热效应[11]。由图1、表3可知,反应前后以及添加单甘酯的各个样品DSC结晶曲线从低温到高温都有2个放热峰,其中峰1代表多不饱和脂肪酸类型的甘三酯(主要是OOL、LLL和POL)的放热峰,峰2代表含多个饱和脂肪酸类型的甘三酯(主要是POP和PPP)的放热峰。随着油酸单甘酯添加量的增加,酯交换产物中峰2的温度不断降低,这是由于随着油酸甘油酯添加量的增加,酯交换产物中硬脂(即含有多个饱和脂肪酸的甘三酯)的浓度和含量降低导致的,该结果与样品的滑动熔点略微下降的趋势是一致的。
从结晶曲线还可以看出,添加油酸单甘酯后,油脂开始结晶的初始温度下降,这说明单甘酯的添加延缓了体系晶核的形成。
2.3 油酸单甘酯对体系结晶速率的影响
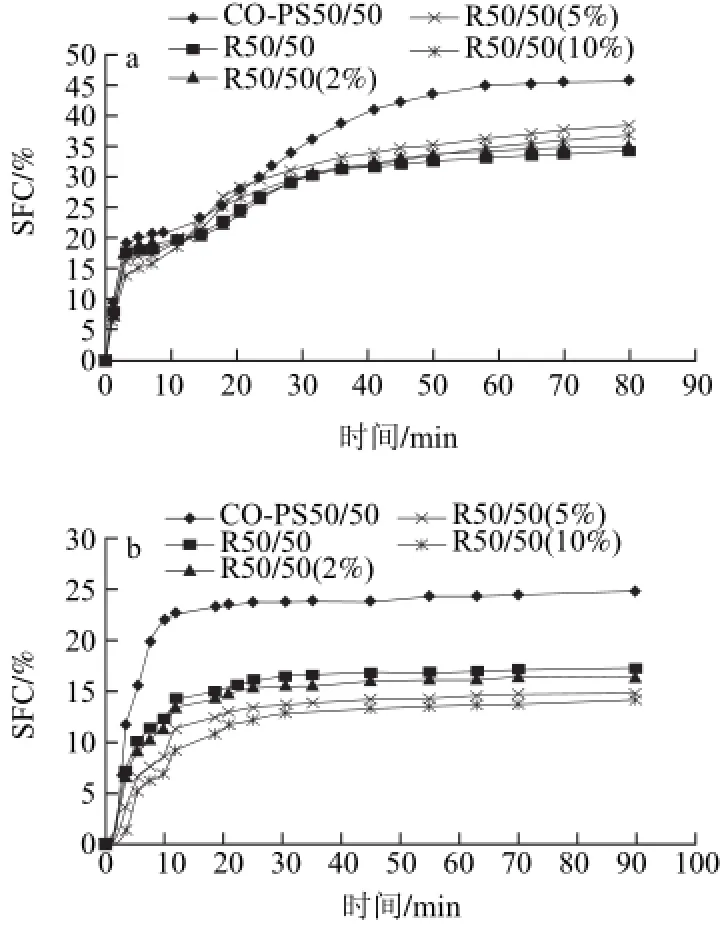
图2 5℃(a)与20℃(b)时酯交换产物结晶等温曲线Fig.2 Crystallization isotherms of different samples at 5℃ and 20℃
由图2可知,酯交换前后样品的静态结晶曲线有很大差异,酯交换后样品SFCmax(平衡时,体系中的最大固体脂肪含量)低于物理混合物,这是因为酯交换后产品中低熔点组分含量增加,因而在同样的冷却温度下,极冷程度减小,有利于形成更为稳定、均一的晶型,这对于油脂实际食品应用而言是非常重要的。添加2%单甘酯的样品,等温结晶曲线与未添加单甘酯的样品没有显著差异;5℃时,添加5%和10%单甘酯样品的SFCmax高于未添加的样品;而在20℃时,添加5%和10%单甘酯样品的SFCmax低于未添加的样品。
20℃时样品晶核期略长于5℃时,但达到最大固体脂肪含量所需时间短。5℃时,不同样品的晶核期基本没有差异;20℃时,物理混合物的晶核期最短,酯交换后样品及添加不同量油酸单甘酯的样品晶核期有不同程度的增加。Foubert等[12]研究发现,单甘酯对乳脂结晶的影响取决于单甘酯中的酰基基团,当酰基为油酸时,单甘酯对乳脂成核速率没有影响,但结晶速率提高;当酰基为硬脂酸时,低温下,成核速率增大,高温时,不影响成核速率。2%的油酸单甘酯对棉籽油与棕榈硬脂酯交换产物的成核速率和结晶速率不存在影响,但在急冷程度较低的条件下(20℃),5%和10%的油酸单甘酯会减缓体系的成核速率和结晶速率。
2.4 单甘酯对脂肪结晶晶形的影响
油脂加工技术中最基本的是脂肪结晶趋势,X射线衍射是研究脂肪结晶最常用的技术之一。脂肪结晶有3种形式,α、β’和β。其中α最不稳定,熔点最低,晶程4.15Å;β最稳定,熔点最高,晶程4.60Å;β’介于两者之间,有3.80、4.20Å两个明显的晶程以及4.27、3.97、3.71Å 3个较为次要的晶程[15]。通常,甘三酯先形成α和β’晶形。晶形转换速率取决于甘三酯同质程度,脂肪中甘三酯类型越少,转化为稳定晶形β的速率越快;甘三酯随机分布的油脂中,更倾向于形成β’晶形[13]。然而,脂肪是由复杂甘三酯组成的混合物,在特定的温度会同时存在不同的晶形和液态油[14]。
图3是酯交换前后及添加不同比例单甘酯样品室温条件下的X射线衍射结果。一般棉籽油是以β’晶形为主,棕榈硬脂以β晶形为主。两者的物理混合物以β晶形为主(91.76%),在4.55Å有一个强的吸收,在4.27Å有一个较小的吸收。Ghotra等[15]研究表明,当体系中棕榈酸含量超过20%以后,更易促使油脂形成β’晶形,这可能是物理混合物中棕榈硬脂中有PPP(棕榈酸甘油三酯)种类的甘油三酯存在的原因。酶催化酯交换以后,在4.20Å和3.80Å出现明显的衍射,体系中油脂转变为以β’晶形为主(77.45%)。β晶形由尺寸大的晶体构成,应用中会提高人造奶油或起酥油的硬度、降低涂抹性能,而β’晶形晶体小,是制作人造奶油和起酥油的理想晶型,因为它们有助于大量的空气以小的空气泡形式被搅入,形成具有良好塑性和奶油化性质的产品[16]。添加不同量的油酸单甘酯后,酯交换后体系中β’晶形比例下降,但下降程度与单甘酯添加量成负相关,即油酸单甘酯添加量大,β’晶形比例下降幅度小。
一般而言,当油脂体系的晶型结构由β’向β转变的时候,体系的滑动熔点会增加2~3℃。本实验添加油酸单甘酯后体系虽然有部分晶型由β’转变β,但添加单甘酯前后体系滑动熔点基本保持不变,这可能是由于由晶型转变导致的熔点增加幅度恰恰与由于油酸单甘酯添加导致的熔点下降幅度基本持平。
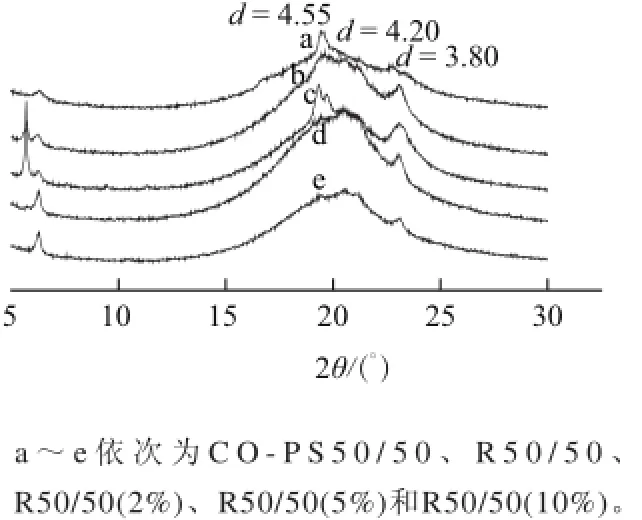
图3 不同样品的X射线衍射图Fig.3 X-ray diffraction patterns of different samples
3 结 论
本实验从体系熔点、固体脂肪含量、结晶速率以及晶型方面,探讨比较了乳化剂单不饱和单甘酯对棉籽油和棕榈硬脂(质量比50:50)酯交换产物结晶行为和性能的影响,结果表明:酯交换产物晶型以β’晶形为主(77.45%),添加2%和5%的油酸甘油酯,对体系SFC与熔点基本无影响,当油酸单甘酯的添加量增大到10%,体系的固体脂肪含量与熔点略有下降;添加油酸单甘酯后,延缓了酯交换产物体系晶核的形成,结晶的初始温度下降;2%油酸单甘酯对酯交换产物的成核速率和结晶速率不存在影响,但在急冷程度较低的条件下,5%和10%的油酸单甘酯会减缓体系的成核速率和结晶速率;添加不同量的油酸单甘酯后,酯交换后体系中β’晶形比例下降,下降程度与单甘酯添加量成负相关。
[1] AHMADI L, WRIGHT A J, MARANGONI A G. Chemical and enzymatic interesterification of tristearin/triolein-rich blends: chemical composition, solid fat content and thermal properties[J]. Eur J Lipid Sci Technol, 2008, 110(2): 1014-1024.
[2] ZHANG H, PEDERSEN L S, KRISTENSEN D, et al. Modification of margarine fats by enzymatic interesterification: evaluation of a solidfat-content-based exponential model with two groups of oil blends[J]. J Am Oil Chem Soc, 2004, 81(6): 653-657.
[3] STEPHEN E L, ASHANTY M, PINA R, et al. Physical and sensory attributes of a trans-free spread formulated with a blend containing a structured lipid palm mid-fraction and cottonseed oil[J]. J Am Oil Chem Soc, 2010, 87(1): 69-74.
[4] AMIR H S, OI-MING L, MISKANDAR M S. Melting and solidification properties of palm-based diacylglycerol, palm kernel olein, and sunflower oil in the preparation of palm-based diacylglycerol-enriched soft tub margarine[J]. Food Bioprocess Technol, 2010, DOI: 10. 1007/s11947-010-0475-5.
[5] COSTALES-RODRI’GUEZ R, VE’RONIQUE G, VERHE R, et al. Chemical and enzymatic interesterification of a blend of palm stearin: soybean oil for low trans-margarine formulation[J]. J Am Oil Chem Soc, 2009, 86(6): 681-697.
[6] LAI O M, GHAZALI H M, CHONG C L. Effect of enzymatic transesterification on the melting points of palm stearin-sunflower oil mixtures[J]. J Am Oil Chem Soc, 1998, 75(9): 881-886.
[7] FIRESTONE D. Official methods and recommended practices of the American Oil Chemists’ Society[M]. 5th ed. Champaign: AOCS Press, 1998: 10-57.
[8] ZEITOUN M, NEFF W E, LIST G R, et al. Physical properties of interesterifies fat blends[J]. Journal of Americal Chemists’Society, 1993, 79(4): 467-471.
[9] FREDRICK E, FOUBERT I, van de JOHN S, et al. Influence of monoglycerides on the crystallization behavior of palm oil[J]. Crystal Growth and Design, 2008, 6(8): 1833-1839.
[10] WASSELL P, YOUNG NWG. Food applications of trans fatty acids substitutes[J]. Journal of Food Science and Technology, 2007, 42(5): 503-517.
[11] TAN C P, CHE MAN Y B. Differential scanning calorimetric analysis of palm, palm oil based products and coconut oil: effects of scanning rate variation[J]. Food Chemistry, 2002, 76(1): 89-102.
[12] FOUBERT I, VANHOUTTE B, DEWETTINCK K. Temperature and concentration dependent effect of partial glycerides on milk fat crystallization[J]. European Journal of Lipid Science and Technology, 2004, 106(8): 531-539.
[13] SATO K. Crystallization behavior of fats and lipids: a review[J]. Chemical Engineering Science, 2001, 56(7): 2255-2265.
[14] CHONG C L, KAMARUDIN Z, LESIEUR P, et al. Thermal and structural behavior of crude palm oil: crystallization at very slow cooling rate[J]. European Journal of Lipid Science and Technology, 2007, 109(4): 410-421.
[15] GHOTRA B S, DYAL S D, NARINE S S. Lipids shortenings: a review[J]. Food Research International, 2002, 35(10): 1015-1048.
[16] ROUSSEAU D, MARANGONI A G. Chemical interesterification of food lipids: theory and practice[M]//AKOH C C, MIN D B. Food lipids: chemistry, nutrition and biotechnology. Boca Raton: CRC Press, 2002: 301-335.
Effect of Monoglyceride on Crystal Properties of Reaction Products of Cottonseed Oil and Palm Stearin Ester
WANG Ying-yao1,2,CHEONG Ling-zhi2,LUAN Xia1,DUAN Zhang-qun1,WEI Cui-ping1,ZHANG Fan1
(1. Academy of State Administraiotn of Grain, Beijing 100037, China;2. Agro-biotechnology Science, Aarhus University, Aarhus DK-8000, Demark)
In this study, the effect of monoglyceride dosage on crystal properties of interesterified products between cottonseed oil and palm stearin ester (50:50, m/m) was investigated. The results showed that monoglyceride at concentrations of 2% and 5% had no effect on solid fat content (SFC) and melting points of the interesterified products, while 10% monoglyceride could result in a decrease in SFC and melting point. Interesterified products with different crystallization temperatures were obtained by varying the monoglyceride dosage. The peak temperature of low-melting-point components was increased with increasing monoglyceride dosage, whereas opposite results were observed for high-melting-point components. Addition of 2% monoglyceride had no effect on the nucleation and crystallization rate of interesterified products. The proportion of crystal polymorphism β′ decreased when adding different amounts of monoglyceride, to a larger extent at higher dosage.
cottonseed oil;palm stearin;interesterified product;monoglyceeride;crystal property
TS221
A
1002-6630(2013)03-0046-04
2012-07-06
中国丹麦政府间科技合作项目(08-039650);国家农业科技成果转化资金项目(SQ2011EC4490011)
王瑛瑶(1978—),女,副研究员,博士,主要从事油脂化学与粮油食品加工技术研究。E-mail:wyy@chinagrain.org

