无溶剂体系下表面活性剂修饰的猪胰脂酶催化酯交换反应的研究
杨 敏,杨国龙,杨力会,毕艳兰,安晓东(河南工业大学粮油食品学院,河南郑州450001)
无溶剂体系下表面活性剂修饰的猪胰脂酶催化酯交换反应的研究
杨 敏,杨国龙*,杨力会,毕艳兰,安晓东
(河南工业大学粮油食品学院,河南郑州450001)
在水溶液中,采用Tween40、蔗糖酯S970、Span60三种表面活性剂修饰猪胰脂酶(porcine pancreas lipase,PPLipase);再以修饰的猪胰脂酶(Tween40-PPLipase、S970-PPLipase、Span60-PPLipase)为催化剂,在无溶剂体系中催化茶油与亚油酸酯交换反应。结果表明,在酶促反应达到平衡前,随着加酶量的增加酯交换量也随之增加;在相同的加酶量下,Tween40-PPLipase、S970-PPLipase和Span60-PPLipase催化酯交换的速率均高于PPLipase催化酯交换的速率;加酶量5%时,2h时PPLipase催化反应的酯交换量为16.1%,Tween40-PPLipase、Span60-PPLipase和S970-PPLipase催化反应的酯交换量分别为20.4%、21.1%和22.4%。达到平衡时,Tween40-PPLipase、Span60-PPLipase、S970-PPLipase和PPLipase催化反应的酯交换量基本相同,均为25%左右。
猪胰脂肪酶,酯交换,无溶剂体系,表面活性剂
酶促反应具有温和、专一、催化效率高的特点,随着酶学研究的进展,脂肪酶及其改性制剂广泛应用于食品营养、药物合成及生物表面活性剂的合成等诸多领域中[1],目前,油脂工业应用最多的酶是脂肪酶。
脂肪酶是一类特殊的作用于油水界面上的酯键水解酶,应用于油脂水解[2],以及有机相中催化酯合成[3]和酯交换反应[4-7]。由于脂肪酶在底物油脂反应中不易分散,需要借助有机溶剂体系来分散,而有机溶剂易导致脂肪酶的变性、失活,为了提高脂肪酶的活性[8-9],很多学者对脂肪酶的修饰[4-7,10-11]进行了研究。孙江彦等[12]以酯交换量为指标,研究了醇溶液体系中蔗糖酯修饰猪胰脂酶的条件,并比较了修饰酶与未修饰酶的热稳定性,结果显示蔗糖酯修饰的猪胰脂酶的热稳定性较猪胰脂酶高。曾俊等[13]研究了乙醇溶液中Span20、Span80和Span85修饰的猪胰脂酶催化茶油与亚油酸酯交换反应,结果表明修饰猪胰脂酶催化酯交换的行为与表面活性剂的类型和反应温度有关。
本研究以水溶液中司盘60、吐温40、蔗糖酯970修饰的猪胰脂肪酶为催化剂,催化无溶剂体系中茶油与亚油酸的酯交换反应,比较修饰酶与原酶催化酯交换行为的差异,考察水溶液中表面活性剂修饰脂肪酶的效果。
1 材料与方法
1.1 材料与仪器
猪胰脂酶(PPLipase) 自制;亚油酸 自制(含量>95%);茶油 购于河南信阳长园野生茶油有限公司;Span60(山梨醇酐单硬脂酸酯,亲水亲油平衡值(HLB)=4.7)和Tween40(聚氧乙烯失水山梨醇脂肪酸酯,HLB=15.5) 购于Sigma公司;S970(硬脂酸蔗糖酯,HLB=9.0) 购于日本三菱公司;其他化学试剂 购于天津市科密欧化学试剂有限公司,色谱纯。
气相色谱仪(Agilent6890N) 美国Agilent公司;色谱柱BPX-70(30.0m×250μm×0.25μm) 澳大利亚SGE公司;KDN-08C定氮仪 上海洪纪仪器设备有限公司;ZF-I型紫外分析仪 上海康华生化仪器制造有限公司。
1.2 实验方法
1.2.1 表面活性剂修饰猪胰脂酶的方法 称取一定量的表面活性剂Span60、Tween40、S970溶解于相应的pH缓冲溶液中,再缓慢加入一定量的猪胰脂肪酶,在25℃下搅拌均匀后,继续缓慢搅拌并计时,达到指定时间后停止搅拌,然后在3500r/min下离心15min弃去上清液,取沉淀,冷冻干燥(冷肼温度-56℃)24h后取出,用研钵研磨成粉状,即得修饰后猪胰脂肪酶Span60-PPLipase、Tween40-PPLipase、S970-PPLipase。工艺流程如图1所示,修饰条件见表1。

图1 表面活性剂修饰猪胰脂肪酶的工艺过程Fig.1 Modification process of PPLipase by surfactants

表1 表面活性剂修饰猪胰脂肪酶的条件Table 1 Modification conditions of PPLipase by surfactants
1.2.2 酶的蛋白质含量测定 PPLipase和修饰PPLipase的蛋白质含量按GB 5009.5-2010测定。
1.2.3 表面活性剂的修饰作用对PPLipase催化酯交换反应的影响 称取10g茶油于50mL圆底烧瓶中,加入一定量的亚油酸,茶油∶亚油酸=1∶2(mol/mol),再加入一定量的蒸馏水(按茶油质量的0.4%计),在50℃温度下搅拌均匀后,缓慢加入PPLipase或修饰的PPLipase(以含氮量为基准,添加量为茶油质量的5%),开始计时,每隔一定时间取样,分离产物中的甘三酯,并采用气相色谱法分析产物中甘三酯的全样脂肪酸组成,计算酯交换过程中酯交换量,考察表面活性剂的修饰作用对PPLipase催化酯交换反应的影响。酯交换量计算公式如下:
酯交换量(%)=L0-Lp
式中:L0:原料茶油中亚油酸的质量百分含量;Lp:产物甘三酯中亚油酸的质量百分含量。
1.2.4 加酶量对酶催化酯交换反应的影响 称取10g茶油于50mL圆底烧瓶中,加入一定量的亚油酸,茶油∶亚油酸=1∶2(mol/mol),再加入一定量的蒸馏水(按茶油质量的0.4%计),在50℃温度下搅拌均匀后,缓慢加入PPLipase或修饰的PPLipase(以含氮量为基准,添加量为茶油质量的5%、10%、15%、20%),开始计时,每隔一定时间取样,分离产物中的甘三酯,并采用气相色谱法分析产物中甘三酯的全样脂肪酸组成,计算酯交换过程中酯交换量,考察加酶量对催化酯交换反应的影响。酯交换量计算见1.2.3。
1.2.5 产物中甘三酯的分离与全样脂肪酸组成分析 取0.4mL反应产物置于离心管中,加入0.8mL石油醚溶解,混匀后,将混合样品进行薄层色谱分离,使用硅胶G为吸附剂,石油醚∶无水乙醚∶甲酸=70∶30∶1(v/v/v)展开剂展开后,在通风橱内晾干,将2,7-二氯荧光素均匀喷洒在薄层板上显色,晾干后在紫外分析仪上观察谱带。
刮下待分析的甘三酯谱带于试管中,加入4mL 0.5mol/L的甲醇钠溶液和2.4mL的正己烷后,封口,剧烈晃动7min,以3000r/min的转速离心1min,吸取上清液于另一洁净试管中,加入无水硫酸钠去除痕量水分,待气相色谱检测。
气相色谱分析条件:毛细管脂肪酸分析色谱柱,BPX-70(30.0m×250μm×0.25μm);检测器,氢火焰离子检测器;进样口温度,230℃;柱温,180℃;检测器温度,300℃;氮气流速:1.5mL/min。
1.3 数据分析与处理
所有数据均为双实验结果的平均值。采用SPSS 2.0对数据进行方差分析。

表2 修饰后猪胰脂肪酶与原酶的蛋白质含量(n=2)Table 2 Protein content of PPLipase and modified PPLipases(n=2)
2 结果与讨论
2.1 未修饰酶及修饰后的PPLipase中蛋白质含量
如表2所示,3种表面活性剂修饰的PPLipase的蛋白质含量在70%~80.5%之间,均低于(p<0.05)原PPLipase的蛋白质含量(86.96%),且不同表面活性剂修饰的PPLipase的蛋白质也存在一定差异,这是因为脂肪酶修饰的过程中酶蛋白质与表面活性剂间作用力的差异,导致相同质量的脂肪酶结合表面活性剂的量有所不同,且修饰后酶的蛋白质含量降低。
2.2 修饰作用对猪胰脂酶催化酯交换反应的影响
表面活性剂修饰的PPLipase催化酯交换反应的酯交换量随时间的变化如图2所示。由图2可知,修饰后的猪胰脂酶催化酯交换达到平衡的时间较PPLipase催化反应达平衡的时间短,PPLipase催化反应达平衡的时间是6h,而三种修饰后的PPLipase催化的酯交换达平衡的时间是4h。在反应达平衡前,相同时间内,修饰后的PPLipase催化反应的酯交换量远大于PPLipase催化反应的酯交换量(p<0.01),2h时PPLipase催化反应的酯交换量为16.1%,Tween40-PPLipase、Span60-PPLipase和S970-PPLipase催化反应的酯交换量分别为20.4%、21.1%、22.4%;三种修饰猪胰脂酶催化反应的酯交换量没有显著差别(p>0.05)。酯交换反应达平衡后(4h后),随反应时间的延长,修饰PPLipase催化酯交换反应的酯交换量没有显著差别(p>0.05)。这说明,采用非离子表面活性剂在水溶液中对PPLipase进行修饰,能显著提高其催化酯交换的活性;但Tween40、Span60和S970对PPLipase的修饰效果无显著差别。曾俊等[13]研究发现,乙醇溶液中用Span修饰PPLipase也能提高其催化酯交换反应的活性。
微观上看,酶催化酯交换反应是界面催化,酶分子自身的性质会影响反应的传质。表面活性的极性部分与脂肪酶(本质是蛋白质)表面的亲水性基团产生亲水相互作用。而作为一种蛋白质,脂肪酶表面肯定会存在一定数量的疏水性基团,且酶的活性部位是由疏水性氨基酸组成的,该区域表现为疏水性,表面活性的疏水部分与脂肪酶表面的疏水性基团通过疏水相互作用进行结合。表面活性剂与脂肪酶间可通过亲水相互作用和疏水相互作用形成表面活性剂-脂肪酶复合物,酶表面性质得到改善从而使得酶的催化活性增加。

图2 PPLipase和修饰的PPLipase催化酯交换过程中酯交换量随时间的变化Fig.2 Changes of acyl incorporation with reaction time increasing during interesterification catalyzed by PPLipase and modified PPLipases
2.3 加酶量对猪胰脂酶催化酯交换反应的影响
由图3~图6可知,就PPLipase、Tween40-PPLipase、Span60-PPLipase和S970-PPLipase催化酯交换反应而言,相同时间的酯交换量随着加酶量的增大而逐渐提高,即酯交换速率随加酶量的增加而增加,反应达平衡的时间随之变小。加酶量由5%增加到10%时,四种酶催化酯交换的速率均显著提高(p<0.01);由10%增加到15%变化时,四种酶催化酯交换的速率有所提高(p<0.05);由15%增加到20%时,PPLipase的酯交换速率略有提高(p<0.05),Tween40-PPLipase、Span60-PPLipase和S970-PPLipase三种修饰酶的酯交换速率几乎没有变化(p>0.05)。原因是当增大加酶量时,扩大了催化剂与反应底物之间的接触面积,从而提高了酯交换的反应速率。随着加酶量的进一步增大,底物逐渐被酶所饱和,仅有一部分酶参加了酯交换反应,饱和的修饰酶参与反应的催化活性高于原酶,即加酶量由15%增加到20%时,修饰酶与原酶的酯交换速率变化有所不同。杨国龙等[14]研究了无溶剂体系下PPLipase催化油茶籽油与亚油酸甲酯酯交换反应酯交换量的变化,加酶量由5%增加到15%时,20h时的酯交换量随着加酶量的增加逐渐上升,加酶量大于15%后变化不大。
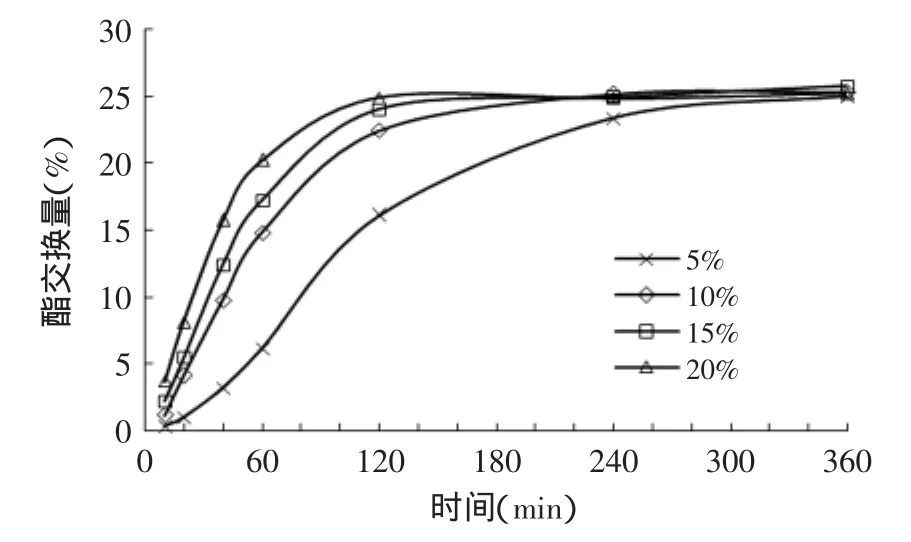
图3 加酶量对PPLipase催化酯交换反应的影响Fig.3 Effect of enzyme load on interesterification catalyzed by PPLipase

图4 加酶量对Tween40-PPLipase催化酯交换反应的影响Fig.4 Effect of enzyme load on interesterification catalyzed by Tween40-PPLipase
对于PPLipase催化的酯交换反应而言,加酶量5%时,达平衡需要6h;10%时达平衡需要4h;加酶量15%和20%时,达平衡需要2~3h。对于Tween40-PPLipase、Span60-PPLipase和S970-PPLipase催化酯交换反应来说,加酶量5%时,达平衡需要4h;10%时达平衡需要2~3h;加酶量15%和20%时,达平衡需要1.5~2h。反应达平衡时,四种酶的催化酯交换反应的酯交换量均为25%左右。这是由于所有反应的底物及反应条件均相同,此反应的平衡常数与加酶量无关,加酶量只能影响酯交换的反应速率,即平衡时的酯交换量基本相同。

图5 加酶量对Span60-PPLipase催化酯交换反应的影响Fig.5 Effect of enzyme load on interesterification catalyzed by Span60-PPLipase
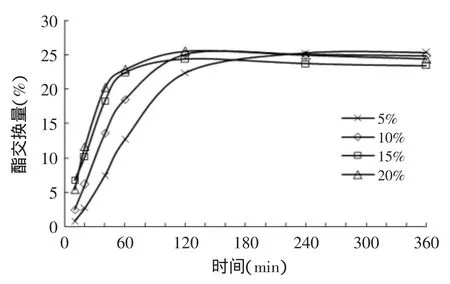
图6 加酶量对S970-PPLipase催化酯交换反应的影响Fig.6 Effect of enzyme load on interesterification catalyzed by S970-PPLipase
3 结论
非离子表面活性剂Span60、Tween40、S970在水溶液中修饰猪胰脂酶能达到其在醇溶液中的修饰效果,即能提高猪胰脂酶催化酯交换反应的催化活性,虽然不同表面活性剂的修饰效果有所不同,但差别不明显。
[1]郭诤,张根旺.脂肪酶的结构特征和化学修饰[J].中国油脂,2003,28(7):5-10.
[2]Luddy FE,Barford RA,Herb SF,et al.Pancreatic lipase hydrolysis of triglycerides by a semimicro technique[J].J Am Oil Chem Soc,1964,41(10):693-696.
[3]曾哲灵,高道龙,龙俊敏,等.胰脂肪酶催化樟树籽仁油和甘油合成中碳链单甘油酯[J].中国油脂,2012,37(1):23-28.
[4]Mogi KI,Nakajima M,Mukataka S.Surfactant modification of lipases for lipid interesterification and hydrolysis reactions[J].J Am Oil Chem Soc,1999,76(11):1259-1264.
[5]Goto M,Kamiya N,Miyata M,et al.Enzymatic esterification by surfactant-coated lipase in organic media[J].Biotechnol Prog,1994,10(3):263-268.
[6]Matsushima A,Kodera Y,Takahashi K,et al.Ester-exchange reaction between triglycerides with polyethylene glycol-modified Lipase[J].Biological Chem,1986,8(2):73-78.
[7]Basheer S,Nakajima M,Cogan U.Sugar ester-modified Lipase for the esterification of fatty acids and long-chain alcohols [J].J Am Oil Chem Soc,1996,73(11):1475-1479.
[8]Kaimal TNB,Saroja M.Enhancement of catalytic activity of porcine pancreatic Lipase by reductive alkylation[J].Biotechnol,1989,11(1):31-36.
[9]张中义,吴新侠,孟令艳,等.超高压下猪胰脂肪酶催化橄榄油水解特性的研究[J].食品科技,2009,34(1):10-13.
[10]张洁,杨国龙,毕艳兰,等.乙醇溶液中Tweens对猪胰脂酶的修饰作用[J].食品与发酵工业,2012,38(4):44-47.
[11]Kamiya N,Goto M,Nakashio F.Surfactant-coated Lipase suitable for the enzymatic resolution of menthol as a biocatalyst in organic media[J].Biotechnol,1995,11(3):270-275.
[12]孙江彦,杨国龙,毕艳兰,等.醇溶液体系中蔗糖酯修饰猪胰脂酶的研究[J].河南工业大学学报,2013,34(2):4-7.
[13]曾俊,杨国龙,毕艳兰,等.无溶剂体系中Span修饰的猪胰脂酶催化茶油与亚油酸酯交换[J].河南工业大学学报,2011,32(1):10-13.
[14]杨国龙,王梦华,王业涛,等.影响猪胰脂肪酶催化油茶籽油与亚油酸甲酯酯交换过程中酯交换量和酰基位移因素的研究[J].中国油脂,2010,35(10):38-41.
Study on the interesterification catalyzed by surfactants modified porcine pancreas lipase in solvent free system
YANG Min,YANG Guo-long*,YANG Li-hui,BI Yan-lan,AN Xiao-dong
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
The porcine pancreas lipase(PPLipase)was modified by Tween40,Sucrose ester S970 and Span60 in aqueous solution,and then the Tween40-PPLipase,S970-PPLipase and Span60-PPLipase were used to catalyze the interesterification of camellia and linoleic acid in solvent free system.The results indicated that the acyl incorporation(Ia)was increased with the enzyme loading increasing before the reaction balance reached. The interesterification volecities of the reactions catalyzed by Tween40-PPLipase,Span60-PPLipase and S970-PPLipase were higher than that catalyzed by PPLipase when the enzyme loadings were same.At enzyme load 5%level,the Ia of the interesterifiecation catalyzed by PPLipase was 16.1%at 2h,however the Ias of the interesterification catalyzed by Tween40-PPLipase,Span60-PPLipase and S970-PPLipase were 20.4%,21.1%and 22.4%,respectively.When the reaction balance reached,the Ias of the interesterifications catalyzed by Tween40-PPLipase,S970-PPLipase,Span60-PPLipase and PPLipase were same roughly,about 25%.
porcine pancreas lipase;interesterification;solvent free system;surfactant
TS229
A
1002-0306(2014)12-0176-04
10.13386/j.issn1002-0306.2014.12.029
2013-09-02 *通讯联系人
杨敏(1987-),女,硕士研究生,研究方向:脂质化学。
国家自然科学基金项目(31071558)。

