反胶束萃取阿魏酸酯酶
王镇发,陈培钦,邓秩韬,谢晨,李夏兰
(华侨大学 化工学院,福建 厦门361021)
阿魏酸酯酶(EC 3.1.1.73)是羧酸酯水解酶的一个亚类,属胞外酶,其主要生物功能是水解多糖与阿魏酸连结的酯键[1].1987年,Mackenzie等[2]首次在橄榄色链霉菌中发现了阿魏酸酯酶;1991年,Faulds等[3]成功分离纯化了阿魏酸酯酶.到目前,已从真菌和细菌中得到超过40种阿魏酸酯酶[4-6],各种微生物分泌的阿魏酸酯酶在氨基酸序列、肽链的结构、物化性质和催化特性上有所不同[4-7].阿魏酸酯酶的分离纯化是其应用的基础,所以阿魏酸酯酶的分离纯化一直都是研究的一个重点.相比于层析法,反胶束萃取蛋白质具有成本低、回收率高、操作时间短和处理量大等优点.本实验室已从腐烂的木质纤维中筛选到1株产阿魏酸酯酶的菌株,并对其进行了鉴定[8].本文研究反胶束萃取法分离纯化该菌种发酵所产的阿魏酸酯酶,为阿魏酸酯酶的应用提供前期的基础.
1 实验材料和方法
1.1 主要试剂和仪器
反式阿魏酸标准品,美国Sigma公司;阿魏酸甲酯,华侨大学化工学院曾庆友老师合成;十六烷基三甲基溴化铵(CTAB),分析纯,北京佰利申科贸有限公司;异辛烷,正己醇,甲醇,氯化钾等均为市售,分析纯.
DYY-8C型电泳仪,北京市六一仪器厂;Agilent 1100型高效液相色谱仪,美国Agilent公司;Thermo EC120小型垂直电泳系统,美国Thermo公司;ODS-C18型色谱柱(5μm,4.6 mm×250 mm),美国Thermo公司;MW3500型透析袋,上海绿鸟科技发展有限公司;XW-80A型漩涡混合仪,上海精科实业有限公司.
1.2 实验方法
1.2.1 发酵液的制备 菌种及发酵液的制备,参见文献[9].
1.2.2 阿魏酸及阿魏酸酯酶酶活的测定 阿魏酸的测定采用HPLC法[8].阿魏酸酯酶活测定方法参见文献[9].
1.2.3 蛋白质浓度测定 蛋白质浓度的测定采用考马斯亮蓝法[10].
1.2.4 反胶束萃取阿魏酸酯酶 1)萃取.用1 mol·L-1HCl溶液、1 mol·L-1NaOH溶液调节酶液p H值,用KCl调节酶液的离子强度.称取一定质量的CTAB加入小试管中,再加入2 m L体积比为1:5的正己醇/异辛烷溶液,振荡片刻,加入等体积的酶液,漩涡振荡2 min,室温静置;待分层后测定下层水相的酶活力和蛋白浓度,计算萃取率(E)和纯化倍数(D).2)反萃取.在另一只小试管中加入1.5 m L萃取相,再加入等体积一定p H值和浓度的KCl溶液,漩涡振荡2 min,室温静置;待油水分层后测定下层水相中的酶活力和蛋白浓度,计算总萃取率(Et)和纯化倍数.
1.2.5 电泳 将经反胶束萃取和反萃取的的酶液进行SDS-PAGE电泳.
2 结果与讨论
2.1 p H值对萃取率的影响
在KCl浓度为0.01 mol·L-1时萃取阿魏酸酯酶,结果如图1所示.从图1可知:萃取液p H值为12时,萃取率最高,达到94.5%.p H值主要决定蛋白质所带的静电荷,进而改变蛋白质表面电荷和反胶束内表面电荷间的静电作用[11].CTAB是阳离子表面活性剂,极性头带正电.因此,只有在水相p H值大于蛋白质等电点时,蛋白质带负电荷,才能被包裹进反胶束中.该菌分泌的阿魏酸酯酶的pI值还未测定,但据报道,不同菌株来源的阿魏酸酯酶的pI值在3~10之间[12].所以p H值越大,水相p H值和蛋白质等电点的差值越大,静电作用就越强,萃取率就越高.
2.2 KCl浓度对萃取率的影响
在p H值为12时萃取阿魏酸酯酶,结果如图2所示.从图2可知:随着离子浓度的增高,萃取率迅速降低,KCl浓度为0.5 mol·L-1时,萃取率只有15%.这可用双电子层理论[11]解释,即离子强度的增加减弱了表面活性剂极性头之间的斥力,反胶束体积变小,蛋白质甚至无法进入反胶束.
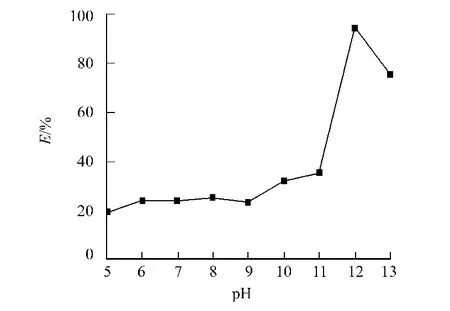
图1 p H值对萃取率的影响Fig.1 Effect of p H value on extraction efficiency
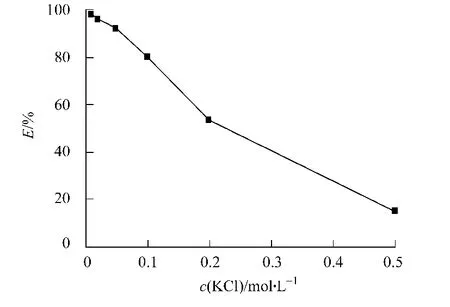
图2 KCl浓度对萃取率的影响Fig.2 Effect of concentration of KCl on extraction efficiency
2.3 CTAB浓度对萃取率的影响
在p H值为12,KCl浓度为0时萃取阿魏酸酯酶,结果如图3所示.从图3可知:当CTAB浓度小于25 mmol·L-1时,萃取率随着CTAB浓度的增加而提高.这是因为表面活性剂浓度的增加使反胶束的数量增加,萃取率提高.当CTAB浓度达到25 mmol·L-1时,水相中的阿魏酸酯酶全部进入反胶束中,萃取率接近100%.
2.4 反萃取时水相p H值对反萃取的影响

图3 CTAB浓度对萃取率的影响Fig.3 Effect of concentration of CTAB on extraction efficiency
优化条件下(p H值为12,CTAB浓度为25 mmol·L-1,KCl浓度为0)对阿魏酸酯酶进行萃取后,在0和0.15 mol·L-1的KCl溶液中进行反萃取阿魏酸酯酶,结果如图4所示.从图4可知:当KCl浓度为0.15 mol·L-1,p H值为5~10时,其反萃取率为70%左右;而当p H>8时,反萃取率下降.若KCl浓度为0时,改变水相的p H值,即使当水相p H值低于阿魏酸酯酶的pI值时,阿魏酸酯酶带正电荷与CTAB的极性头所带的正电荷排斥,也无法实现阿魏酸酯酶从反胶束中的反萃取.这说明在萃取中起作用的不只是静电作用,还有其他的因素,如疏水相互作用[11]、立体相互作用和特异性相互作用[12].
2.5 反萃取时水相的KCl浓度对反萃取的影响
用p H值为7的不同浓度KCl溶液进行反萃取阿魏酸酯酶,结果如图5所示.从图5可知:随着KCl浓度的升高,反萃取率逐渐增大,当KCl浓度为0.20 mol·L-1时,反萃取率最高为79%.当离子强度增大时,反胶束表面双电层变薄[13],阿魏酸酯酶与反胶束表面之间的静电吸引减弱,酶在反胶束中的溶解度降低,从而使反萃取率提高.但进一步提高KCl浓度,反萃取率开始下降,当KCl浓度为0.25 mol·L-1时,萃取率仅为56%.这可能是较高的KCl浓度会导致酶的盐析,从而使反萃取率降低.
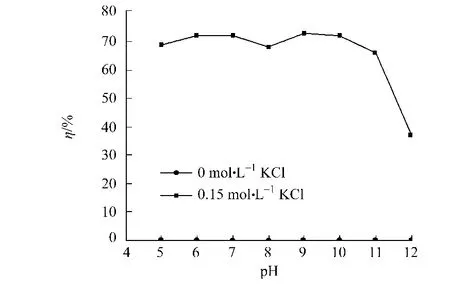
图4 反萃取水相的p H值对总萃取率的影响Fig.4 Effect of p H in backward aqueous phase on the total extraction efficiency
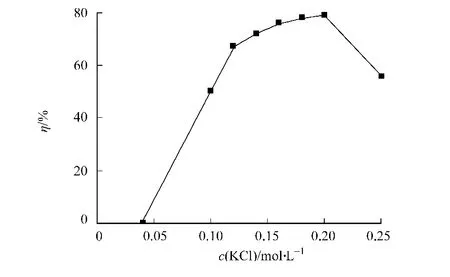
图5 反萃取水相KCl浓度对总萃取率的影响Fig.5 Effect of concentration of KCl in backward aqueous phase on the total extraction efficiency
透析后粗酶液在p H值为12,CTAB浓度为25 mmol·m L-1,KCl浓度为0下萃取,在0.2 mol·L-1KCl下反萃取,酶活力(z)和蛋白浓度(c(蛋白质))的变化如表1所示.通过萃取和反萃取,阿魏酸酯酶回收率(Et)为79.0%,比活(Δz)从51.7μkat·g-1提高到356.7μkat·g-1,纯化倍数(D)为6.9.

表1 阿魏酸酯酶纯化的各参数Tab.1 Summary of the purification of feruloyl esterases
2.6 反胶束纯化结果电泳
图6为不同透析时间的阿魏酸酯酶液反胶束萃取纯化后的SDS-PAGE电泳图.其中:1为Marker;2为发酵液;3为经反胶束萃取及反萃取的纯化结果.从图6中可知:在条带35 ku左右有一条带,与本实验室报导的相近[9],为阿魏酸酯酶的条带.同时还可以看出:CTAB反胶束纯化阿魏酸酯酶有较好的效果,尤其是对除去分子量大于阿魏酸酯酶的蛋白质.
3 结论
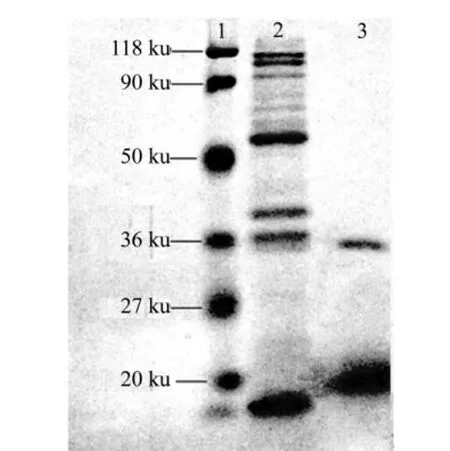
图6 阿魏酸酯酶液反胶束萃取后的电泳图Fig.6 Electrophoresis of feruloyl esterase after reverse micelles extraction
研究结果表明:萃取时,透析后的粗酶液的p H值为12时,与等体积的25 mmol·L-1CTAB反胶束溶液混合,阿魏酸酯酶萃取率最高,接近100%;反萃取时,将反胶束与等体积p H值为7的0.20 mol·L-1KCl溶液混合,漩涡振荡3 min,阿魏酸酯酶总得率最高为79%,比活从粗酶液的51.7μkat·g-1提高到356.7μkat·g-1,纯化倍数为6.9.阿魏酸酯酶酶液经反胶束萃取后,SDS-PAGE电泳只显示两条带,说明CTAB/正己醇/异辛烷反胶束体系能有效地分离纯化阿魏酸酯酶.此方法与层析法相比,具有提取时间短、成本低、易于放大等优点.
[1] CREPIN V,FAULDS C,CONNERTON I.Functional classification of the microbial feruloyl esterases[J].Applied Microbiology and Biotechnology,2004,63(6):647-652.
[2] MACKENZIE C R,BILOUS D,SCHNEIDER H,et al.Induction of cellulolytic and xylanolytic enzyme systems inStreptomycesspp.[J].Applied and Environmenta Microbiology,1987,53(12):2835-2839.
[3] FAULDS C B,WILLIAMSON G.The purification and characterization of 4-hydroxy-3-methoxycinnamic(ferulic)acid esterase fromStreptomycesolivochromogenes[J].Microbiology,1991,137(10):2339-2345.
[4] TOPAKAS E,VAFIADI C,CHRISTAKOPOULOS P.Microbial production,characterization and applications of feruloyl esterases[J].Process Biochemistry,2007,42(4):497-509.
[5] BENOIT I,DANCHIN E G J,BLEICHRODT R J,et al.Biotechnological applications and potential of fungal feruloyl esterases based on prevalence,classification and biochemical diversity[J].Biotechnology Letters,2008,30(3):387-396.
[6] KOSEKI T,FUSHINOBU S,SHIRAKAWA H,et al.Occurrence,properties,and applications of feruloyl esterases[J].Applied Microbiology and Biotechnology,2009,84(5):803-810.
[7] FAZARY A E,JU Y H.Feruloyl esterases as biotechnological tools:Current and future perspectives[J].Acta Biochimica et Biophysica Sinica,2007,39(11):811-828.
[8] 李夏兰,胡雪松,范韵敏,等.一株产阿魏酸酯酶青霉菌株的筛选、鉴定及生长特征[J].微生物学通报,2010,37(11):1588-1593.
[9] 李夏兰,范韵敏,方柏山.来自桔青霉的阿魏酸酯酶的分离纯化、理化性质[J].微生物学报,2010,50(8):1058-1064.
[10] 汪家正,范明.蛋白质技术手册[M].北京:科学出版社,2000:42-47.
[11] 王金枝,曹学君.反胶束萃取技术分离胰激肽原酶[J].中国生物工程杂志,2007,27(3):93-99.
[12] KOSEKI T,FUSHINOBU S,SHIRAKAWA H,et al.Occurrence,properties and applications of feruloyl esterases[J].Applied Microbiology and Biotechnology,2009,84(5):803-810.
[13] 李凯,李成付,李加友,等.反胶束萃取精氨酸脱亚胺酶[J].精细化工,2008,25(2):163-166.

