慢性眼内压增高对大鼠视网膜Müller细胞钙通道电流的影响△
杨薇 吴杭婧 王中峰
·基础研究·
慢性眼内压增高对大鼠视网膜Müller细胞钙通道电流的影响△
杨薇 吴杭婧 王中峰
目的利用电生理方法,鉴定大鼠视网膜Müller细胞钙通道,进而研究慢性眼内压增高对Müller细胞钙通道电流的影响。方法在急性分离的大鼠Müller细胞上,利用全细胞膜片钳的电压钳技术记录钙通道电流。采用结扎巩膜上静脉的方法制备大鼠高眼压模型。结果当细胞外液中不含二价阳离子时,可以记录到电流幅度较大的钙通道介导的Na+电流。该电流可被L-型钙通道阻断剂nimodipine和T-型钙通道阻断剂mibefradil可逆地压抑到加药前的(39.8±5.4)%(P<0.001)和(46.7±8.7)%(P<0.001)。与假手术组相比,高眼压术后1周、2周和4周的大鼠视网膜Müller细胞钙通道的电流幅度没有明显的变化。然而,电流成分分析发现,与对照组相比,高眼压大鼠Müller细胞的nimodipine敏感电流呈降低的趋势[1周:(70.9± 13.3)%;2周:(70.5±21.9)%;4周:(69.2±23.9)%],而mibefradil敏感的电流在高眼压术后1周和2周呈增高趋势[(157.5±21.2)%和(158.6±35.5)%],4周时趋于正常(109.2±37.9)%。结论大鼠视网膜Müller细胞功能性表达L-型和T-型钙通道。慢性眼内压增高导致L-型钙通道电流减小,T-型钙通道电流增大,从而增加胞内钙,共同参与Müller细胞的去极化和激活。(中国眼耳鼻喉科杂志,2013,13:352-356)
Müller细胞;钙通道;慢性高眼压;大鼠;视网膜
青光眼是第二大致盲性眼病,是不可逆性致盲的最主要原因[1],以视神经乳头病变、神经节细胞数目减少和视野缺失为特征,眼内压增高是其主要的致病因素之一[2]。随着人均寿命的延长,老年相关性眼病的发病率日益增加。在我国部分地区,50岁以上中老年人群中,原发性青光眼的患病率高达2.07%~ 3.8%[3]。鉴于其与其他慢性神经退行性疾病相似,青光眼视网膜神经节细胞损伤的确切机制还不明。近年来,胶质细胞的激活在神经系统损伤过程中的作用日益受到人们的重视[4-5]。Müller细胞是脊椎动物视网膜中一类主要的胶质细胞[5],该细胞不仅对神经元起着支持和营养作用,而且也释放多种神经活性物质和因子,从而调控视网膜功能和参与视网膜疾病的病理过程。已有的文献[6-7]表明,在视网膜脱离、缺血,青光眼,糖尿病视网膜病变等病理过程中,都伴随着Müller细胞的激活。激活的Müller细胞,其特征性表现是胶质原纤维酸性蛋白(GFAP)的表达上调和ERK1/2的激活。我们最近的研究发现,高眼压引起的经由代谢性谷氨酸受体激活介导的内向整流钾通道(Kir)表达下调是Müller细胞激活的机制之一[7]。Kir电流的下调,导致的Müller细胞去极化,还可能激活其他电压门控离子通道等。
电压门控钙通道在细胞行使功能中有重要作用。形态学和电生理研究发现,多种动物的视网膜Müller细胞功能性表达有钙通道。如在蝾螈的Müller细胞上表达有L-型和N-型钙通道[8-9];在蟾蜍的Müller细胞上存在T-型钙通道[10];在培养的人Müller细胞上,存在L-型和T-型钙通道[11-12]。Müller细胞钙通道电流可以调节胞外K+水平,胞内Ca2+浓度的升高还可以影响神经元的突触传递效率并诱发内向电流的产生[8,13]。而在病理状态下,如增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)患者中,钙通道发生下调[14]。在大鼠视网膜Müller细胞,尽管用免疫组织化学技术发现有钙通道表达[15],但还没有电生理方面的报道验证其钙通道的类型。而且,在青光眼病理过程中,Müller细胞的钙通道是否发生了变化也没有报道。因此,本研究拟利用膜片钳电生理技术研究大鼠视网膜Müller细胞的钙通道类型,并在慢性高眼压大鼠模型,观察钙通道电流的改变。
1 材料与方法
1.1 急性分离大鼠视网膜Müller细胞 雄性Sprague-Dawley大鼠(体质量100~150 g),购自上海斯莱克实验动物中心,清洁级。本实验所有动物实验均遵守美国眼科与视觉研究协会(ARVO)和复旦大学实验动物饲养管理及动物使用规定。实验中尽量减轻动物疼痛和不适,饲养时温度维持在21℃,12 h光照/黑暗循环照明,给予充足的水、饲料和活动空间。将34只大鼠分为2组:正常Müller细胞钙通道鉴定组(10只);高眼压组(共24只,其中假手术和高眼压不同时间点各6只)。
采用木瓜蛋白酶酶解和机械分离相结合的方法制备单个的视网膜Müller细胞[7]。大鼠用25%乌拉坦4 mL/kg腹腔注射深度麻醉后,用弯头眼科剪环剪结膜和眼外肌,迅速取出眼球,在滤纸上用显微剪将球壁的肌肉及结膜剪除;一次性刀片在角巩膜缘后约2 mm切开眼球壁,后用显微剪环剪球壁,弃去角膜、晶状体及部分玻璃体;显微剪尖端轻压巩膜使之紧贴于滤纸上,轻推视网膜至视神经处,剪断视神经;将与巩膜分离开的视网膜置于含木瓜蛋白酶(活性为30 000 U/mg,Calbiochem,USA)的Hank液中,在34℃水浴中孵育33 min,每10 min轻轻振荡消化液,以均匀消化。消化液由4 mL Hank液、21 mg木瓜蛋白酶、3~5 mg L-半胱氨酸配置而成,Hank液使用前充纯氧至少30 min。视网膜组织块消化好后,用纯净的Hank液清洗2~3遍,然后置于充氧的Hank液中静置15 min,再转入含200 U/mL Dnase I(Sigma,Germany)的Hank液中,于34°C孵育4 min;将离心管中的Hank液换成细胞外液,用粗管径的滴管轻轻吹打视网膜组织片,直至组织块基本消失,获得视网膜细胞悬液,静置1~2 min;轻取上部悬浮液接种于培养皿中(Corning,USA),置于相差倒置显微镜的载物台上,静置10~15 min待细胞贴壁后可进行观察。经过机械分离的视网膜Müller细胞在显微镜下可依据其形态特征辨认,并在2 h内保持较好的细胞形态和活性[7]。通常情况下,每只动物选取2~3个细胞用于实验记录。
1.2 全细胞膜片钳记录 急性分离的Müller细胞置于外液中(mM:NaCl 113,EGTA 1,HEPES 10,Glucose 11,pH 7.4,渗透压约为300~320 mOsm/L)。记录电极由水平拉制仪(Sutter,USA)将电极毛坯(Sutter公司,货号BF150-86-10,外径1.5 mm,内径0.86 mm,长度10 cm,USA)5步拉制而成,然后经抛光仪对电极尖端抛光以提高封接效果。电极尖端口径约1~2μm,冲灌电极内液(mM:CsCl 120,NaCl 5,CaCl21,MgCl22,HEPES 10,EGTA 10,GTP-Na 0.4,ATP-Mg 2,phosphocreatine 10,pH 7.2,渗透压290 mOsm/L)后,电极电阻3~8 MΩ。全细胞膜电流采用Axopatch 200B放大器,Digidata 1322A数据采集板以及Clampex 8.0软件(Molecular Devices)记录。信号采样频率5 kHz,低通滤波频率1 kHz。所有实验均在室温条件下进行(22~25°C)。
1.3 慢性高眼压大鼠模型的建立 慢性高眼压大鼠模型的制备参照我们以前的报道[7,16]。用氯胺酮(25 mg/kg)和甲苯噻嗪(10 mg/kg)的混合麻醉药物对大鼠进行肌肉注射,再用0.4%的盐酸奥布卡因(Benoxil,Santen Pharmaceutical)进行眼球表面麻醉。左眼为手术眼,在OPMIVISU 140显微镜(Carl Zeiss)下,小心地分离并结扎大鼠左眼鼻上、鼻下及颞上的3条巩膜上静脉。术后在结膜囊内涂金霉素药膏预防暴露性角膜炎。假手术组除不结扎血管外,其余操作同手术组。
在术前、术后即刻、术后1 d、1周、2周、3周和4周测定大鼠手术眼(左眼)眼压,同时测定右眼眼压作为对照眼。肌肉注射氯胺酮(25 mg/kg)和甲苯噻嗪(10 mg/kg)麻醉动物,运用Tonolab便携式眼压计(TioLat,Finland)测眼压。每次测试均在上午9~10点进行,避免大鼠眼压昼夜波动影响实验结果。
1.4 药品和试剂 所用药品和试剂均购自Sigma公司(Sigma-Aldrich,Inc.,St.Louis,MO,USA)。Nimodipine先溶解于二甲亚枫(DMSO)中,然后再加入细胞外液中,溶液中DMSO的终浓度<0.1%,该浓度的DMSO对细胞钙电流没有显著影响。其他药品溶于去离子水,分装保存于-20℃,在实验前溶于细胞外液中。
1.5 数据处理及分析 数据处理主要是在Clampfit 10.2(Molecular Devices,Foster City,CA,USA)、Igor 4.0(Wavemetrics,Lake Oswego,OR,USA)、Coredraw X4(Corel,USA)和SigmaPlot 10.0(Jandel Scientific,Erkrath,Germany)软件上完成。在Clampfit中选取电流最大值附近4 ms内电流的平均值。所有统计数据均表示为平均值±标准误。统计数据的差异性分析均采用Student t-检验。
2 结果
2.1 大鼠视网膜Müller细胞钙通道的鉴定 首先,我们利用膜片钳电压钳技术记录大鼠视网膜Müller细胞的钙通道电流。为了诱导钙电流,先给细胞一个500 ms的-120 mV的预刺激,然后再给予从-80 mV以10 mV的增量递增到+10 mV的200 ms去极化刺激,最后回到钳制电位-40 mV(图1A)。当用Ca2+或Ba2+作为电荷载体来记录通过钙通道的电流时,无法得到可识别的内向电流。但是用Na+作为电荷载体,且外液中不含任何二价阳离子时,可以记录到较大幅度的内向电流[14,17]。因此,在以下的实验中,为了记录到电流幅度较大的钙电流,我们采用的是不含二价离子的细胞外液。
然后通过胞外施加钙通道阻断剂来鉴定我们所记录的内向电流是否为通过钙通道的电流。如图1B所示,在1例细胞上记录正常电流作为对照,然后胞外施加10μM的L-型钙通道的阻断剂nimodipine,电流明显被压抑;用不含nimodipine的细胞外液冲洗后,电流可部分恢复。通常情况下,电流在-50 mV左右达到最大。在观察的11例细胞上,-50 mV时的电流幅度被nimodipine压抑到正常的(39.8±5.4)%[对照:(-185.1±26.3)pA;nimodipine:(-68.7±10.9)pA,P<0.001]。接着,又检测T-型钙通道的阻断剂mibefradil对钙通道电流的影响。结果发现,胞外施加3μM mibefradil也可以显著压抑电流;用不含mibefradil的细胞外液冲洗1.5 min后,电流幅度可部分恢复(图1C)。在-50 mV电压下,电流被mibefradil压抑至对照的(46.7±8.7)%[对照:(-173.5± 31.4)pA;mibefradil:(-78.2±24.9)pA,n=9,P<0.001]。此外,鉴于记录到的电流是由Na+介导的,我们在胞外施加电压门控钠通道的阻断剂河豚毒素(tetrodotoxin,TTX),结果发现,TTX对电流没有影响,证明电流不是钠通道电流。这些结果表明,在大鼠视网膜Müller细胞上所记录的电流包含L-和T-型钙通道成分。

图1. 大鼠Müller细胞上的钙通道电流类型A:记录钙通道电流所用的电压刺激;B:10μM nimodipine作用40 s显著压抑内向电流,且用正常外液灌流洗脱后,电流可恢复;C:3μM mibefradil作用40 s显著压抑内向电流,且用正常外液灌流洗脱后,电流可恢复
2.2 慢性眼内压增高对大鼠钙通道电流的影响 在上述研究的基础上,我们观察了钙通道电流在慢性眼内压增高大鼠视网膜Müller细胞的变化。本研究制作的高眼压大鼠模型,术后平均眼压维持在较高水平,1周为(27.5±0.3)mm Hg(1 mm Hg=0.133 kPa),2周为(26.4±0.2)mm Hg,4周为(26.2±0.3)mm Hg,与手术前的(19.2±0.2)mm Hg和假手术组的(19.5±0.2)mm Hg的平均眼压相比,差异均有统计学意义(P<0.001),与我们先前的报道一致[7,16]。图2A所示的典型电流记录分别取自假手术组(对照组)、高眼压术后1周、2周和4周的大鼠视网膜Müller细胞。与对照组比,手术后1~4周Müller细胞钙通道电流幅度没有明显变化,在-50 mV电压下,电流幅度分别为对照组的(83.8±16.6)%(1周)(P=0.44)、(97.8±11.0)%(2周)(P=0.90)和(104.4± 18.4)%(4周)(P=0.84)(图2B)。电流成分分析发现,与对照组相比,高眼压大鼠Müller细胞的nimodipine敏感电流呈降低的趋势,分别为对照组的(70.9±13.3)%(1周)(P=0.18)、(70.5±21.9)%(2周)(P=0.25)和(69.2±23.9)%(4周)(P= 0.25)(图3A);然而,mibefradil敏感的电流在高眼压术后1周和2周呈增高趋势,分别为(157.5± 21.2)%,P=0.07;(158.6±35.5)%,P=0.13;4周时趋于正常,为(109.2±37.9)%,P=0.81(图3B)。图2与图3对照组例数不同,是由于有1个细胞在完成了总电流的记录(图2)后,在记录nimodipine和mibefradil敏感钙电流组分时,漏电流增大,封接电阻降低,放弃记录,故图3对照组中共记录了20个细胞。
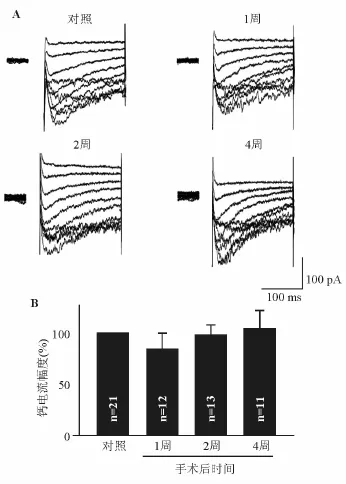
图2. 慢性高眼压大鼠Müller细胞的钙通道电流A:代表性电流记录显示假手术组(对照组)、慢性高眼压建模1周、2周和4周的大鼠Müller细胞钙通道电流;B:在刺激电压为-50 mV时的电流幅度统计直方图
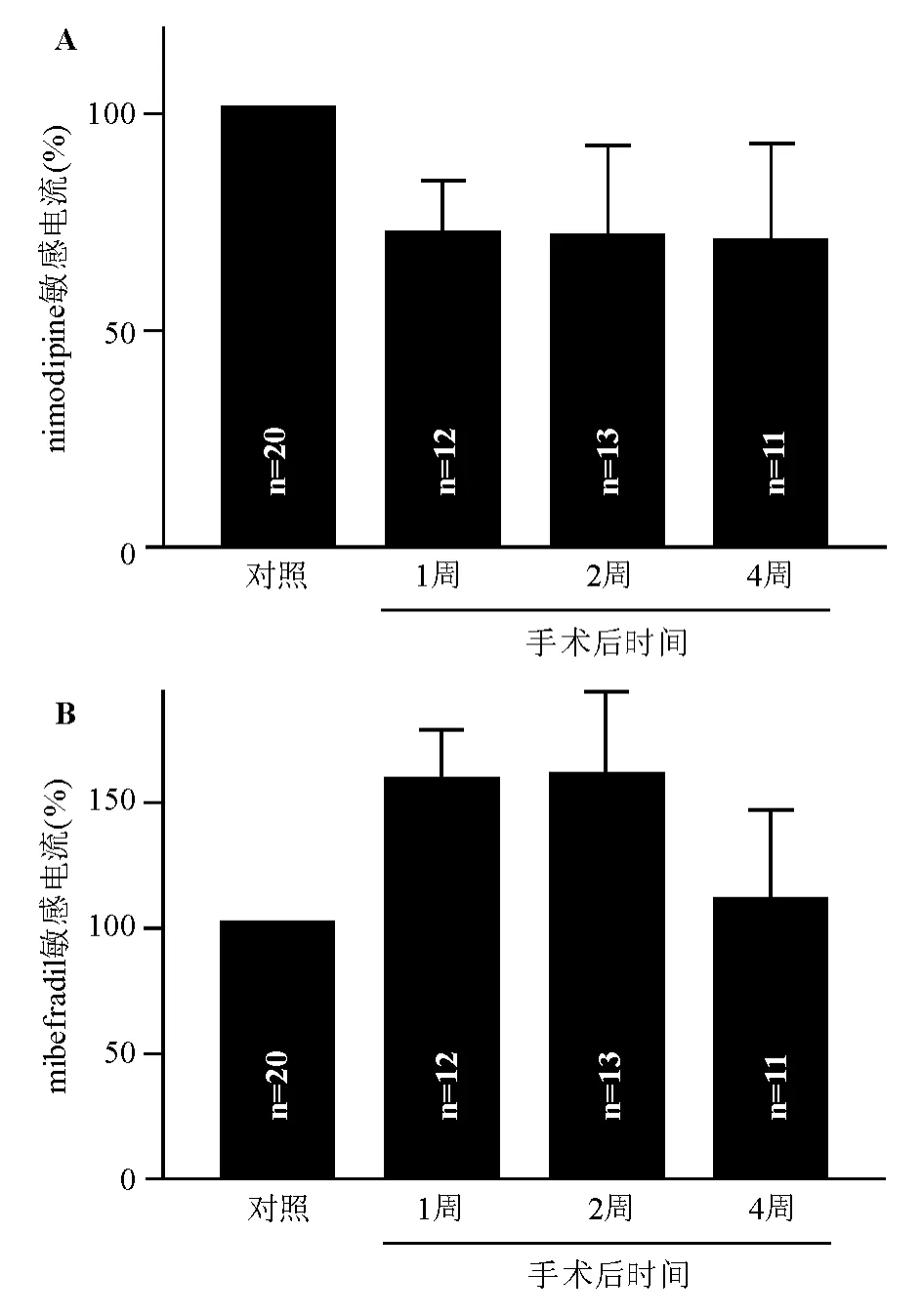
图3. 慢性高眼压大鼠Müller细胞nimodipine和mibefradil敏感钙电流组分的变化A:假手术组(对照组)、慢性高眼压建模1周、2周和4周的大鼠Müller细胞对nimodipine敏感的钙电流组分的变化。与对照组相比,手术后1周、2周和4周的nimodipine敏感电流成分呈下降趋势;B:假手术组(对照组)、慢性高眼压建模1周、2周和4周的大鼠Müller细胞对mibefradil敏感的钙电流组分的变化。与对照组相比,手术后1周、2周的mibefradil敏感电流成分呈上升趋势,4周的mibefradil敏感电流成分又恢复至正常值
3 讨论
先前有研究报道,在培养的人Müller细胞上,用Ba2+作为电荷载体可记录到低电压激活的T-型钙通道电流和高电压激活的L-型钙通道电流。然而,在急性分离的人和兔Müller细胞,用Ba2+或Ca2+作为电荷载体则很难记录到可分辨的钙通道电流,相反,在无二价离子的细胞外液中,可以记录到幅度较大的流经钙通道的Na+电流[14,17]。与这些结果相似,我们在急性分离的大鼠Müller细胞上也只能记录到较大的Na+电流,而且这些电流对电压门控钠通道阻断剂TTX不敏感,其动力学特征也不符合瞬间内向Na+电流的特征。此外,这些电流对L-型钙通道的阻断剂nimodipine和T-型钙通道的阻断剂mibefradil敏感,证明我们记录的电流是由Na+负载的钙通道电流。尽管先前利用免疫组织化学技术发现大鼠的Müller细胞表达L-型钙通道的亚型α1D(Cav1.3)[15],本研究是首次利用电生理学技术证明大鼠Müller细胞上存在L-型和T-型钙通道。另外,去除二价离子将改变细胞膜表面的电荷分布,从而使钙通道的激活动力学向超极化方向移动约20 mV,我们记录到的以Na+为载体的钙通道电流,其最大激活电压在-50 mV左右,也符合钙通道的动力学特征。
尽管电压门控钙通道表达在多种动物的胶质细胞(包括视网膜Müller细胞)上,但对这些钙通道的生理功能,我们还知之甚少。有研究报道,在一些病理状况下,激活的脑星形胶质细胞上调L-型钙通道的表达,由此导致的胞内钙浓度升高诱导胶质化。在老年人的视网膜Müller细胞,高电压激活钙通道的表达密度显著增高,且伴有Müller细胞的激活;而在PVR患者的Müller细胞,电生理记录结果显示钙通道电流的下调[14]。这些结果说明,在老化过程和PVR患者,Müller细胞的激活可能有不同的机制参与,但是什么原因导致钙通道的改变以及这种改变有什么作用还不清楚,或许钙通道的下调可以减轻Müller细胞的钙超载,从而保护Müller细胞。本研究发现,在慢性高眼压大鼠的Müller细胞,电生理记录的总钙通道电流和对照组没有明显的差异,但高电压激活的L-型钙通道电流组分呈降低的趋势,而低电压激活的T-型钙通道电流组分在眼压增高后的前2周呈增高的趋势。我们先前的研究[7]发现,伴随眼内压的增高,Kir4.1在大鼠视网膜Müller细胞的表达下调,同时Kir K+电流幅度变小,细胞膜去极化,从而导致Müller细胞的激活。由于T-型钙通道是低电压激活钙通道,细胞膜的轻度去极化将首先激活该通道,从而增加胞内Ca2+浓度,可能共同参与高眼压引起的Müller细胞的去极化和激活。此外,细胞膜去极化和增加的胞内Ca2+,还可能激活Ca2+激活的K+通道(BKCa)和增加一些Ca2+依赖激酶的活性,进而影响细胞的兴奋性和功能,这些有待于进一步的研究。
总之,我们的研究发现,在大鼠视网膜Müller细胞功能性表达L-和T-型电压门控钙通道。慢性眼内压增高导致L-型钙通道电流减小,T-型钙通道电流增大,从而增加胞内钙,共同参与Müller细胞的去极化和激活。因此,钙通道阻断剂(如T-型钙通道阻断剂),通过干预Müller细胞的钙通道,从而遏制胞内钙浓度的升高,阻止Müller细胞的激活,发挥神经保护作用。
[1]Quigley HA,Broman AT.The number of people with glaucoma worldwide in 2010 and 2020[J].Br JOphthalmol,2006,90(3):262-267.
[2]Nickells RW.From ocular hypertension to ganglion cell death:a theoretical sequence of events leading to glaucoma[J].Can J Ophthalmol,2007,42(2):278-287.
[3]孙兴怀.老年人常见青光眼的特点[J].实用老年医学,2008,22(5):326-329.
[4]Bringmann A,Iandiev I,Pannicke T,et al.Cellular signaling and factors involved in Muller cell gliosis:neuroprotective and detrimental effects[J].Prog Retin Eye Res,2009,28(6):423-451.
[5]Bringmann A,Pannicke T,Grosche J,etal.Muller cells in the healthy and diseased retina[J].Prog Retin Eye Res,2006,25(4):397-424.
[6]Zhang,S,W ang H,Lu Q,et al.Detection of early neuron degeneration and accompanying glial responses in the visual pathway in a rat model of acute intraocular hypertension[J].Brain Res,2009,1303:131-143.
[7]JiM,Miao Y,Dong LD,et al.Group ImGluR-mediated inhibition of Kir channels contributes to retinal Muller cell gliosis in a rat chronic ocular hypertension model[J].JNeurosci,2012,32(37):12744-12755.
[8]Newman EA.Voltage-dependent calcium and potassium channels in retinal glial cells[J].Nature,1985,317(6040):809-811.
[9]Welch NC,Wood S,Jollimore C,et al.High-voltage-activated calcium channels in Muller cells acutely isolated from tiger salamander retina[J].Glia,2005,49(2):259-274.
[10]Bringmann A,Pannicke T,Reichenbach A,et al.Ca(2+)channel-mediated currents in retinal glial(Muller)cells of the toad(Bufomarinus)[J].Neurosci Lett,2000,281(2-3):155-158.
[11]Puro DG,Hwang JJ,Kwon OJ,et al.Characterization of an L-type calcium channel expressed by human retinal Muller(glial)cells[J].Brain Res Mol Brain Res,1996,37(1-2):41-48.
[12]Puro DG,Mano T.Modulation of calcium channels in human retinal glial cells by basic fibroblast growth factor:a possible role in retinal pathobiology[J].JNeurosci,1991,11(6):1873-180.
[13]Newman EA.Propagation of intercellular calcium waves in retinal astrocytes and Muller cells[J].J Neurosci,2001,21(7):2215-2223.
[14]Bringmann A,Biedermann B,Schnurbusch U,et al.Age-and disease-related changes of calcium channel-mediated currents in human Muller glial cells[J].Invest Ophthalmol Vis Sci,2000,41(9):2791-2796.
[15]Xu HP,Zhao JW,Yang XL.Expression of voltage-dependent calcium channel subunits in the rat retina[J].Neurosci Lett,2002,329(3):297-300.
[16]Chen J,Miao Y,Wang XH,etal.Elevation of p-NR2A(S1232)by Cdk5/p35 contributes to retinal ganglion cell apoptosis in a rat experimental glaucoma model[J].Neurobiol Dis,2011,43(2):455-464.
[17]Bringmann A,Schopf S,Reichenbach A.Developmental regulation of calcium channel-mediated currents in retinal glial(Muller)cells[J].JNeurophysiol,2000,84(6):2975-2983.
Changes of Ca2+channel currents in retinal Müller cells in a rat chronic ocular hypertension model
YANGWei,WU Hang-Jing,WANG Zhong-feng.Institutes of Brain Science,Institute of Neurobiology,State Key Laboratory of Medical Neurobiology,Fudan University,Shanghai 200032,China
WANG Zhong-feng,Email:zfwang@fudan.edu.cn
Objective To identify the Ca2+channel types on rat retinal Müller cells by using electrophysiological techniques and to explore the changes of Ca2+channel currents in retinalMüller cells in a rat chronic ocular hypertension(COH)model.Methods Ca2+channel currents were recorded by using whole-cell recording of patch-clamp techniques on acutely isolated rat Müller cells.The COH rats were reproduced by blocking the episcleral veins.Results Na+currents through Ca2+channels could be recorded in a bath solution without divalent cation.The Ca2+channel currentswere reversibly suppressed to 39.8%±5.4%(P<0.001)and 46.7%±8.7%of control(P<0.001)by nimodipine,an L-type Ca2+channel blocker,and mibefradil,a T-type Ca2+channel blocker,respectively.In Müller cells isolated from COH rats,although the total Ca2+current amplitudes did not show significant changes as compared with control,the nimodipine-sensitive current component showed a moderate decrease(1 week:70.9%±13.3%;2 weeks:70.5%±21.9%;4 weeks:69.2%±23.9%).Meanwhile,the mibefradil-sensitive current componentwas increased to 157.5%±21.2%and 158.6%±35.5%at1 week and 2 weeks after the operation respectively,and then declined to control level at4 weeks(109.2%±37.9%).Conclusions L-and T-type calcium channelswere functionally expressed on rat retinal Müller cells.Elevated intraocular pressure in the COH rats increased the T-type Ca2+channel currents,which may contribute to Müller cell depolarization and gliosis.(Chin JOphthalmol and Otorhinolaryngol,2013,13:352-356)
Müller cells;Calcium channel;Chronic ocular hypertension;Rats;Retina
2013-06-06)
(本文编辑 诸静英)
国家自然科学基金项目(31070966;31271173);上海市科委基础研究重点课题(11JC1401200)
复旦大学脑科学研究院 神经生物学研究所 医学神经生物学国家重点实验室 上海 200032
王中峰(Email:zfwang@fudan.edu.cn)

