转化生长因子-β2诱导的上皮间质转分化对人晶状体上皮细胞基因表型的影响△
徐庆 武静 李贞
引起白内障术后发生后囊膜混浊(posterior capsular opacification,PCO)的因素有很多,包括手术创伤、炎症介质释放、血房水屏障破坏、晶状体上皮细胞(lens epithelial cells,LECs)和皮质残留、人工晶状体的材料、设计及植入位置等[1]。对PCO发生机制的研究[2]结果表明,残留的 LECs增殖、上皮间质转分化(epithelial-mesenchymal transition,EMT)和细胞外基质产生是引发PCO的主要原因。迄今为止,诱导发生上述过程的信号因子尚不明确,但在离体PCO模型的研究中发现并证实,多种调控因子参与了PCO的发生过程,包括转化生长因子-β(transforming growth factor-β,TGF-β)、成纤维生长因子(fibroblast growth factor,FGF)、表皮生长因子(epidermal growth factor,EGF)和血小板衍生生长因子(platelet-derived growth factor,PDGF)等,其中TGF-β在此过程起着至关重要的作用[3-4]。本研究在体外培养的LECs 中,加入100 pg/mL浓度的TGF-β2,诱导其发生EMT,观察转分化的人LECs在形态和基因表型上发生的变化。
1 材料与方法
1.1 材料 MTT试剂盒购于碧云天公司(中国);TGF-β2、人LECs购于ATCC公司(美国);Trizol试剂、SYBR Green I染料、Platinum Taq DNA聚合酶、SuperScript III反转录酶等购于 Invitrogen公司(美国);αB-晶状体蛋白抗体购于Chemicon公司(美国)。
1.2 方法
1.2.1 细胞培养和鉴定 用含10%胎牛血清的DMEM培养基,在37℃,5%CO2的细胞培养箱中进行人LECs常规传代培养。免疫组织化学法检测培养细胞中αB-晶状体蛋白表达,主要步骤:磷酸盐缓冲液(phosphate-buffered saline,PBS)漂洗盖玻片上培养的人LECs,室温晾干、丙醛浸泡20 min,PBS漂洗;37℃下用3%H2O2孵育10 min,PBS漂洗;羊血清37℃封闭10 min,加抗人αB-晶状体蛋白抗体,37℃孵育1 h(以PBS代替一抗作为阴性对照);加生物素标记二抗,37℃孵育30 min,PBS漂洗;加辣根过氧化物酶标记的链霉素卵白素,37℃孵育30 min,PBS漂洗;DAB/H2O2反应染色,自来水充分冲洗;苏木素复染,常规脱水、透明、干燥、封片,光学显微镜(简称光镜)下观察。
1.2.2 噻唑蓝法[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]在96孔板中每孔加入100 μL 2000 个人LECs,不同浓度的 TGF-β2(0、1、3.3、10、33、100、330 pg/mL)处理组各设置 3 个复孔,均处理0、6、24、48 h。每孔加入 20 μL MTT 溶液。在 CO2培养箱中孵育4 h。终止培养,小心吸去孔内培养液。每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪在490 nm处测量各孔的吸光度值(OD值)。以0 pg/mL浓度TGF-β2处理组为对照组,其余各浓度组的测量值为各时间点3个复孔OD值的均数。分别将各浓度组48 h和0 h OD值的均数差与对照组做组间单因素方差分析,并换算成抑制率,选出最佳TGF-β2处理浓度。
1.2.3 最佳浓度TGF-β2处理后对人LECs形态学影响 倒置显微镜观察及拍摄用最佳浓度TGF-β2处理0、6、24、48 h 后的人 LECs照片。
1.2.4 荧光定量RT-PCR法检测mRNA的表达 从经浓度为100 pg/mL 的 TGF-β2 处理 0、6、24、48 h 的人 LECs及空白对照组0、6、24、48 h的人 LECs中抽提RNA。消化离心收集2×106人LECs,用Trizol一步法提取各样品组的总RNA;每组取4 μg总RNA,进行反转录反 应,反 应 体 系:总 RNA 5 μL,oligo dT 引 物(50 μmol/L)0.5 μL,随机引物 0.5 μL,10 mmol/L dNTP 混合液1 μL,DEPC 处理水5 μL,配置得到12 μL混合液Ⅰ,再在混合液Ⅰ的反应体系内加5倍的第一链缓冲液 4 μL,0.1 mol/L dTT 2 μL,RNA 酶 抑 制 剂(40 U/μL)1 μL,反转录酶Ⅲ(200 U/μL)1 μL,混合液I 12 μL配置得到20 μL混合液Ⅱ。反应条件:25℃处理5 min,50℃处理60 min,70℃处理15 min。立即放置到冰上。得到 cDNA,反转录成 cDNA后,取2 μL DNA产物进行荧光定量 PCR。PCR体系:双蒸水12.3 μL,10 倍的 PCR 缓冲液 2 μL,50 mmol/L 的 Mg2+溶液2 μL,10 mmol/L 的 dNTPs 溶液 0.5 μL,20 倍的sybgreen 染料 1 μL,10 μmol/L 的下游引物 0.5 μL,5 U/μL的 Taq 酶 0.2 μL,混合液Ⅱ1 μL。反应条件:预变性95℃ 2 min,变性95℃ 10 s,退火60℃ 30 s,延伸70℃ 45 s,反应进行40个循环。分别检测E-钙粘蛋白(E-cadherin,CDH1)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin,VIM)的 Ct值,并换算成△Ct均数±标准差和相对表达量(2-△Ct)。各基因的引物序列见表1。对照组为actin内参基因。

表1 各基因的引物序列
1.3 统计学处理 所有实验均重复3遍。实验结果采用均数、均数±标准差以及相对表达量表示,所有数据应用SPSS12.0统计软件统计。经单因素方差分析或t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MTT法选择TGF-β2最佳浓度 用不同浓度的TGF-β2(0、1、3.3、10、33、100、330 pg/mL),分别处理人 LECs 0、6、24、48 h,经 MTT 反应后,测定 490 nm 处的OD值(表2、图1)。结果显示:100 pg/mL的TGF-β2对人LECs的增殖抑制最为明显,抑制率为36.9%,P=0.001(表3),故选择该浓度作为本实验的TGF-β2最佳处理浓度。
2.2 细胞培养及鉴定 结果显示,光镜下见传代培养人LECs呈多边形上皮样细胞贴壁生长(图2)。用免疫组织化学方法染色见αB-晶状体蛋白在培养细胞中大量表达,表达部位为胞质,证实培养细胞为人LECs(图3)。
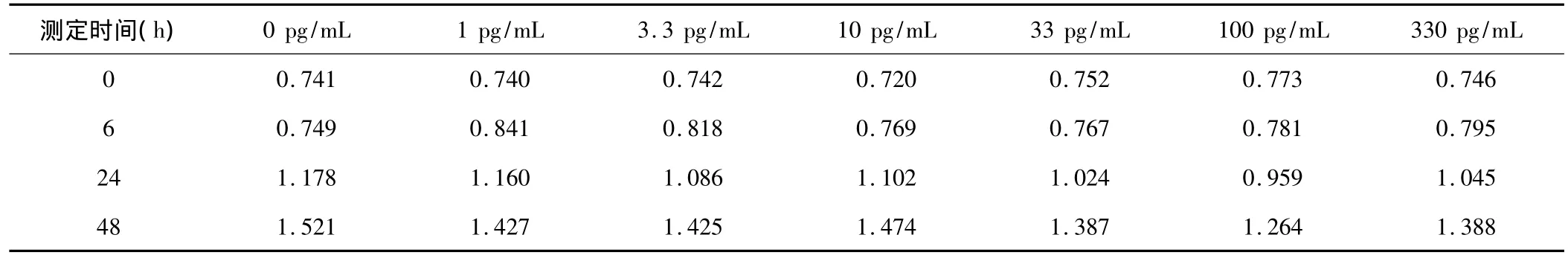
表2 MTT反应后各时间点3次测定不同浓度TGF-β2处理人LECs的OD值
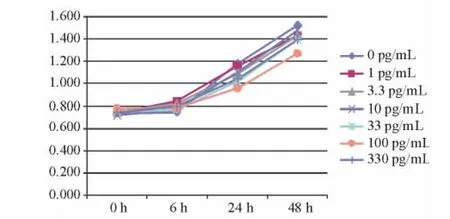
图1.细胞活性折线图
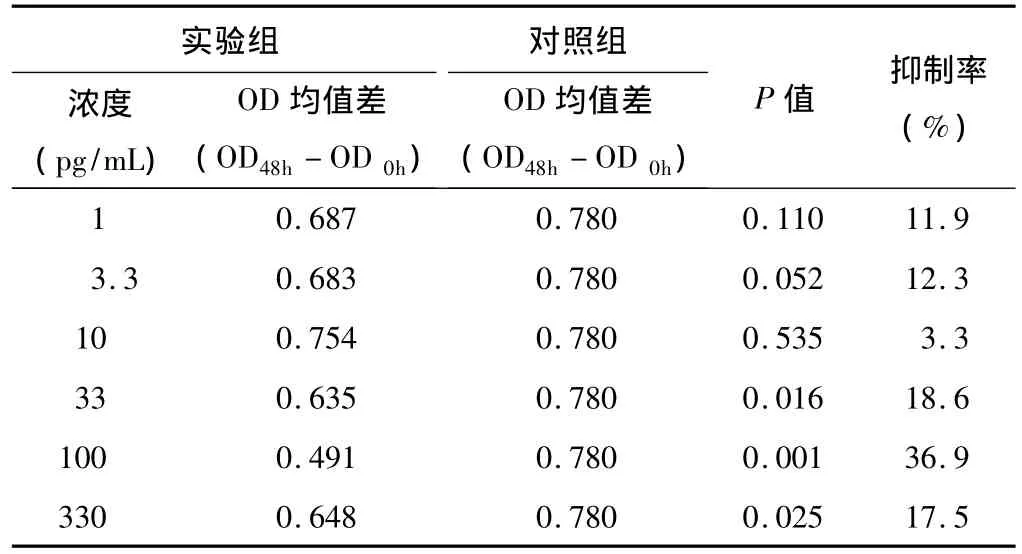
表3 不同浓度TGF-β2处理人LECs 48 h后对其增殖的影响
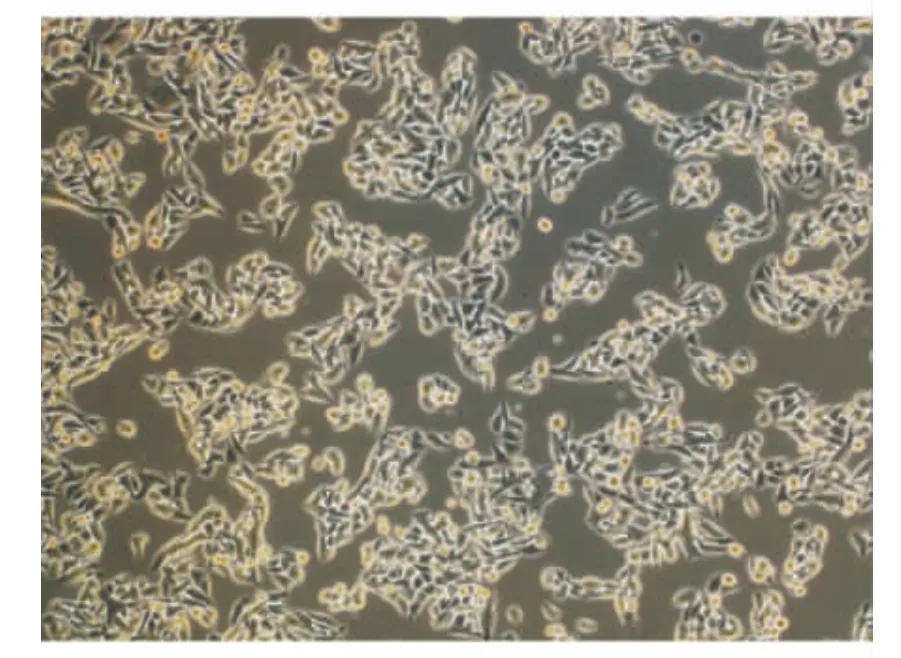
图2.培养人LECs呈多边形上皮样细胞贴壁生长
2.3 TGF-β2处理人LECs后对其形态学的影响 用100 pg/mL 浓度的 TGF-β2 处理人LECs 6、24、48 h 后,细胞形态上拉长,呈梭形,表现出间质细胞样外观(图4)。
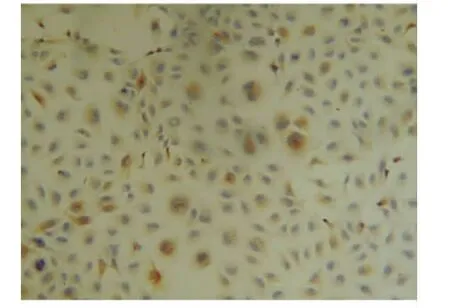
图3.光镜下观察αB-晶状体蛋白在培养细胞中表达阳性,表达部位为胞质(×100)
2.4 TGF-β2对人LECs发生EMT时相关基因表达的影响 从经浓度为100 pg/mL的 TGF-β2处理0、6、24、48 h 的人 LECs及空白对照组 0、6、24、48 h 的人LECs中抽提 RNA,反转录,qRT-PCR检测表示,CDH1、α-SMA、VIM以及对照组actin内参基因表达水平的Ct值。
2.4.1 CDH1 结果表明,100 pg/mL TGF-β2 处理人LECs后,随着时间的推移,CDH1相对表达量逐渐下调,48h时达 1.10E-06。和对照组 2.68E-06 相比,表达水平差异有统计学意义(P=0.002)(表4、图5)。
2.4.2 α-SMA 结果表明,100 pg/mL TGF-β2 处理人LECs后,随着时间的推移,α-SMA相对表达量逐渐上升,48 h时达9.21E-03。虽和对照组8.67E-03相比,表达水平差异无统计学意义(P=0.551),但仍呈上升趋势(表5、图 6)。

图4.100 pg/mL浓度TGF-β2处理6、24、48 h后的人LECs形态照片 A:处理6 h后;B:处理24 h后;C:处理48 h后
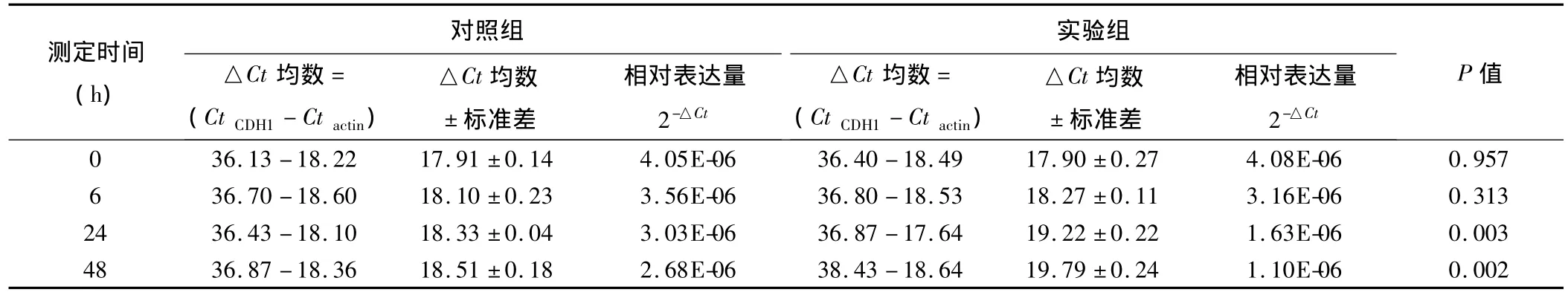
表4 100 pg/mL TGF-β2处理人LECs后各时间点测定的CDH1 Ct值、△Ct均数±标准差以及相对表达量
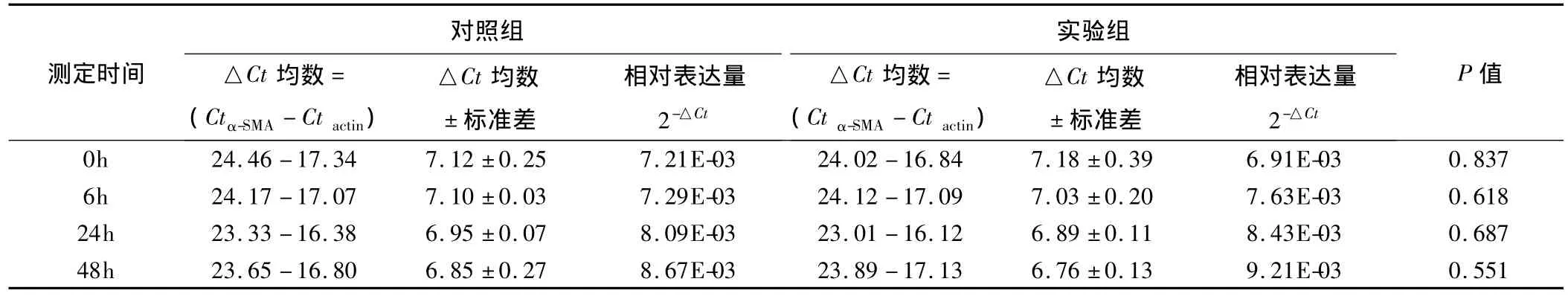
表5 100 pg/mL TGF-β2处理人LECs后各时间点测定的α-SMA Ct值、△Ct均数±标准差以及相对表达量
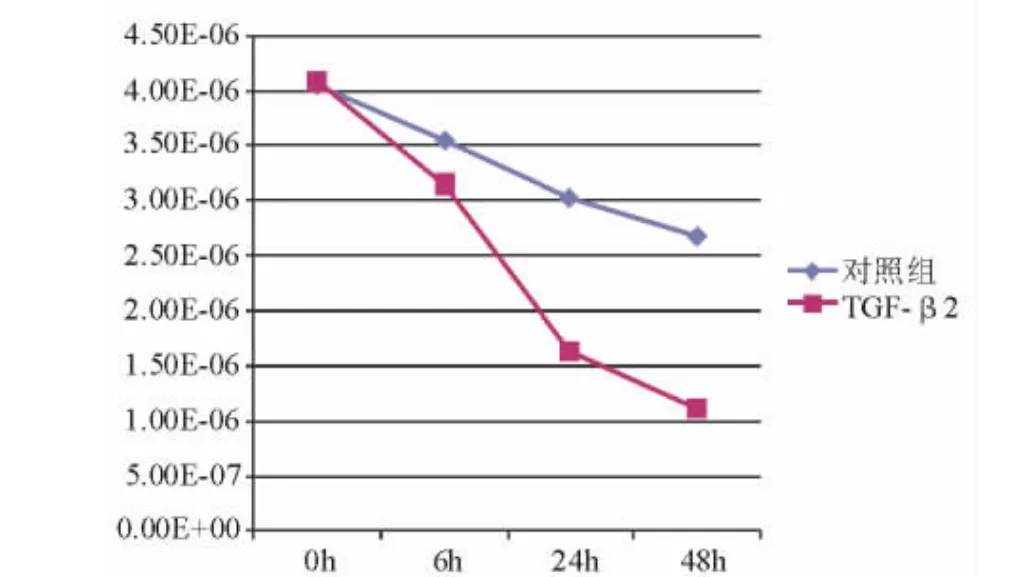
图5.100 pg/mL TGF-β2处理人LECs后各时间点测定的CDH1相对表达量曲线图
2.4.3 VIM 结果表明,100 pg/mL TGF-β2 处理人LECs后,随着时间的推移,VIM相对表达量逐渐上升,48 h时达1.64E-02和对照组1.37E-02相比,表达水平有显著差异(P=0.006)(表6、图7)。
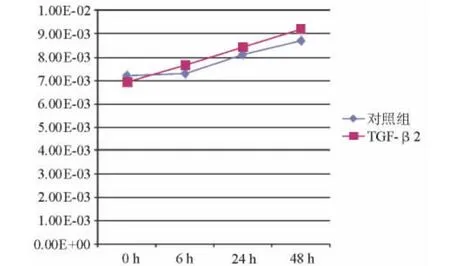
图6.100 pg/mL TGF-β2处理人LECs后各时间点测定的α-SMA相对表达量曲线图
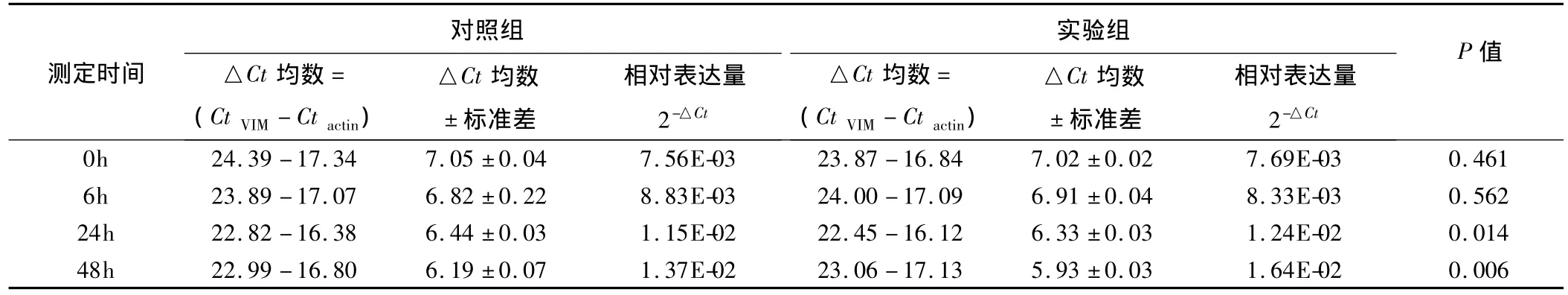
表6 100pg/mL TGF-β2处理人LECs后各时间点测定的VIM Ct值、△Ct均数±标准差以及相对表达量
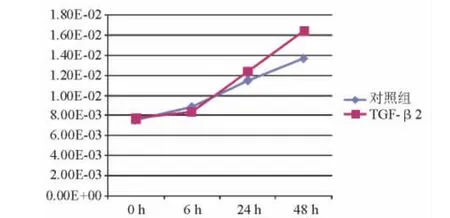
图7.100 pg/mL TGF-β2处理人LECs后各时间点测定的VIM相对表达量曲线图
3 讨论
目前认为,PCO主要是一个由多因子参与调控的、残留的LECs发生EMT的过程。届时,上皮源性的LECs在某种特定的条件下,进行一系列的转录和蛋白修饰,使其特有的上皮细胞表型表达受阻遏,如CDH1等表达下降;转而分化为表达间质源性细胞特有表型的间质细胞,如VIM、α-SMA等标志性抗原的表达上调,这使得LECs之间发生分离,失去顶-基极性和移动性增强,从而发生变形、增殖和迁移[5-7]。
Yang等[8]运用培养肾血管上皮细胞做模型进行研究,发现在TGF-β1诱导下,肾血管上皮细胞发生的整个EMT过程需完成4个关键步骤,分别是:上皮细胞失去原有的黏着特性,上皮细胞表达间质细胞的α-SMA和出现肌动蛋白结构重构,基底膜瓦解,转分化的上皮细胞增强了迁移和侵袭能力。
EMT的触发和进展是一个复杂的过程,可能由各种调控因子(如TGF-β、FGF、EGF和PDGF等)经细胞表面的丝-苏氨酸或酪氨酸蛋白激酶受体作用,通过多个互相之间存在有意义串并的路径(包括Wnt、Notch信号通路),最后激活上皮细胞基因表达下调,间质细胞基因表达上调的转录程序而发动的[6-8]。其中TGF-β在此过程中是最主要的因子。正常情况下TGF-β在人的房水、玻璃体和晶状体中均有表达,以TGF-β2为主,且多以无活性的潜伏型存在,活化后对LECs的生理性分化起着至关重要的作用。TGF-β 3种同源异构体均可诱导LECs发生EMT,而TGF-β2是效价最高的一个亚型,比 TGF-β1 强10 倍以上[9-11]
我们在实验中观察到,在体外培养的人LECs中,加入浓度为100 pg/mL的TGF-β2后,人LECs在形态上拉长,呈梭形(图4)。采用qRt-PCR检测其CDH1、α-SMA、VIM等相关基因的表达,结果发现人LECs出现了间质细胞的表型,即上皮细胞标志性基因CDH1相对表达量24 h后逐渐出现下调,并随着时间的推移越发明显,48 h时为1.10E-06,和对照组2.68E-06相比,差异有统计学意义(P=0.002)(表4、图5)。同时,间质细胞标志性基因VIM相对表达量24 h后逐渐上调,随着时间的推移而明显上升,48 h时达1.64E-02,和对照组1.37E-02 相比,差异有统计学意义(P=0.006)(表6、图7)。α-SMA的相对表达量虽然也逐渐上升,48 h时达9.21E-03,但和对照组8.67E-03相比,差异无统计学意义(P=0.551),然而48 h后α-SMA似仍有上升趋势(表5、图6),当然这还需做进一步的实验加以证实。本实验表明,在TGF-β2的诱导下,人LECs发生EMT后,其形态和基因表型均发生与间质细胞相符的变化。
CDH家族是一种同亲型结合、Ca2+依赖的上皮细胞跨膜黏着糖蛋白,其胞外结构域与邻近细胞所表达的CDH相互作用,在建立上皮细胞坚固的黏着力,维持细胞极性和紧密性等方面起着关键作用[12]。不同的细胞及其不同的发育阶段,所表达的CDH的种类与数量均有所不同。E-CDH位于上皮组织;N-CDH在神经元中;P-CDH在胎盘中;T-CDH没有胞质结构域且必须系链到质膜上。E-CDH由胞外结构域5个CDH重复(EC1~EC5),一个跨膜结构域及一个结合p120连环素和β-连环素的胞内结构域组成。胞内结构域包括一个高度磷酸化的区域,该区域对其与β-连环素的结合,继而对于E-CDH的功能至关重要。上皮细胞中,含E-CDH的细胞间连接经常毗邻含肌动蛋白的细胞骨架的微丝。CDH作为细胞黏附分子家族的一员,不仅维持着上皮细胞的黏附性,而且在细胞增殖和维持细胞极性方面也起着重要的作用[13]。CDH能够抑制细胞间的分离,因此EMT的关键步骤就是下调CDH的作用[14]。E-CDH下调会降低组织内细胞黏附的强度,导致细胞活动性(motility)增加。
在EMT过程中,转分化的上皮细胞中的肌动蛋白细胞骨架的重构以及α-SMA的表达能够形成某种结构基础,使得转分化的上皮细胞不仅在形态学上成为间质细胞[8],而且能够获得迁移、侵袭甚至收缩的能力。而α-SMA是活化状态的成纤维细胞的一种标志物,实际上这些活化状态的成纤维细胞也被称为肌成纤维细胞[15],它在形态及功能介于成纤维细胞和平滑肌细胞之间,拥有收缩及运动功能。
VIM是中间丝中的一种蛋白质,它们与微管及肌动蛋白微细丝共同组成细胞骨架。一个VIM单体有一个中央α螺旋结构域,在前端连着一个非螺旋的氨基,末端连着一个羧基。两个单体会互相扭曲,形成一个卷曲螺管形状的二聚物。两个二聚物会进一步形成一个四聚物,再与其他四聚物相连成为一片。研究发现VIM附在细胞核、内质网及线粒体的旁边或末端,因而相信它在支撑及锚固原生质内的细胞器起着重要的作用。它还能维持细胞的形状、细胞质的完整性及稳定细胞骨架内的相互作用。VIM的动态特性对细胞的灵活性非常重要。在试管压力测试中发现,VIM能提供微管及肌动蛋白所没有的弹性,因此推测它负责维持细胞骨架的完整性。另外,没有VIM的细胞受到微小的针刺时,会出现严重的伤害。在剔除VIM基因的实验老鼠中,虽然它们的动能正常,但微管网却因失去VIM而受损。这加强了微管与VIM之间存在紧密相互作用的假设。再者,当微管解聚物出现时,VIM会发生重组,这表明了两种系统之间存在内在的联系[16-17]。
[1]Saika S.Relationship between posterior capsule opacification and intraocular lens biocompatibility[J].Prog Retin Eye Res,2004,23(3):283-305.
[2]Cho HJ,Baek KE.Saika S,et al.Snail is required for transforming growth factor-beta-induced epithelial-mesenchymaltransition by activating P3 kinase/Akt signal pathway[J].Biochem Biophys Res Commun,2007,353(2):337-343.
[3]Cordeiro MF.Beyond mitomycin:TGF-β and wound healing[J].Prog Retin Eye Res,2002,21(1):75-89.
[4]de Iongh RU,Wederell E,Lovicu FJ,et al.Transforming growth factor-beta-induced epithelial-mesenchymal transition in the lens:a model for cataract formation[J].Cells Tissues Organs,2005,179(1/2):43-55.
[5]Guarino M,Rubino B,Ballabio G.The role of epithelial-mesenchymal transition in cancer pathology[J].Pathology,2007,39(3):305-318.
[6]Hugo H,Ackland ML,Blick T,et al.Epithelial-mesenchymal and mesenchymal-epithelial transitions in carcinoma progression[J].J Cell Physiol,2007,213(2):374-383.
[7]Moustakas A,Heldin CH.Signaling networks guiding epithelialmesenchymal transitions during embryo-genesis and cancer progression[J].Cancer Sci,2007,98(10):1512-1520.
[8]Yang J,Liu Y.Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J].Am J Pathol,2001,159(4):1465-1475.
[9]de Iongh RU,Gordon-Thomson C,Chamberlain CG,et al.TGF-βreceptor expression in lens:implications for differentiation and cataractogenesis[J].Exp Eye Res,2001,72(6):649-659.
[10]Carrington LM,Albon J,Anderson I,et al.Differential regulation of key stages in early corneal wound healing by TGF-beta isoforms and their inhibitors[J].Invest Ophthalmol Vis Sci,2006,47(5):1886-1894.
[11]Yokoi H,Sugawara A,Mukoyama M,et al.Role of connective tissue growth factor in profibrotic action of transforming growth factor-β:a potential target for preventing renal fibrosis[J].Am J Kidney Dis,2001,38(4 Suppl 1):S134-S138.
[12]Ozcan AA,Ozdemir N,Canataroglu A.The aqueous levels of TGF-β2 in patients with glaucoma[J].Int Ophthalmol,2004,25(1):19-22.
[13]Fouquet S,Lugo-Martinez VH,Faussat AM,et al.Early loss of E-cadherin from cell-cell contacts is involved in the onset of anoikis in enterocytes[J].J Biol Chem,2004,279(41):43061-43069.
[14]Nightingale J,Patel S,Suzuki N,et al.Oncostatin M,a cytokine released by activated mononuclear cells induces epithelial cellmyofibroblast transdifferentiation via Jak/Stat pathway activation[J].J Am Soc Nephrol,2004,15(1):21-32.
[15]Zeisberg M,Strutz F,Müller GA.Role of fibroblast activation in inducing interstitial fibrosis[J].J Nephrol,2000,13(Suppl):S111-S120.
[16]Schietke R,Brohl D,Wedig T,et al.Mutations in vimentin disrupt the cytoskeleton in fibroblasts and delay execution of apoptosis[J].Eur J Cell Biol,2006,85(1):1-10.
[17]Ivaska J,Pallari HM,Nevo J,et al.Novel functions of vimentin in cell adhesion,migration,and signaling[J].Exp Cell Res,2007,313(10):2050-2062.

