冰醋酸电离实验数据曲线全程函数构建与解析
许城玉
(南京市金陵中学河西分校江苏南京210019)
冰醋酸电离实验数据曲线全程函数构建与解析
许城玉
(南京市金陵中学河西分校江苏南京210019)
根据冰醋酸加水稀释导电性变化实验,在一定前提条件下提出了贴合数据曲线全程的函数关系式,并对误差的形成机理进行了解析。
冰醋酸电离实验;醋酸二聚体;数据曲线全程函数
一、问题提出
1.冰醋酸加水稀释过程中混合物的导电性变化是中学化学在电离理论教学过程中经常介绍的经典实验,其“混合物导电性~醋酸浓度关系曲线”也常被当作经典教学素材加以使用,但具体的实验数据却未见太多权威报道。
2.“混合物导电性~醋酸浓度关系曲线”呈单驼峰形结构,对该特殊形态曲线的形成原因,现有文献资料一般只给予曲线的下降部分(即稀溶液区段)比较准确的定量解析,但是对于曲线的上升部分(即浓溶液区段),则难以检索到严谨准确的定量分析。故在冰醋酸加水稀释的过程中,离子浓度的变化为什么会形成“单驼峰形”变化曲线、能否构建一种能涵盖实验全程的函数关系,是本研究的主要目的。
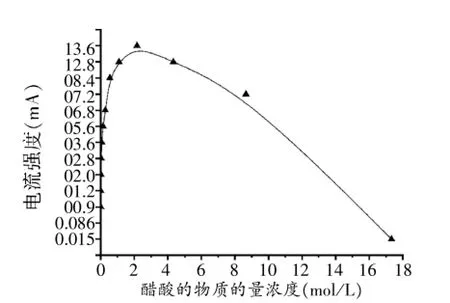
图1 混合物导电性~醋酸浓度关系曲线
二、实验过程
1.仪器与试剂
μA级灵敏电流计、12V直流稳压电源、100mL烧杯(干燥洁净)、石墨电极(干燥洁净)、pH计;
冰醋酸(CH3COOH含量≥99.0%,密度1.05g·mL-1,物质的量浓度约17.33mol·L-1)、蒸馏水。
2.实验步骤
(1)测量电流通过冰醋酸、蒸馏水时灵敏电流计的电流强度读数并记录;
(2)测量电流通过不同浓度的醋酸溶液时灵敏电流计的电流强度读数并记录;
(3)测量不同浓度醋酸溶液的pH记录其最低值及其对应溶液的物质的量浓度。
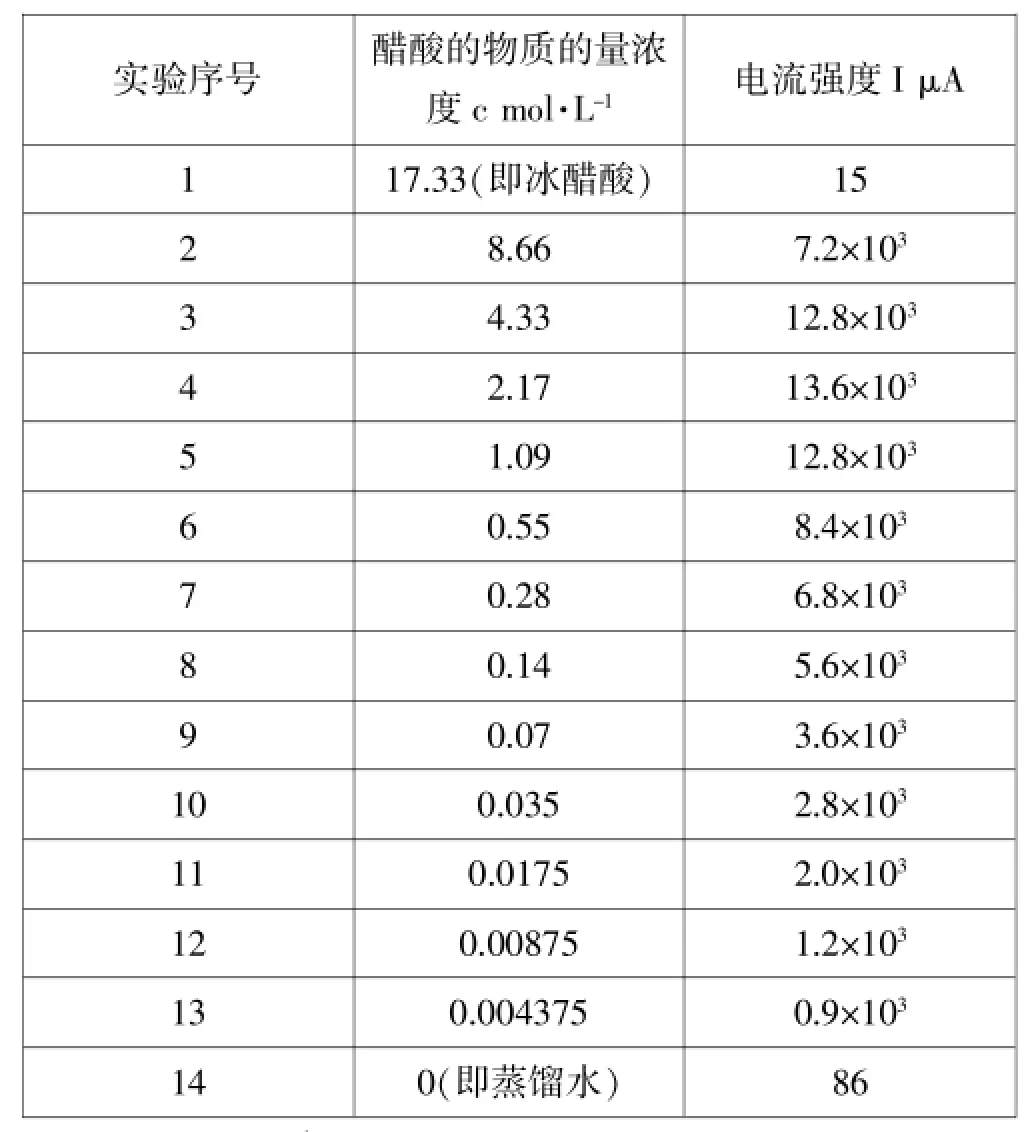
表1 不同物质的量浓度醋酸溶液的导电能力(电流强度)
3.数据与绘图
醋酸溶液的pH最低可达约4.75、对应溶液的物质的量浓度约为2.17mol·L-1,其他实验数据记录于表1。
绘制I~c曲线图1:
有鉴于电解质溶液的导电能力与溶液中的离子浓度存在对应关系,因此,上述曲线也基本体现了实验过程中混合物中离子浓度的变化情况。
三、结果讨论与函数关系的建立
1.冰醋酸的物质的量浓度
冰醋酸,CH3COOH,M.P.=16.635℃,B.P.=117.9℃,M=60.050,d=1.0492g·cm-3(20℃)[1]。因此20℃时,冰醋酸的物质的量浓度可做如下估算:
c(CH3COOH)≈1.0492g·cm-3×1000cm3÷60.050g· mol-1÷1L≈17.47mol·L-1
本文实验中的冰醋酸,c=17.33mol·L-1,这是因为样品的纯度约为99%的缘故。
2.纯水的物质的量浓度
纯水:d=0.998203g·cm-3(20℃),M=18[2]。因此20℃时,纯水的物质的量浓度可做如下估算:
c(H2O)≈0.998203g·cm-3×1000cm3÷18g·mol-1÷ 1L≈55.46mol·L-1
3.冰醋酸与水混合过程中,两者物质的量浓度的变化情况
鉴于冰醋酸与纯水的密度非常接近,两者在混合过程中的体积变化很小可以忽略,则向100mL纯度为100%的冰醋酸中加入xmL蒸馏水时,混合物的体积约为100+xmL,此时:
醋酸的总物质的量浓度
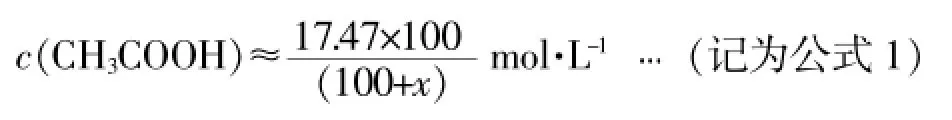
水的总物质的量浓度
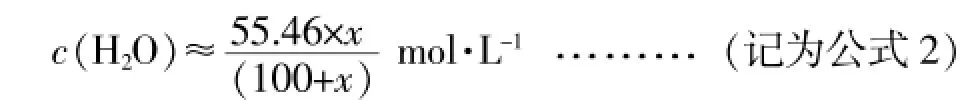
4.醋酸~水二元混合体系中的主要化学平衡
在忽略冰醋酸自偶电离平衡的前提条件下,醋酸~水二元混合体系中还存在下列两个电离平衡:
(1)CH3COOH+H2O⇌H3O++CH3COO-
(2)2H2O⇌H3O++OH-
与平衡(1)相比,水的自偶电离可以忽略,即主要考虑平衡(1),其反应平衡常数表达式如下:

上述反应平衡常数表达式将所有与平衡密切相关的微粒都作为考察对象、并以其实际存在形式的物质的量浓度作为参数项,故能适用于混溶操作全程。
将上述表达式进行简单的数学变换,得到如下表达式:
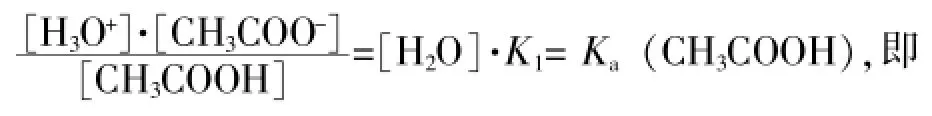

在稀溶液中,Ka(CH3COOH)通常被认为是常数,这是因为:相比较而言,稀溶液中溶剂水的物质的量远远大于溶质弱酸物质的量,因此达到平衡时水的浓度可以认为是一个常数,由此可见,弱酸的解离常数有一定的适用范围,即稀溶液;当弱酸浓度较大时则不可忽略,需用更具普遍意义的平衡常数(而非解离常数)进行相关计算。
显然,可以利用稀溶液条件下的Ka(CH3COOH)逆推出高浓度溶液中的K1,即:
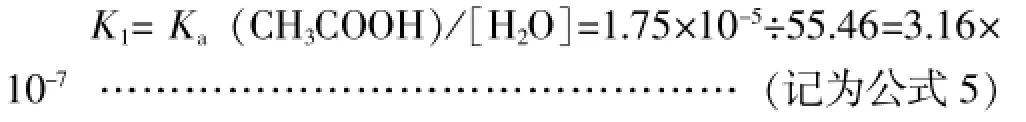
设此时醋酸的电离度为α,则从公式1、2不难推得:
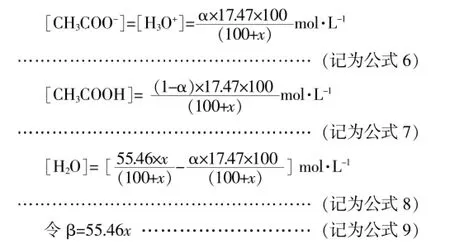
将上述公式6、7、8、9代入公式1并进行整理可得如下关系式:
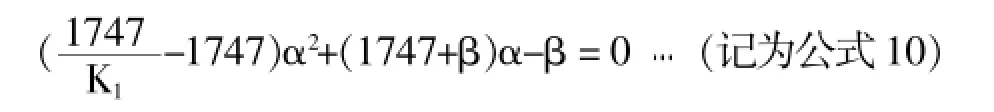
其合理算术根为

5.生成函数曲线
(1)打开EXCEL工作簿:
在A列首行输入“加入水的体积xmL”,然后在该列第2行至1501行输入数值1~1500;
在B列首行输入“β”,在第2行输入“=55.46*A2”,回车;
在C列首行输入K1,在第2行输入“=3.16*10ˆ-7”,回车;
在D列首行输入1/K1,在第2行输入“=1/C2”,回车;
在E列首行输入α,在第2行输入
“=0.5*(POWER(POWER(1747+B2,2)+4*B2*(1747*D2-1747),0.5)-(1747+B2))/(1747*D2-1747)”,回车;
在F列首行输入[CH3COO-]或[Ac-],在第2行输入“=1747*E2/(100+A2)”,回车;
选中B2~F2,拖动句柄到各列第1501行,保存。
选中F列,通过菜单插入折线图,得图2:
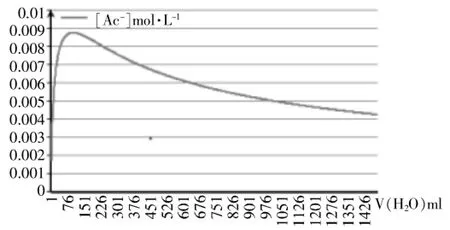
图2 离子浓度随加入水体积的变化
(2)反之,向100mL纯度为100%的蒸馏水中加入x mL冰醋酸,也设混合物的体积约为100+xmL,采用同样的推算思路,得到图3:
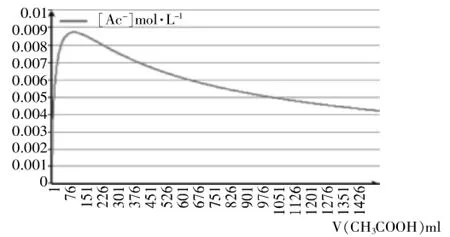
图3 离子浓度随加入醋酸体积的变化
6.结果讨论
对比图1、2、3,不难发现:
(1)图2、图3彼此吻合;
(2)图2、图3与实验数据图1都具备独特的单驼峰形结构。
以上结果说明有推演具有一定的科学性与合理性;
存在的问题也非常突出:
(1)横向比较显示:图2、图3曲线及其对应的EXCEL文档均清晰表明混合溶液导电能力极大值都出现在横坐标V(CH3COOH):V(H2O)=1∶1的100mL处,此时混合溶液中醋酸的物质的量浓度约为8~9mol·L-1;而在实验数据曲线图1中,混合溶液导电能力极大值出现在2.17mol·L-1左右,此时V(CH3COOH)∶V(H2O)≈1∶7。
(2)纵向比较显示:图2、图3曲线及其对应的EXCEL文档均清晰表明[CH3COO-]的最大值可达0.0087431mol·L-1,对应溶液的pH≈2.1;而实验数据表明醋酸溶液pH最低仅可达约4.75,对应的[CH3COO-]仅为0.00001782mol·L-1。
以上数据说明既有推演具有无法忽略的“巨大误差”!
2.问题溯源:
文献资料[3][4]表明,醋酸分子易形成稳定的醋酸二聚体:(CH3COOH)2⇌2CH3COOH。在醋酸浓溶液中单分子态醋酸分子的物质的量浓度[CH3COOH]的实际值要远远低于按公式1求得的计算值。
随着溶液的稀释,上述聚合~解聚平衡不断向单分子化方向移动;而下列平衡则同时随着水浓度的增加而向电离方向移动:CH3COOH+H2O⇌H3O++CH3COO-,溶液中H3O+、CH3COO-的数目增多但其物质的量浓度随着溶液体积的扩大而下降,进而导致曲线图中的单驼峰向后漂移。
水溶液背景下醋酸分子缔合平衡的平衡常数值尚未见文献资料报道,且笔者目前还不具备足够的实验手段与能力自行测定,故只能进行如下逆推:
实验事实表明:常温下当醋酸溶液的物质的量浓度(在假定不存在醋酸二聚体的情况下)约为2.17mol·L-1时pH可达最低(约4.75,即离子浓度峰值约为10-4.75mol·L-1)
据稀释定律有:2.17×[V(CH3COOH)+V(H2O)]≈17.47×V(CH3COOH)
可得此时:V(CH3COOH)∶V(H2O)≈217∶1530
此时:[H2O]≈55.46×1530÷(217+1530)mol·L-1≈48.57mol·L-1
又据CH3COOH+H2O⇌H3O++CH3COO-,K1=
可得:此时溶液中单分子态醋酸分子的物质的量浓度[CH3COOH]≈2.06×10-5mol·L-1
所以,此时溶液中醋酸二聚体的物质的量浓度[(CH3COOH)2]=(2.17-2.06×10-5)÷2mol·L-1
则:反应(CH3COOH)2⇌2CH3COOH的平衡常数
显然:上述反应平衡常数的倒数值K3=2.56×109即为醋酸~水二元混合物中醋酸分子的缔合常数,这一推算结果说明醋酸溶液中醋酸分子的主要存在形态为醋酸二聚体,其与文献资料提供的“醋酸分子易形成稳定的醋酸二聚体”说法是相互印证的!
[1]http://www.chemyq.com/xz/xz1/4436ytrdu.htm
[2]http://cec.ustc.edu.cn/hxsc/201011/t20101110_75243.html
[3]邢其毅,徐瑞秋,周政[M].基础有机化学(上册).北京:人民教育出版社,1980:416-417
[4]MAITLANDJONES,Jr.OrganicChemistry(SecondEdition). PrincetonUniversity,1989:890
1008-0546(2013)01-0021-03
G633.8
B
10.3969/j.issn.1008-0546.2013.01.008

