Excel在《化学反应原理》教学中的应用
吴志惠
Excel在《化学反应原理》教学中的应用
吴志惠
(江苏省横林高级中学江苏常州213101)
文章介绍了Excel软件的一些功能在《化学反应原理》实际教学中应用。
Excel;图表;IF嵌套函数;单变量求解;VBA;化学平衡;酸碱中和滴定
《化学反应原理》比较系统地介绍化学反应的基本原理和规律,知识内容复杂抽象,历来是高中化学教学中的难点。如果在教学中将抽象的内容形象化、真实化,必然有助学生的理解。Excel具有强大的计算功能及形象的图表功能,通过Excel的各种功能的组合,将帮助学生突破难点,深刻领悟抽象的反应原理,同时,还能培养学生的数据处理能力。
一、图表功能初步运用
在“化学反应速率的表示方法”这一节中(取自于江苏教育出版社出版的《化学反应原理》),要求学生绘制H2O2分解反应浓度-时间曲线,并计算任意一个10min间隔中平均每分钟H2O2的物质的量浓度的改变值。利用Excel的图表功能,能精确、快速实现这一任务。
在A1:F2区域内输入数据:(表1),将鼠标停留在数据区域,点击“插入-图表”,
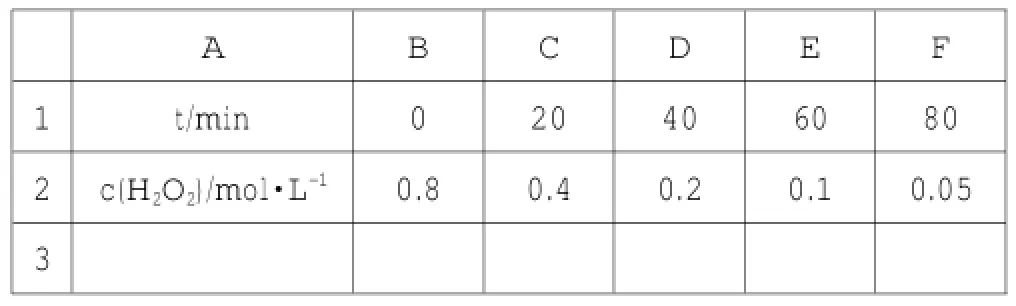
表1

图1
出现“图表向导-4步骤之1-图表类型”(见图1),在选项卡“标准类型”中选择“XY散点图”,“子图表类型”选择“平滑线散点图”,点击“下一步”,出现“图表向导-4步骤之2-图表源数据”,再点击“下一步”,出现“图表向导-4步骤之3图表选项”(见图2),点击选项卡“标题”中的“图表标题”中输入“H2O2分解反应浓度-时间曲线”,“数值(X)轴”输入“t/min”,“数值(Y)轴”输入“c(H2O2)/mol/ L”,点击选项卡“网格线”中“数值(X)轴”与“数值(Y)轴”均勾选“次要网格线”,选项卡“图例”把“显示图例”的勾去掉。点击完成就得到H2O2分解反应的浓度-时间曲线图(见图3)。
选中X轴的网格线,右键点击后出现“网格线格式”,修改“刻度”中“次要刻度单位”为“10”,同样方法,修改Y轴网格线的“主要刻度单位”为“0.1”“次要刻度单位”为“0.01”,“图案”-“线条”-“颜色”选为“红色”,并拉大图像,可以清晰、快捷地完成教材中规定的“以10min为时间间隔,计算任意一个10min间隔中平均每分钟H2O2的物质的量浓度的改变值”任务。
右键点击曲线,选择“添加趋势线”,选项卡“类型”中选择“指数”,选项卡“选项”,勾选“显示R平方值”,“趋势预测”中“前推20个单位”,确定后曲线自动延伸至100min中,在图上出现“R2=1”,表明吻合度最高。利用这种方法,可以预测100min中H2O2的浓度。
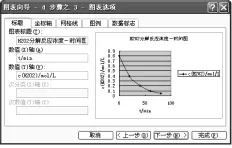
图2
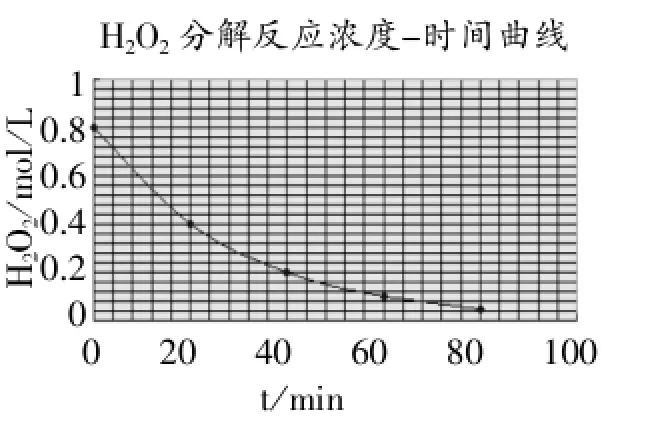
图3
二、IF嵌套函数与图表功能的结合运用
酸碱滴定曲线的绘制,可以采用pH传感器、数据采集器和电脑,利用相应的软件就能实现快速便捷绘制。这种方法的缺点是装备投入较大,用excel同样可以实现数据的快速处理及曲线的绘制。
在表格中输入如下数据:
由于氢离子浓度的计算方法与溶液的酸碱性有关,当溶液显酸性时溶液显中性时为c(H+)=1×107,溶液显碱性时为c(H+)=KW因此必须用IF嵌套函数解决这个问题,在E2单元格中输入“=IF((A¥2*B¥2=C¥2* D2),10ˆ-7,(IF((A¥2*B¥2>C¥2*D2),(A¥2*B¥2-C¥2 *D2)/(B¥2+D2),10ˆ-14*(B¥2+D2)/(C¥2*D2-A¥2 *B¥2))))”,pH=-log(c(H+)),在F2单元格中输入“=-LOG(E2)”。在D3单元格中输入2.00,选中D2、D3单元格,鼠标放在单元格D3的右下角,会出现黑十字(填充柄),往下拖动,可以以等差数列的方式实现自动填充其他数据,直到40.00。由于溶液接近中性时,体积细微的变化会引起pH较大的变化,因此,在D20单元格下插入8行,在D21单元格内输入“19.20”,使每次的体积变化为“0.02mL”,用填充柄自动填充其他数据。选中单元格E2、F2,用填充柄自动填充公式,就能得到氢离子浓度及对应的pH。
按住“Ctrl”键不放松,选择氢氧化钠溶液的体积与pH这两组数据(不要多选),点击“插入-图表”,在选项卡“标准类型”中选择“XY散点图”,“子图表类型”选择“平滑线散点图”,就能得到滴定曲线。通过这种方法,可以使学生直观地观察到滴定曲线的突变。
只需改变单元格A2、B2、C2(即盐酸的浓度、体积或者氢氧化钠的浓度),pH能实时改变,能方便地观察曲线的变化过程,从而理解为什么氢氧化钠的浓度与盐酸浓度要相近的原因。

表2
三、单变量求解功能的应用
化学平衡的移动是高中教学的重点与难点,由于概念抽象,学生不易理解接受。如果把抽象的推导过程用数据展现给学生,将帮助学生容易突破难点。但是,绝大多数的化学平衡的计算是高次方程,不易求解,如果引入Excel单变量求解功能,将解决这一棘手问题。
下面以2SO2+O2⇌2SO3这一化学平衡为例来说明如何运用这一功能:
恒温恒容条件下,容器体积为1L,假设SO2、O2与SO3的初始投料分别为1mol、1mol、0mol,平衡常数K= 20,建立如下表格(见表3)。
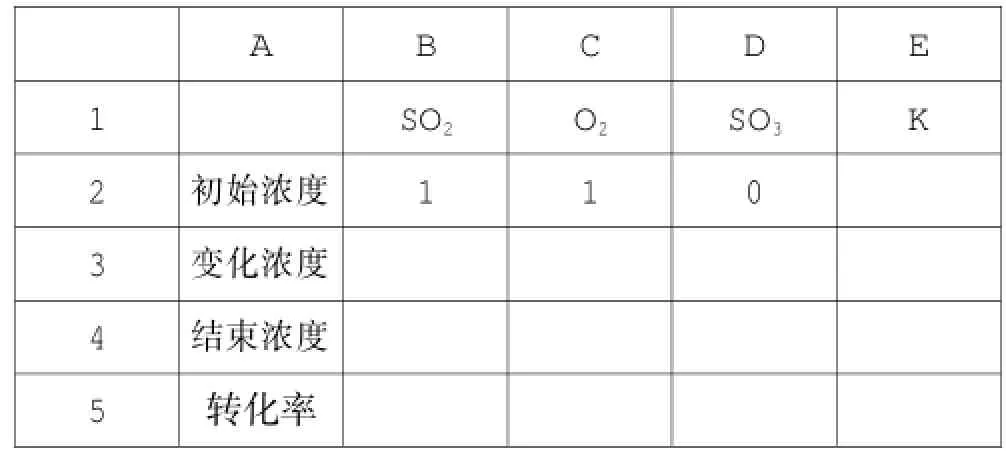
表3
SO2结束时浓度为“初始浓度-变化浓度”,在B3单元格中输入“=B2-B3”。O2的变化浓度是SO2的一半,C3单元格中输入“=B3/2”,C4单元格中输入“=C2-C3”。SO3的变化浓度与SO2的相同,D3单元格中输入“=B3”,D4单元格中输入“=D2+D3”。平衡常数,在 E2单元格中输入公式“=D4ˆ2/B4ˆ2/C4”。点击“工具-单变量求解”,在“目标单元格”中选择“E2”单元格,目标值20(即平衡常数K= 20),“可变单元格”中选择“B3”单元格(即变量),见图4。点击确定后,出现数据(见表4)。
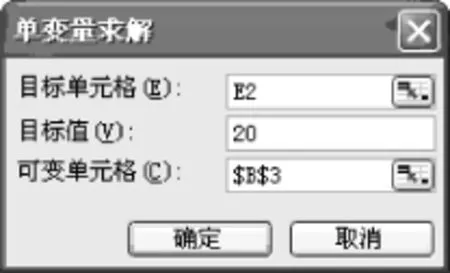
图4
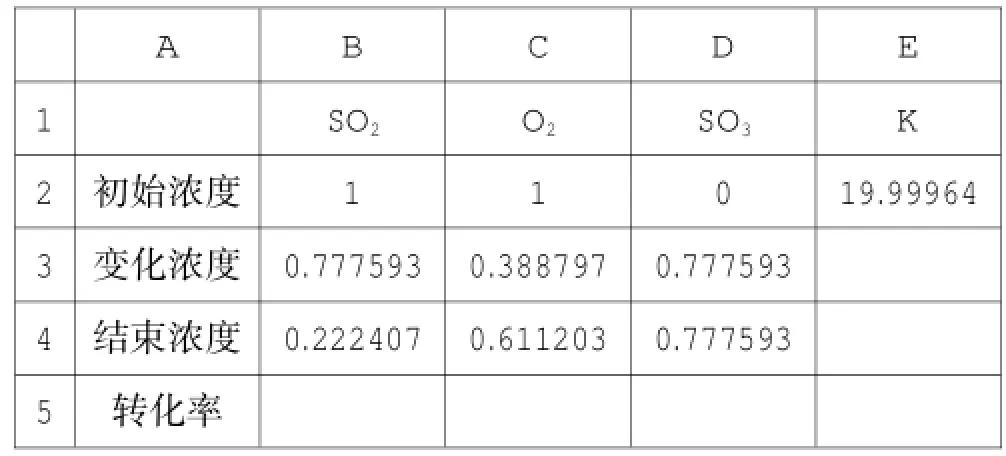
表4
点击“工具-选项-重新计算-迭代计算”中,更改“最多迭代次数”为“10000”,“最大误差”为“0.0000001”,并勾选该项,重新进行单变量求解,可得更精确的数据,见表5。
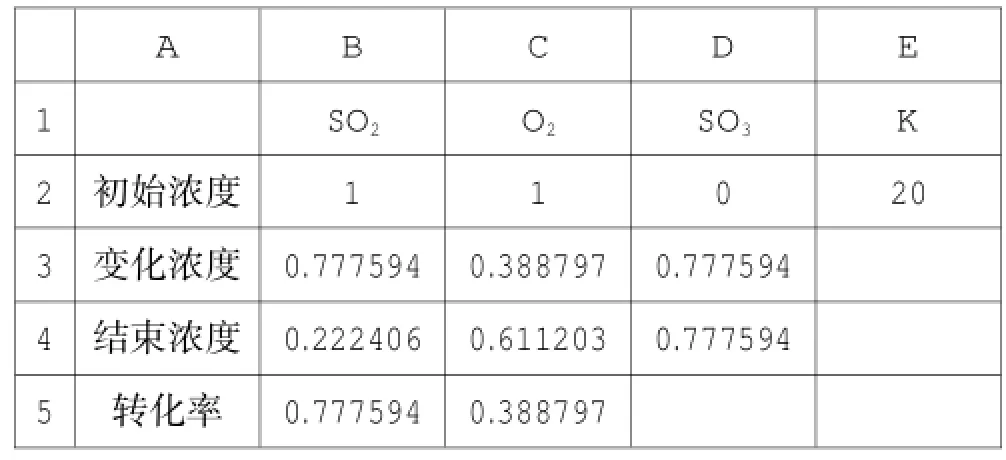
表5
在B5单元格中输入“=B3/B2”,C5单元格中输入“= C3/C2”,即可得反应物的转化率。
复制该表格,粘贴在A7、A13单元格,即可得两张相同的表,将其中一张表中的SO2的初始浓度改为2,其他不变,另一张表中O2的初始浓度改为2,其他不变,都重新用单变量求解进行运算,得新数据,见表6与表7。
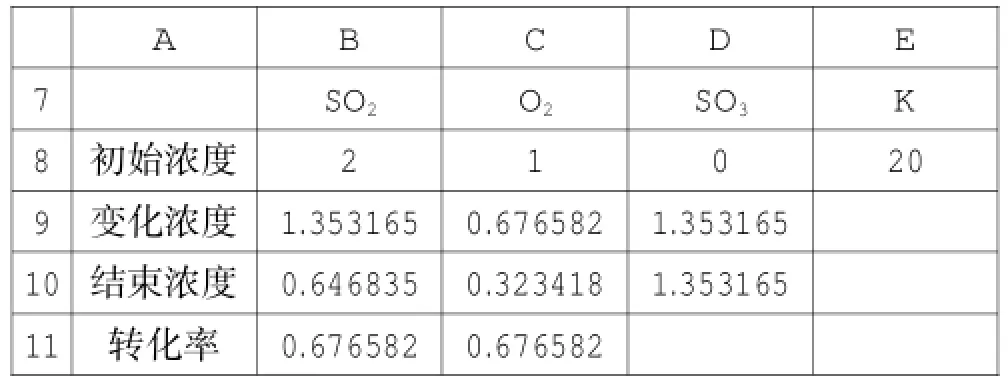
表6
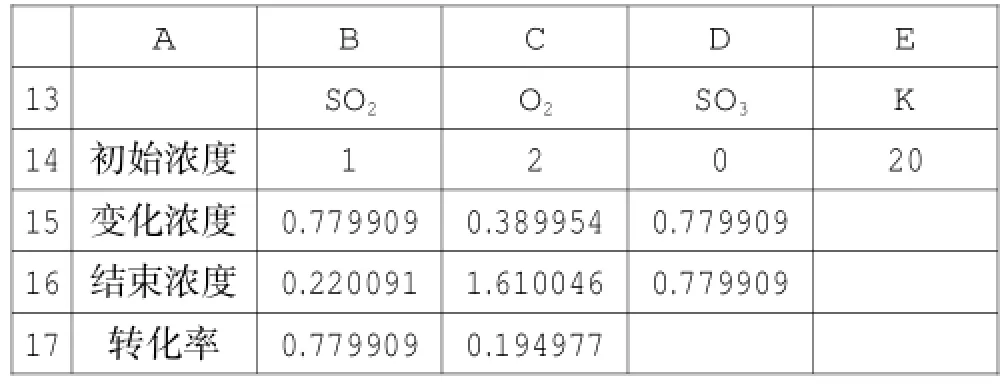
表7
对比表5、表6、表7的数据,可以很容易得出结论:恒温恒容条件下,对于可逆反应“A+B⇌C”,如果增加反应物A的物质的量,平衡向正方向进行,A的转化率下降,B的转化率升高。
可逆反应2NO2⇌N2O4是一种特殊类型的反应,只有二种物质,该平衡体系涉及一些问题学生难以理解。运用单变量求解功能,可以得以下四张表(注:除表9外,均为恒温恒容条件下,表9是对表8的容器进行恒温压缩)。
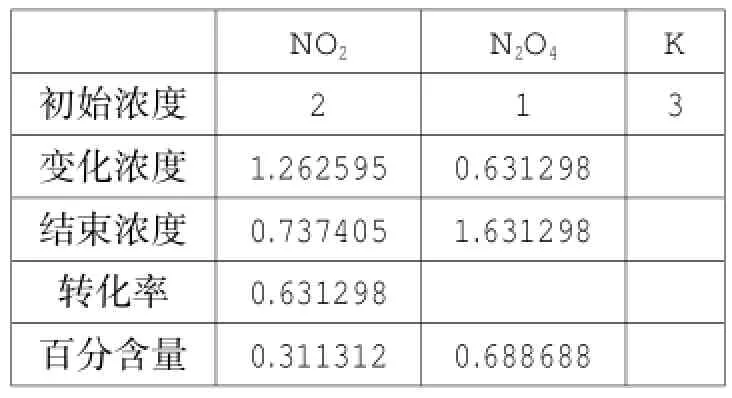
表8
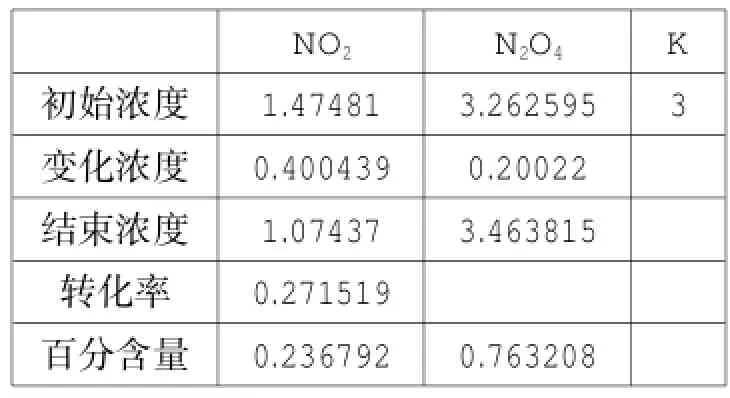
表9
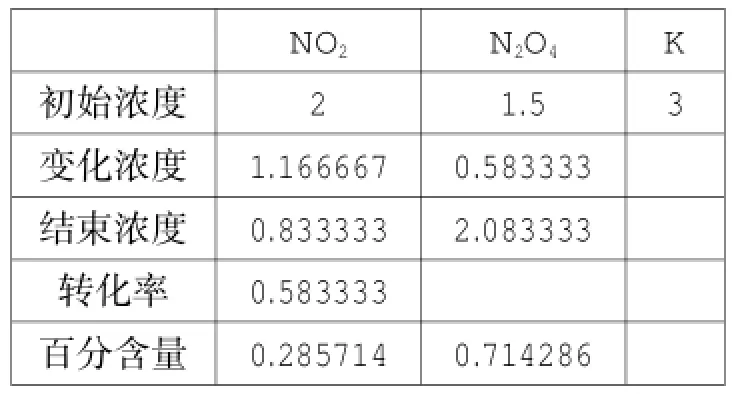
表10
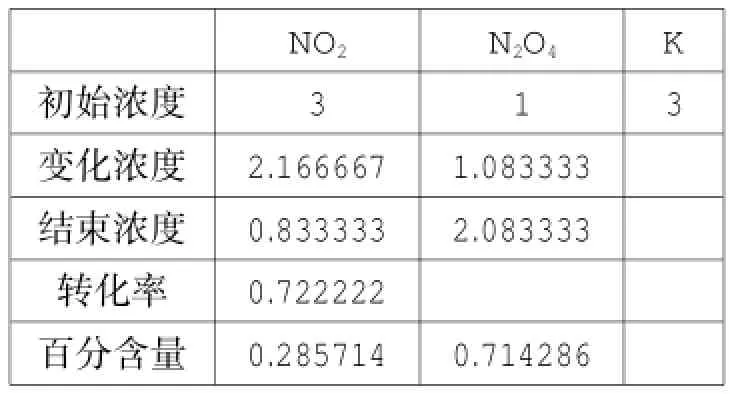
表11
对比表8与表11,可以得出结论:增加NO2的投料,平衡向正方向移动,NO2的转化率提高,NO2百分含量下降;对比表4与表10,可以得出结论:增加N2O4的投料,平衡向逆方向进行,NO2的转化率降低,NO2百分含量下降;表10与表11是等效平衡,平衡时NO2的百分含量相同,但由于投料方式不同,NO2的转化率不同。
比较表8与表9的数据,表9相当于对表8的体系到达平衡后,使表8的容器体积变为原来的一半,可以得出结论:开始时颜色加深,随着平衡的正向移动,颜色逐渐变浅,到达新平衡后,颜色仍比上次平衡时深。
通过这些直观数据比较得出的结论,然后引导学生定性分析这些结论的原因。
四、单变量求解、VBA、函数及图表的综合运用
如果要绘制强碱滴定弱酸的pH变化曲线,pH值的计算常用的方法是用近似法,利用单变量求解可以求出相对更精确的值。但是单变量求解的缺点是每次只能求出一个pH值,如果要每次计算,就会十分繁琐,可以编写简单的VBA来解决这个问题。
比如,用0.10mol·L-1的NaOH溶液来滴定20mL 0.10mol·L-1的醋酸溶液,建立如下初始表格,见表12。
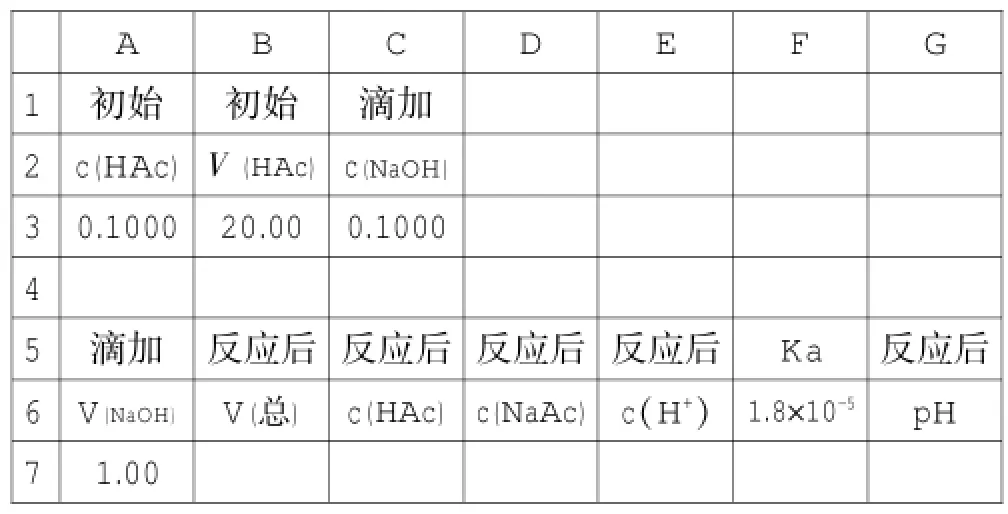
表12
V(总)=V(HAc)+V(NaOH),在B7单元格中输入“=B¥3+A7”,反应后的c(HAc)=(n(HAc)初始-n(NaOH))/V(总),在C7单元格输入“=(A¥3*B¥3-C¥3*A7)/ B7”;c(NaAc)=n(NaOH)/V(总),在D7单元格输入“=C¥3*A7/ B7”;假定H+浓度为0.000001 mol·L-1,
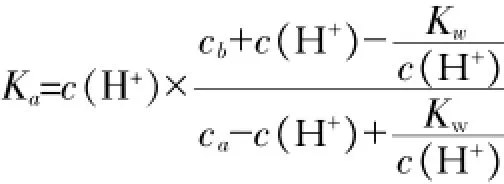
在E7单元格输入“0.000001”,在F7单元格输入“=E7*(D7+E7-10ˆ-14/E7)/(C7-E7+10ˆ-14/E7)”;在碱没有过量前,pH的计算直接用H+的浓度计算,当碱过量后,直接用碱的浓度计算,pH=14-pOH,在G7单元格输入“=IF(C7>=0,-LOG(E7),14+LOG(-C7))”。在A8单元格中输入“2.00”,选中A7、A8两个单元格,用填充柄填充至40,利用填充柄填充B至G列的第7行以下的单元格的函数或数值。
点击“工具-宏-Visual Basic编辑器”,“插入-模块”,在代码窗口中输入下列代码:
End Sub
1008-0546(2013)05-095-03
:G632.41
:B
10.3969/j.issn.1008-0546.2013.05.044

