氟伐他汀对高糖培养大鼠肾小球系膜细胞CTGFmRNA的影响及其作用机制的研究
王丽晖,吴广礼,张丽霞,李 赛,黄旭东
氟伐他汀对高糖培养大鼠肾小球系膜细胞CTGFmRNA的影响及其作用机制的研究
王丽晖,吴广礼,张丽霞,李 赛,黄旭东
目的探讨高糖状态下肾小球系膜细胞中结缔组织生长因子(CTGF)mRNA的表达以及HMG-CoA还原酶抑制剂氟伐他汀对其的影响及作用机制。方法 体外培养大鼠肾小球系膜细胞,实验分为4组:低糖组(LG组,5.5 mmol/L葡萄糖);低糖 +甘露醇组(LG+M组,5.5 mmol/L葡萄糖 +24.5 mmol/L甘露醇);高糖组(HG组,30 mmol/L葡萄糖);高糖+氟伐他汀组(HG+Flu组,30 mmol/L葡萄糖+10μmol/L氟伐他汀)。采用逆转录-聚合酶链反应(RT-PCR)检测CTGF和纤维粘连蛋白(FN)mRNA的表达,Western印迹检测磷酸化p38丝裂原活化蛋白激酶(p-p38 MAPK)及其下游因子cAMP反应元件结合蛋白1(p-CREB1)。结果 与LG+M组相比,HG组系膜细胞增殖明显,p-p38 MAPK、p-CREB1表达明显上调,CTGF和FNmRNA的表达增加。与HG组比较,HG+Flu组可抑制系膜细胞增殖,p-p38 MAPK、p-CREB1的表达明显下调,CTGF和FNmRNA的表达降低。结论 高糖状态下肾小球系膜细胞CTGFmRNA表达增强,p-p38 MAPK和p-CREB1表达明显升高,氟伐他汀抑制肾小球系膜细胞CTGFmRNA和细胞外基质的分泌可能部分是通过影响p38 MAPK及其下游核因子CREB1的激活而实现。
系膜细胞;HMG-CoA还原酶抑制剂;结缔组织生长因子;p38丝裂原活化蛋白激酶;cAMP反应元件结合蛋白1;氟伐他汀;大鼠,Wistar
结缔组织生长因子(connective tissue growth factor,CTGF)作为转化生长因子-β1(TGF-β1)的下游因子,是目前颇受关注的促进细胞和组织纤维化的重要细胞因子,在肾小球硬化和肾间质纤维化中发挥一定作用[1-4]。p38丝裂素活化蛋白激酶(p38 mitogen-activated Protein Kinase,p38 MAPK)途径在高血糖和血管紧张素Ⅱ的作用下被激活,在糖尿病肾病的发生发展中发挥一定的作用,是近年来备受关注的细胞内重要信号转导途径[5]。以往研究表明,羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂洛伐他汀能够抑制糖尿病大鼠肾组织细胞外基质的蓄积,延缓糖尿病肾病的发展[6-7],其非依赖降脂的抑制细胞增殖作用越来越受到人们的重视。为进一步探讨HMG-CoA还原酶抑制剂对糖尿病肾病可能的保护作用及机制,本实验通过体外培养大鼠肾小球系膜细胞,观察HMG-CoA还原酶抑制剂(Statins)氟伐他汀对高糖培养系膜细胞CTGF和细胞外基质蛋白表达的影响,同时观察p38 MAPK下游因子cAMP反应元件结合蛋白1(cAMP response elementbingding protein,p-CREB1)的表达,以探讨氟伐他汀可能的肾脏保护机制。
1 材料和方法
1.1 材料 氟伐他汀(粉剂)由北京诺华制药有限公司馈赠。健康清洁级雄性Wistar大鼠,体重100~150 g,由河北省实验动物中心提供,实验动物合格证号701073。小鼠抗p-p 38 MAPK单克隆抗体,小鼠抗p-CREB1单克隆抗体,ECL增强化学发光试剂盒均购自Santa Cruz公司,RT-PCR试剂购自Promega公司产品,Ⅳ型胶原酶购自Sigma公司。辣根酶标记羊抗小鼠或兔IgG由北京中山公司进口分装。聚偏二氟乙烯膜(PVDF)购自Milipore公司。
1.2 系膜细胞的分离培养和刺激实验 Wistar大鼠乙醚麻醉后,无菌条件下取出肾脏(手术器械均经200℃烘烤4 h消毒),用4℃ D-Hanks液冲洗肾脏,去掉被膜,小心分离肾皮质并将其剪成1~2 mm的3小块。将肾皮质碎块用D-Hanks液洗涤2~3次,分别经80、140和200目不锈钢筛网,收集200目的肾小球,加入0.1%Ⅳ型胶原酶消化后,离心收集被消化的肾小球,加入PRMI1640完全培养液(含体积分数0.2胎牛血清,2 mmol/L谷氨酰胺,100 kU/L青霉素,100mg/L链霉素,0.66 kU/L胰岛素),于37℃、5%CO2孵箱中培养,4~6 d首次换液。以后每2~3 d换液1次,约2~3周系膜细胞长满培养瓶底,应用相差倒置显微镜观察细胞形态。将第3代系膜细胞接种于24孔板,48 h后用PBS冲洗系膜细胞,乙醇固定30 min,再分别用兔抗大鼠结蛋白(desmin)、角蛋白、Ⅷ因子单克隆抗体为一抗,行SP法,DAB显色,阳性信号呈棕黄色或褐色。抗desmin抗体阳性,抗角蛋白、Ⅷ因子阴性表明所鉴定的细胞为系膜细胞。0.25%胰蛋白酶消化传代,取4~10代细胞用于实验研究。将细胞分为4组:低糖组(LG组,5.5 mmol/L葡萄糖);低糖+甘露醇组(LG+M 组,5.5 mmol/L 葡萄糖 +24.5 mmol/L甘露醇);高糖组(HG组,30 mmol/L葡萄糖);高糖+氟伐他汀组(HG+Flu组,30 mmol/L葡萄糖+10μmol/L氟伐他汀)。刺激48 h后收集细胞,分别提取蛋白、RNA及细胞上清液。
1.3 MTT法检测系膜细胞增殖水平 取第4代系膜细胞应用胰酶消化,加入含15%胎牛血清的RPMI1640培养液于离心管中,反复吹打,混匀,按每孔200μl,密度4000/孔接种于96孔板中。待系膜细胞贴壁24 h后,加无血清培养液200μl,同步24 h,使细胞同步于G0期。每6孔细胞为一组,按1.2的分组进行刺激,刺激时间分别为12、24、48 h。此外,观察不同氟伐他汀浓度(1、10、20μmol/L)对高糖状态下系膜细胞增殖的影响,选择刺激时间为48 h。将细胞置于 37℃、5%CO2孵箱培养,加入 MTT(5 g/L),于4 h后每孔分别加入DMSO,用酶标仪观察,在490 nm波长处记录A值。
1.4 逆转录-聚合酶链反应(RT-PCR)检测CTGF和纤维粘连蛋白(fibronectin,FN)mRNA的表达应用Trizol试剂提取细胞总RNA,用紫外-可见分光光度仪测定其纯度和含量。在逆转录酶催化下合成cDNA,以适量cDNA为模板在TaqDNA聚合酶催化下进行PCR扩增。CTGF上下游引物:5'-GCCTCAAACTCCAAACACCATC-3'和5'-CAGCAAACACTTCCTCGTGGA-3',扩增产物:252 bp。FN上下游引物:5'-CTGAACCAGCCTACGGATGACT-3'和 5'-CCGTCGTCATAACACGTTGCT-3', 扩 增 产 物:305 bp。GAPDH上下游引物为:5'-TATCGGACGCCTGGTTAC-3'和 5'-CTGTGCCGTTGAACTTGC-3',扩增产物为140 bp。所用引物均由上海生工生物公司合成。CTGF和FN的扩增条件为:预变性94℃、5 min,进入循环,94℃、0 s,退火温度分别为58℃和56.9℃、60 s,72℃、60 s,30 个循环后 72℃、8 min。将PCR产物在2%琼脂糖凝胶中进行电泳,置于凝胶图像分析系统(UVP公司,美国)进行吸光度扫描,以管家基因GAPDH作为内参照校正,用目的基因吸光度与GAPDH吸光度的比值代表目的基因的相对表达含量。
1.5 Western印迹检测p-p38 MAPK和p-CREB1的表达 细胞用冰冷PBS(1 mmol/L正钒酸钠)冲洗2遍,加入细胞裂解液(20 mmol/L Tris HCl,2.5 mmol/L EDTA,体积分数0.1甘油,质量浓度10 g/L的SDS,体积分数0.01的 TritonX100,质量浓度50 g/L去氧胆酸钠,10 mmol/L焦磷酸钠,50 mmol/L氟化钠,1 mmol/L正钒酸钠,质量浓度1 g/L苯甲基磺酰氟),冰浴1 h,于4℃、14000 r/min 离心25 min,应用Lowry法测定上清液蛋白浓度。取细胞裂解蛋白50μg,经8%十二烷基硫酸钠-聚丙烯酰胺(SDS PAGE)凝胶电泳后电转移至PVDF膜;5%脱脂奶粉封闭PVDF膜2 h,加入小鼠抗p-p38 MAPK和抗p-CREB1单克隆抗体。抗体经过1∶200稀释,4℃过夜,洗膜后加辣根过氧化物酶标记的羊抗小鼠或兔抗体(1∶5000 稀释),37℃ 孵育 1.5 h,洗膜后加ECL试剂,然后将PVDF膜放入X光片暗盒、压片、显影、定影。用美国UVP公司LabWorks4.5分析系统软件对Western条带进行定量分析,确定杂交条带的吸光度值。
1.6 统计学处理 采用SPSS 11.0统计软件进行统计分析,实验数据以均数±标准差(±s)表示,组间比较采用方差分析,α=0.05为检验水准。
2 结果
2.1 肾小球系膜细胞的鉴定 倒置相差显微镜下见系膜细胞呈梭形、不规则星形或树枝状,生长旺盛时多呈梭形。HE染色见系膜细胞胞浆向外伸出数个长短不一的突起,核清晰位于细胞中央,呈圆形或椭圆形(图1)。染色显示细胞胞浆结蛋白阳性(图2),角蛋白、Ⅷ因子阴性,从而证明这些细胞为系膜细胞而非肾小球上皮细胞或内皮细胞。
图1 大鼠肾小球系膜细胞(HE×200)图2 结蛋白在大鼠肾小球系膜细胞中表达(DAB×200)
2.2 氟伐他汀对系膜细胞增殖的影响 LG组与LG+M组差异无统计学意义(P>0.05);与LG+M组相比,高糖能够促进系膜细胞增殖,并随时间延长更加明显;10μmol/L氟伐他汀作用24 h和48 h后,能够抑制高糖对系膜细胞的促增殖作用(表1)。1、10和20μmol/L氟伐他汀对高糖培养系膜细胞增殖都有抑制作用,并且随药物浓度的增加抑制作用更加明显(表2)。2.3 RT-PCR检测CTGF和FN mRNA的表达 LG组与LG+M组差异无统计学意义(P>0.05);与LG+M组相比,高糖刺激48 h可以使系膜细胞CTGF和FN mRNA升高(P<0.05),分别是LG组的2.31和3.42倍;与 HG 组相比,HG+Flu组 CTGF和FN mRNA的表达明显降低(P<0.05),分别降低了34%和55%。见表3、图3。
表1 不同刺激时间对4组大鼠肾脏系膜细胞增殖的影响(±s)

表1 不同刺激时间对4组大鼠肾脏系膜细胞增殖的影响(±s)
注:LG组,加入 5.5 mmol/L葡萄糖;LG+M组,加入5.5 mmol/L葡萄糖 +24.5 mmol/L 甘露醇;HG 组,加入30 mmol/L葡萄糖;HG+Flu组,加入30 mmol/L葡萄糖 +10μmol/L氟伐他汀。与 LG+M 组比较,a P<0.05,b P<0.01;与HG组比较,c P<0.05
12 h 24 h 48 h LG组组别 孔数 A值6 0.281 ±0.018 0.312 ±0.027 0.456 ±0.031 LG+M 组 6 0.267 ±0.019 0.337 ±0.030 0.473 ±0.021 HG 组 6 0.364 ±0.016a 0.481 ±0.057b 0.692 ±0.043b HG+Flu组 6 0.295 ±0.015c 0.354 ±0.043c 0.469 ±0.037c
表2 不同浓度氟伐他汀对4组大鼠肾脏系膜细胞增殖的影响(±s)

表2 不同浓度氟伐他汀对4组大鼠肾脏系膜细胞增殖的影响(±s)
注:HG组,加入30 mmol/L葡萄糖;HG+Flu组,加入30 mmol/L葡萄糖+氟伐他汀。与HG组比较,b P<0.01
组别 Flu浓度(μmol/L) 孔数 A值HG组6 0.350 ±0.023 HG+Flu 组 1 6 0.227 ±0.026b 10 6 0.174 ±0.018b 20 6 0.136 ±0.015-b
表3 4组大鼠肾脏系膜细胞中CTGF、FN mRNA的表达(±s)

表3 4组大鼠肾脏系膜细胞中CTGF、FN mRNA的表达(±s)
注:CTGF:结缔组织生长因子;FN:纤维粘连蛋白;LG组,加入5.5 mmol/L葡萄糖;LG+M组,加入5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇;HG组,加入30 mmol/L葡萄糖;HG+Flu组,加入30 mmol/L葡萄糖+10μmol/L氟伐他汀。与 LG+M 组比较,a P <0.05;与 HG 组比较,c P <0.05
组别 孔数CTGF FN LG组6 0.328 ±0.015 0.417 ±0.013 LG+M 组 6 0.321 ±0.011 0.415 ±0.015 HG 组 6 0.867 ±0.035a 0.953 ±0.025a HG+Flu 组 6 0.625 ±0.018c 0.641 ±0.024c
2.4 Western印迹检测结果 LG组与LG+M组差异无统计学意义(P>0.05);与LG+M组相比,高糖组p-p38 MAPK和 p-CREB1表达上调(P<0.01)。HG+Flu组p-p38 MAPK和p-CREB1表达下调(P<0.01)。见图4、表4。

图3 4组大鼠肾脏系膜细胞结缔组织生长因子和纤维粘连蛋白RT-PCR结果

图4 4组大鼠肾脏系膜细胞中p38 MAPK、CREB1蛋白的表达
表4 4组大鼠肾脏系膜细胞中p38 MAPK,CREB1蛋白的表达(±s)
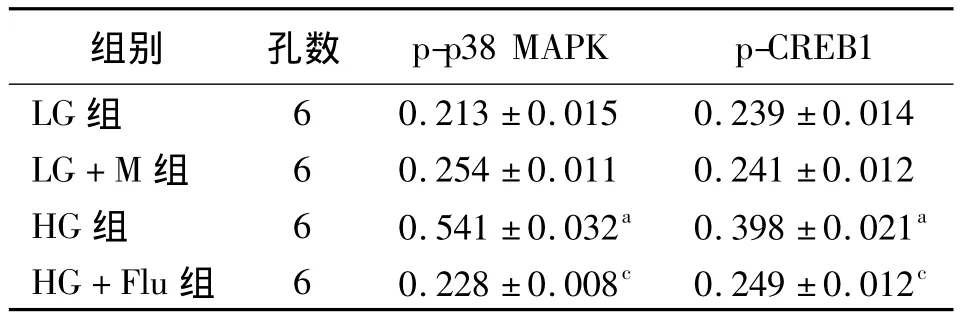
表4 4组大鼠肾脏系膜细胞中p38 MAPK,CREB1蛋白的表达(±s)
注:LG组,加入 5.5 mmol/L葡萄糖;LG+M组,加入5.5 mmol/L葡萄糖 +24.5 mmol/L 甘露醇;HG 组,加入30 mmol/L葡萄糖;HG+Flu组,加入30 mmol/L葡萄糖+10μmol/L氟伐他汀。与 LG+M组比较,a P<0.05;与 HG组比较,c P <0.05
组别 孔数p-p38 MAPK p-CREB1 LG组6 0.213 ±0.015 0.239 ±0.014 LG+M 组 6 0.254 ±0.011 0.241 ±0.012 HG 组 6 0.541 ±0.032a 0.398 ±0.021a HG+Flu 组 6 0.228 ±0.008c 0.249 ±0.012c
3 讨论
Statins是临床上常用的降脂药物,通过阻断细胞内甲羟戊酸代谢途径,使细胞胆固醇和多种非甾醇异戊二烯产物的生成减少,从而降低胆固醇的产生。但是,近年来Statins非依赖降脂的肾脏保护作用得到人们的关注。主要表现在可以有效减轻肾脏细胞增殖肥大和细胞外基质(extra cellular matrix,ECM)的积聚,减轻尿蛋白排泄量[8]。系膜细胞作为肾小球内最活跃的固有细胞,能够产生ECM、分泌细胞因子、吞噬和清除异物等多种功能,其功能异常与多种肾脏疾病的发生、发展有关。体外实验结果表明,Statins可以抑制系膜细胞增殖,阻断系膜细胞分泌ECM[9]。本实验结果也表明氟伐他汀可以明显抑制高糖作用48 h时FN分泌和mRNA的表达,可抑制高糖培养下系膜细胞分泌ECM。这与文献报道一致[10-11]。本研究特意设立LG+M组,其渗透压与HG组基本一致,进一步除外高糖导致的高渗透压对系膜细胞的影响。
CTGF是由349个氨基酸组成的相对分子质量为34 000~38 000的富含半胱氨酸的分泌肽,被视为TGF-β1/Smad通路中的下游效应介质[12]。有研究表明,statins能够减轻系膜细胞ECM的分泌,可能与其能够减轻TGF-β1的表达有关[13]。在CTGF启动子序列128~162位置上存在着一个重要的TGF-β1调控元件,TGF-β1通过调控CTGF启动子内TGF-β1反应元件和Smad结合元件诱导CTGF的产生,在病理情况下,可诱发及增加Ⅰ型胶原等的合成,使ECM合成增加,从而导致纤维化[14]。本研究表明,高糖可以引起系膜细胞CTGF mRNA表达的升高,CTGFmRNA表达的增加,正是系膜细胞分泌ECM增多的原因之一,从而引起糖尿病肾小球的硬化。而氟伐他汀则能够抑制高糖刺激下系膜细胞中促纤维化因子CTGF和FN mRNA的表达,提示氟伐他汀抑制系膜细胞ECM的分泌可能是通过抑制CTGF的表达来实现的。
p38 MAPK途径是近年来倍受关注的一条细胞内重要的信号转导途径,高糖刺激使之活化后可以激活多种核转录因子,影响目的基因的表达[15]。有研究认为,无论在糖尿病肾病的早期还是发展阶段,p38 MAPK可能均发挥重要作用[16],影响TGF-β因子的合成[17],促进系膜细胞及肾小管细胞的凋亡等[18]。本实验结果显示高浓度葡萄糖能够激活肾小球系膜细胞p38 MAPK和CREB1,使其磷酸化水平明显增高,进一步提示p38 MAPK信号途径可能参与了糖尿病肾病的发病过程。但氟伐他汀可以明显阻断系膜细胞p38 MAPK和CREB1的磷酸化水平。提示氟伐他汀能够阻断高糖状态下系膜细胞CTGFmRNA的表达,可能是通过阻断p38 MAPK信号转导途径,降低CTGF的表达,从而降低FN的表达来实现的。此外有研究表明,FN作为ECM的主要成分之一,同时又是CREB的作用底物,其启动子在其序列的170 bp含有CRE,所以激活后的CREB可以结合在这个CRE上,导致FN mRNA表达增强[19]。氟伐他汀阻断 p38 MAPK及其下游因子CREB1后,可以有效阻断FN的合成。
综上所述,氟伐他汀能够产生肾脏保护作用,而这种作用可能是通过抑制p38 MAPK信号途径的激活,进一步抑制CTGF过度表达,减少细胞外基质蛋白的生成,调节细胞的增殖状态,从而产生明显的肾脏保护作用。
[1] Dai H Y,Zheng M,Lv L L,et al.The roles of connective tissue growth factor and integrin-linked kinase in high glucose-induced phenotypic alterations of podocytes[J].J Cell Biochem,2012,113(1):293-301.
[2] 张景云,张秋梅,于德民,等.结缔组织生长因子在糖尿病肾病发生发展中的作用[J].中国医药,2011,6(9):1070-1074.
[3] 杨爱婷,王萍,刘天会,等.外源性和内源性结缔组织生长因子对大鼠肝脏前体细胞分化的影响[J].首都医科大学学报,2010,31(3):293-298.
[4] 于海,周春华.结缔组织生长因子siRNA抑制高糖诱导的大鼠系膜细胞合成结缔组织生长因子及Ⅰ型胶原的表达[J].中国医药,2010,5(2):125-127.
[5] Fang Y,Tian X,Bai S,et al.Autologous transplantation of adipose-derived mesenchymal stem cells ameliorates streptozotocin-induced diabetic nephropathy in rats by inhibiting oxidative stress,pro-inflammatory cytokines and the p38 MAPK signaling pathway[J].Int JMol Med,2012,30(1):85-92.
[6] 王丽晖,段惠军,史永红,等.洛伐他汀对糖尿病大鼠肾功能及肾脏组织p38丝裂原激活蛋白激酶表达的影响[J].中国危重病急救医学,2004,16(12):734-737.
[7] 杨霞,孙兆林,袁静,等.洛伐他汀联合厄贝沙坦对梗阻性肾病大鼠骨桥蛋白及肾间质纤维化的影响[J].中国当代医药,2013,20(18):9-11.
[8] Gao P,Wu X,Shui H,et al.Fluvastatin inhibits high glucose-induced nuclear factor kappa B activation in renal tubular epithelial cells[J].JNephrol,2013,26(2):289-296.
[9] Fang D,Guan H,Liu J,et al.Early intensive insulin therapy attenuates the p38 pathway in the renal cortex and indices of nephropathy in diabetic rats[J].Endocr J,2012,59(1):81-90.
[10]Usui H,Shikata K,Matsuda M,etal.HMG-CoA reductase inhibitor ameliorates diabetic nephropathy by its pleiotropic effects in rats[J].Nephrol Dial Transplant,2003,18(2):265-272.
[11]Song Y,Li C,Cai L.Fluvastatin prevents nephropathy likely through suppression of connective tissue growth factor-mediated extracellular matrix accumulation[J].Exp Mol Pathol,2004,76(1):66-75.
[12] Tossidou I,Starker G,Kruger J,etal.PKC-alphamodulates TGF-beta signaling impairs podocyte survival[J].Cell Physiol Biochem,2009,24(5-6):627-634.
[13] Kim S I,Han D C,Lee H B,et al.Lovastatin inhibits transforming growth factor-beta 1 expression in diabetic rat glomeruli and cultured rat mesangial cells[J].JAm Soc Nephrol,2000,11(1):80-87.
[14] Tall E G,Bernstein A M,Oliver N.TGF-β-stimulated CTGF production enhanced by collagen and associated with biogenesis of a novel 31kDa CTGF form in human corneal fibroblasts[J].Invest Ophthamlol Vis Sci,2010,51(10):5002-5011.
[15] Ma J,Phillips L,Wang Y,etal.Curcumin activates the p38 MPAK-HSP25 pathway in vitro but fails to attenuate diabetic nephropathy in DBA2J mice despite urinary clearance documented by HPLC[J].BMC Complement Altern Med,2010,12(10):50-67.
[16]Komers R,Lindsley JN,Oyama T T.Renal p38 MAPK kinase activity in experimental diabetes[J].Lab Invest,2007,87(6):548-558.
[17] Lim A K,Nikolic-Paterson D J,Ma F Y,et al.Role of MKK3-p38 MAPK signalling in the developmentof type 2 diabetes and renal injury in obese db/dbmice[J].Diabetologia,2009,52(2):347-358.
[18] Rane M J,Song Y,Jin S,et al.Interpl ay between AKt and p38 MAPK pathways in the regulation of renal tubular cell apoptosis associated with diabetic nephropathy[J].AM JPhysiol,2010,298(1):49-61.
[19] Barros E P,Garcia-Pinto A B,Machado P Y,et al.J Rosuvastatin beneficially alters the glomerular structure of kidneys from spontaneously hypertensive rats(SHRs)[J].Mol Histol,2011,42(4):323-331.
Effect and Functional Mechanisms of Fluvastatin on the Expressions of Connective Tissue Growth Factor m RNA in G lomerular Mesangial Cells Cultivated with High Concentration of Glucose in Rats
WANG Li-hui,WU Guang-li,ZHANG Li-xia,LISai,HUANG Xu-dong(Department of Nephrology,Bethune International Peace Hospital of PLA,Shijiazhuang 050082,China)
ObjectiveTo investigate the effectand functionalmechanisms of Fluvastatin on the expression of connective tissue growth factor(CTGF)mRNA and the activation of p38mitogen-activated protein Kinase(p38 MAPK)and cAMP response element-bingding protein1(CREB1)in glomerularmesangial cells cultivated with high concentration of glucose in rats.MethodsGlomerularmesangial cells in Wistar rats were cultured in vitro and divided into four groups:low glucose group(group LG,5.5mmol/L glucose),low glucosewithmannitol group(group LG+M,5.5mmol/L glucose+24.5mmol/Lmannitol),high glucose group(group HG,30mmol/L glucose)and high glucose with Fluvastatin group(group HG+Flu,30mmol/L glucose+10μmol/LFluvastatin).Expressions of mRNA in CTGFand fibronectin(FN)were detected by reverse transcription and polymerase chain reaction(RT-PCR).Expressions of phosphorylated p38(p-p38)mitogen activated protein kinase(MAPK)and p-CREB1 were detected by Western blotting.ResultsThe intercapillary cellmultiplication and expressions of p-p38MAPK,p-CREB1 andmRNA of CTGF and FN were significantly increased in group HG,compared with those in group LG+M.The intercapillary cellmultiplication could be inhibited,and expressions of p-p38 MAPK ,p-CREB1 and mRNA of CTGFand FN were significantly lower in group HG+Flu,compared with those in group HG.ConclusionThe expressions of CTGFmRNA,p-p38MAPK and p-CREB1may be significantly increased in glomerularmesangial cellsunder high concentration of glucose,and Fluvastatin can inhibit production of CTGF and extracellularmatrix(ECM)proteins partly by regulating the phosphorylation of p38MAPK and CREB1.
Mesangial cell;Hydroxymethylglutaryl-coA reductase inhibitors;Connective tissue growth factor;p38 mitogen activated protein kinase;cAMP response element- bingding protein1;Fluvatatin;Rat,wistar
R-332;R963
A
2095-140X(2013)12-0057-05
10.3969/j.issn.2095-140X.2013.12.015
河北省科技攻关计划课题资助项目(072761188)
050082石家庄,解放军白求恩国际和平医院肾脏病科
2013-08-19 修回时间:2013-09-24)

