浸泡及萌发条件对大豆富硒作用的影响
郑传进,吴小勇,*,杨 洋,曾祥珊
(1.广东药学院食品科学学院,广东中山528458; 2.广州市来利洪饼业有限公司,广东广州510470)
硒是人体必需的微量元素之一,存在于所有细胞、组织及器官中。硒在人体发挥抗氧化、增强免疫能力等多种重要的生物学功能[1-2]。缺硒将导致人体罹患多种疾病,包括癌症、心血管病、肝病、哮喘、白内障、胰脏疾病、糖尿病、生殖系统疾病、儿童发育不良等。越来越多的证据表明,改善硒的摄入状况,对居民长远的健康有益,特别是可以降低居民罹患癌症的风险[3]。上世纪90年代初,在我国进行的基于临床的流行病学研究结果也表明,每天补充50~200μg的硒,可以降低肝癌及食道癌的风险[3]。因此,适当的硒补充对于维护人体健康是非常重要的。人体内的硒主要是有机态硒,无机态硒对人体有一定的毒副作用;因此,补硒首选有机硒。利用生物本身对无机硒的富集和转化能力,将无机硒转化成有机硒,是制备有机硒产品有效途径,如利用含无机硒培养基发酵灰树花,培养红发夫酵母或食用菌等途径实现硒的转化和富集[4-6]。有研究表明,大豆硒蛋白能显著增强小鼠抗疲劳能力[7],增加小鼠体内抗氧化酶的活力、促进免疫器官发育、抑制肿瘤生长,且无任何毒副作用[8],是一种品质优良的硒补充剂。本研究以亚硒酸钠为硒源,以大豆为富硒载体,通过浸泡和萌发过程,实现大豆对硒元素的富集和生物转化,制备得到富硒大豆;然后通过碱提酸沉工艺从富硒大豆中分离出富硒大豆蛋白。本文的研究结果将为富硒大豆及大豆硒蛋白的工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
东北大豆 购于市场,选择颗粒饱满、无虫蛀、无霉烂者进行实验;亚硒酸钠 先导(清远)稀有金属有限公司产品,纯度大于99%;硒标准 光谱纯,A Johnson matthey company产品;其他化学试剂 均为分析纯。
FA2004N型电子天平 上海精科;AFS-920双道原子荧光光度计 北京吉天仪器有限公司。
1.2 实验方法
1.2.1 大豆富硒工艺流程 参照文献[9],对大豆进行富硒处理:大豆→冲洗→浸泡→萌发
1.2.2 浸泡温度对富硒大豆萌发和生长的影响 取5份重100g的大豆,冲洗干净后分别置于500m L烧杯中,用300m L浓度为30μg/m L的亚硒酸钠溶液浸泡,恒温培养箱控制浸泡环境温度分别为20、25、30、35、40℃,浸泡时间均为7h;浸泡后取出,沥干水分,称重,根据浸泡前后重量的差别,计算出各自的吸水率;然后将浸泡好的大豆置于25℃的恒温、高湿环境(恒温水浴箱)中萌发24h;再分别计算出各样品的萌发率和芽长;比较浸泡温度对大豆吸水率、萌芽率及芽长的影响,以确定对大豆富硒作用最有利的浸泡温度。
1.2.3 浸泡时间对富硒大豆萌发和生长的影响 操作方法同1.2.2,固定浸泡温度(30℃)和浸泡液中亚硒酸钠的浓度(30μg/m L),改变浸泡时间(分别为5、6、7、8、9h),通过比较经过处理后的大豆之吸水率、萌芽率、芽长,确定大豆富硒的最佳浸泡时间。
1.2.4 亚硒酸钠浓度对富硒大豆萌发和生长的影响
操作方法同1.2.2,固定浸泡温度(30℃)和浸泡时间(8h),改变浸泡液中亚硒酸钠的浓度(分别为20、30、40、50、60μg/m L),通过比较大豆吸水率、萌芽率、芽长,确定大豆富硒的最佳亚硒酸钠溶液浓度。
1.2.5 正交实验 采用L9(34)正交设计,以富硒大豆的蛋白硒含量为指标,进行正交实验,对大豆的富硒工艺条件进行优化。
1.2.6 大豆吸水率、萌发率、芽长的测定 大豆经过浸泡后取出,沥干水分称重,浸泡前后大豆重量的差别,即为大豆的吸水量,大豆吸水量与原料大豆重量的比值即为大豆的吸水率(%)。
萌发率是指经过浸泡、萌发处理后,样品中萌发的大豆数量占样品中大豆总数的百分比。萌发率的测定方法为,从每份萌发好的大豆样品中随机取出3份小样,每份小样的大豆总数在30~50粒之间,计数每份小样中萌发与不萌发的大豆数,即可计算该份小样的萌发率,然后用3份小样萌发率的平均值来代表整份大豆样品的萌发率。大豆是否萌发的判定标准为伸出大豆种皮的胚根长度大于1mm。
芽长的测定为,从每份萌发好的大豆样品中随机取出3份小样,每份小样的大豆总数在10~20粒之间,用直尺量出小样中每粒大豆伸出种皮的胚根的长度(小于1mm的计为0),全部长度之和除以大豆的粒数,即为这份小样的芽长,然后用3份小样芽长的平均值来代表整份大豆样品的芽长。
1.2.7 富硒大豆总硒含量的测定 参照国标GB/T 5009.93-2003食品中硒的测定[10],采用氢化物原子荧光光谱法。
1.2.8 富硒大豆蛋白的制备 采用碱提酸沉工艺提取蛋白质,通过透析的方法除去无机盐。具体操作如下:称取一定量的富硒大豆,加10倍蒸馏水匀浆,用4%的NaOH溶液将匀浆调至pH10,搅拌20min,然后4000r/min离心10m in,取上清液,用1mol/L的HCl溶液调至pH4.6,然后4000 r/m in离心10m in,取沉淀,用蒸馏水分散,再装入截留分子量为3500的透析袋中,置于4~6℃蒸馏水中透析24h,其间每6h换一次蒸馏水,以除去可能残留于蛋白质中的硒盐及其他无机盐,然后取出透析袋内沉淀,冷冻干燥,即制得富硒大豆蛋白。
2 结果与讨论
2.1 浸泡温度对富硒大豆萌发和生长的影响
种子的吸水主要是吸胀吸水。吸胀吸水与温度有关,在一定温度范围内,种子吸胀吸水能力随温度升高而增强,即在一定的时间内,种子的吸水率随温度升高而升高。浸泡温度对大豆吸水率的影响见表1。结果表明,在20~35℃这一温度范围内,大豆的吸水率随温度升高而升高;但当浸泡温度为40℃时,吸水率反而比30和35℃时低,说明浸泡温度过高对大豆种子的吸水有负面影响。
浸泡温度过高也不利于种子的萌发和生长,表1中的数据表明,在20~30℃这一温度范围内,大豆的萌发率和芽长随温度升高而升高;但当浸泡温度超过30℃后,大豆的萌发率和芽长逐渐下降。萌发率和芽长是衡量大豆生长,进而衡量其富硒能力的关键指标。从本研究的结果来看,在30℃时,富硒大豆的吸水率为129.43%,与35℃时的吸水率相差不大,而萌发率为84.29%,芽长为1.19cm,均比其他温度要高;因此,可以确定,在本研究中大豆富硒的最佳浸泡温度为30℃。
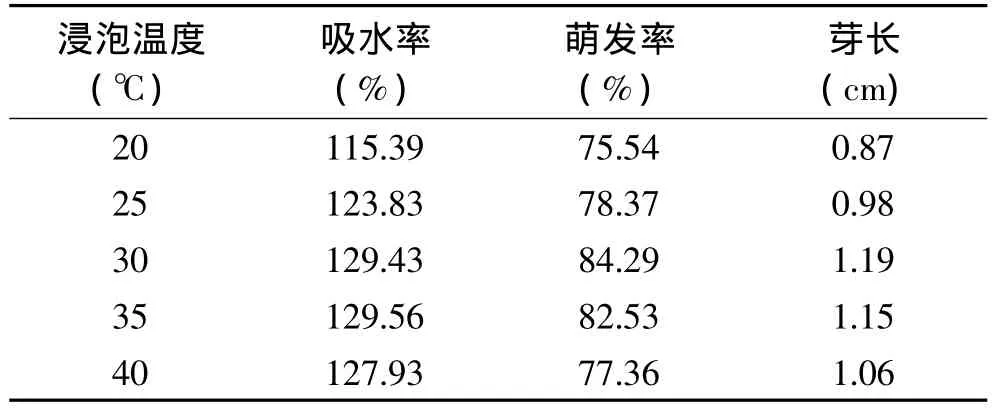
表1 浸泡温度对富硒大豆吸水率、萌发率及芽长的影响Table1 Relationship between soaking temperature and water absorption,germination rate,sprout length of selenium enriched soybean
2.2 浸泡时间对富硒大豆萌发和生长的影响
在温度一定,其他条件相同时,大豆在浸泡过程中对水及水中亚硒酸钠的吸收主要取决于浸泡时间。本文研究了不同的浸泡时间对大豆富硒作用的影响,结果见表2。由表2可以看出,当浸泡时间在8h以内时,富硒大豆的吸水率、萌发率、芽长均随浸泡时间的延长而升高;但当浸泡时间超过8h以后,除吸水率略有升高外,萌发率、芽长量反而有所下降;因此,可以确定最佳的浸泡时间为8h。
2.3 亚硒酸钠浓度对富硒大豆萌发和生长的影响
亚硒酸钠是一种无机硒盐,若在浸泡液中的浓度太高,则会对大豆种子有一定的毒副作用,影响其吸水和萌发,不利于大豆的富硒作用。在确定了大豆富硒作用的最佳浸泡温度、浸泡时间后,本文进一步研究了浸泡液中亚硒酸钠浓度对大豆富硒作用的影响,结果见表3。从表3可以看出,在20~60μg/m L的浓度范围内,除芽长外,富硒大豆的吸水率、萌发率都随亚硒酸钠浓度的升高而升高,且生长状况均比较好,说明浸泡液中亚硒酸钠的浓度还可以进一步升高。
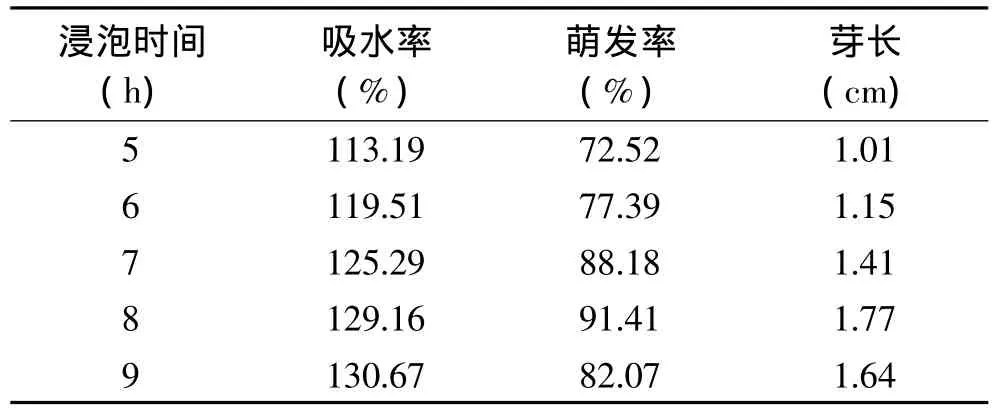
表2 浸泡时间对富硒大豆吸水率、萌发率及芽长的影响Table2 Relationship between soaking time and water absorption,germination rate,sprout length of selenium enriched soybean
为探索大豆种子能够耐受的亚硒酸钠浓度的范围,本研究进一步采用浓度分别为50、100、150、200、250μg/m L的亚硒酸钠溶液浸泡大豆,进行大豆富硒实验,实验结果见表4。结果表明,当浸泡液中亚硒酸钠浓度大于100μg/m L时,大豆的萌发和生长明显受到抑制,但浓度在50~100μg/m L范围内时,大豆的吸水和萌发都还比较好,因此决定采用正交实验来确定亚硒酸钠最佳浓度。
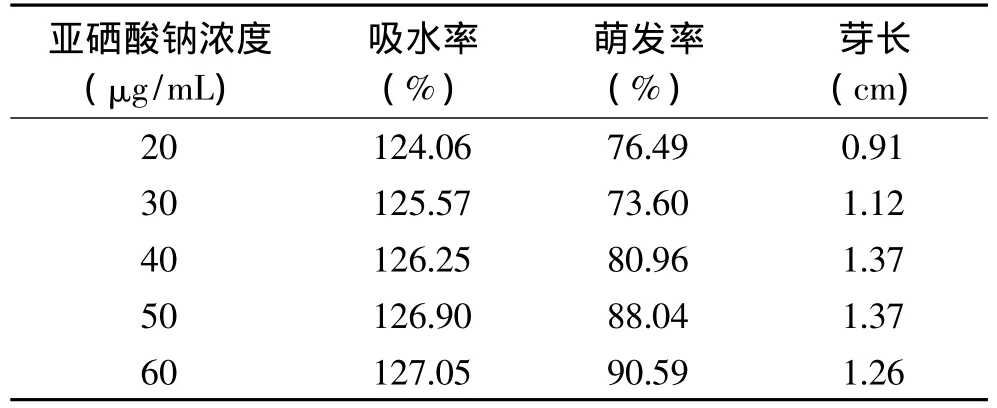
表3 亚硒酸钠浓度对富硒大豆吸水率、萌发率、芽长的影响Table3 Relationship between Na2 SeO3 concentration and water absorption,germination rate,sprout length of selenium enriched soybean

表4 亚硒酸钠浓度对富硒大豆吸水率、萌发率及芽长的影响Table4 Relationship between Na2 SeO3 concentration and water absorption,germination rate,sprout length of selenium enriched soybean
2.4 正交实验结果
浸泡是大豆富硒过程的第一步,通过浸泡,大豆种子充分吸水,其中的营养物质由凝胶态转变成溶胶态,为种子萌发过程中必需的各生物化学反应的发生创造条件;此外,在吸水的同时,浸泡液中的亚硒酸钠会通过各种途径进入大豆中,与大豆中的成分形成物理或化学结合。萌发是大豆富硒过程的第二步,萌发过程中有大量的生物化学反应发生,包括大分子物质的分解和合成。萌发阶段是无机硒转化成有机硒的主要阶段。根据前期研究所掌握的信息,作者选择萌发温度、萌发时间、浸泡液亚硒酸钠浓度这三个因素及各自相应的水平设计正交实验,以大豆蛋白硒含量为主要指标,对萌发条件进行优化,直观分析结果见表5,由表5可知,影响富硒大豆蛋白硒含量的因素主次顺序为C>B>A,即亚硒酸钠浓度>萌发时间>萌发温度,富硒工艺条件理论最佳实验组合为A2B2C3,方差分析结果(表6)表明,在考察的3种因素中,亚硒酸钠的浓度对富硒大豆中蛋白硒含量影响达显著水平,而萌发温度和萌发时间对富硒水平影响不大。综合分析结果和实际最佳实验组合(同理论最佳),得出大豆富硒的最佳工艺为:亚硒酸钠浓度80μg/m L,萌发时间36h,萌发温度25℃,在此条件下,得到的富硒大豆其蛋白的硒含量高达31.95μg/g。

表5 正交实验结果Table5 Results of orthogonal test

表6 正交实验结果方差分析表Table6 Variance analysis of orthogonal experimental result
3 结论
大豆种子发芽过程具有较强的富硒能力[11]。浸泡是种子发芽过程的重要一环,通过浸泡,大豆种子在吸水的同时,会吸收溶解在水中的亚硒酸钠。种子的萌发过程有大量的物质分解和合成,是种子中的硒由无机态转变成有机态的关键阶段。浸泡和萌发条件的控制对大豆的富硒能力有较大的影响。吸水率是衡量种子浸泡程度的主要指标,萌发率和芽长是衡量种子萌发状况的关键指标。本研究以吸水率、萌发率、芽长为主要指标,通过单因素实验初步确定了大豆浸泡的最佳温度、时间及亚硒酸钠浓度;然后以富硒大豆硒蛋白含量为指标,通过正交实验对大豆的富硒工艺条件进行优化,得到大豆富硒的最佳工艺条件为:浸泡温度30℃,浸泡时间8h,浸泡液中亚硒酸钠浓度80μg/m L,萌发温度25℃,萌发时间36h;并制备得到总硒含量为27.31μg/g的富硒大豆,及硒含量高达31.95μg/g的富硒大豆蛋白。况冲等以黄豆芽为富硒载体,制备出富硒黄豆芽并分离出富硒量为21.23μg/g的富硒大豆蛋白[12]。本研究制备得到的富硒大豆蛋白的硒含量,高于上述文献报道。本文的研究结果将为富硒大豆及富硒大豆蛋白的工业化生产奠定基础。
[1]廖明,吴蕴棠,孙忠,等.硒对氧化损伤大鼠肝细胞凋亡的影响[J].营养学报,2010,32(5):466-469.
[2]肖颜颜,王晓洁,戴小曼,等.富硒大麦苗对小鼠免疫功能的调节[J].食品科学,2009,30(23):401-405.
[3]John Weldon Finley.Increased intakes of selenium-enriched foodsmay benefithuman health[J].Journal of the Science of Food and Agriculture,2007,87(10):1620-1629.
[4]赵莉,刘伟民,顾慧敏,等.灰树花加硒米糠培养基液态发酵产富硒多糖的研究[J].食品工业科技,2012,33(18): 199-201.
[5]张超,尹礼国,朱文优,等.富硒红发夫酵母补料分批培养研究[J].食品工业科技,2011,32(9):220-222.
[6]王莲芳,窦春霞,张连富,等.富硒食用菌中硒蛋白提取工艺研究[J].食品与发酵工业,2007,33(1):122-126.
[7]刘玉翠,陈英珠,辛春艳.大豆硒蛋白药理作用研究[J].河北省科学院学报,2000,17(3):168-171.
[8]向天勇,吴永尧,陈建英.大豆硒蛋白的生物学功能初探[J].营养学报,2004,26(12):168-171.
[9]吴小勇,王志,王秀霞,等.绿豆富硒工艺研究[J].食品工业科技,2008,29(2):197-198.
[10]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.93-2003,食品中硒的测定[S].北京:中国标准出版社,2004:661-668.
[11]樊翠,张红,杨润强,等.大豆发芽器具硒富集能力[J].食品科学,2011,32(20):17-20.
[12]况冲,郭晓玲,张永忠,等.富硒大豆蛋白的研制[J].食品工业新技术,2008,29(6):192-194.

