超声波、微波对鲑鱼肽结构及抗氧化性的影响
康永锋,康俊霞,吴文惠,史华进
(1.上海海洋大学食品学院,上海201306; 2.上海海洋大学海洋科学研究院,上海201306)
胶原蛋白(collagen)主要存在于动物的结缔组织,被广泛的应用于医药、美容、食品、化工、照相、材料、饲料等行业[1]。由于酶法水解制备多肽条件温和易于控制、专一性强、副产物少、重复性好等优点,被广泛用于肽类的研究中[2-3]。但是酶解反应仅在普通水浴中进行,需要较长的酶解时间,易使蛋白质变性,酶解的效率低。而利用微波或者超声波等物理手段辅助酶解蛋白获得多肽,可以大大缩短酶解时间,提高酶解效率,但是对其作用机理的研究处于起步阶段。2002年Xuejun Pan等[4]通过对微波辅助提取与普通加热回流提取进行比较,发现微波辅助提取不仅可以节约时间而且可以提高提取率。2005年罗昭锋等[5]报道了超声波对牛血清白蛋白结构的影响,发现超声使 BSA严重聚集。2012年 Rohit Upadhyay等[6]研究发现微波辅助提取绿原酸不仅可增加其得率,而且对其超氧阴离子自由基清除能力有影响。2010年Conti等[7]通过红外扫描研究了超声波对细胞结构的影响,发现经超声波处理后被测样品的二级结构发生了变化。不同来源胶原蛋白肽其成分和氨基酸组成不同,对海洋生物来源的胶原肽的研究尚处于初级阶段。对于鲑鱼鱼皮胶原肽(Salmon skin Peptide,SSP)的抗氧化性的研究还未见报道。另外超声波、微波对SSP氨基酸组成及结构的影响还未见报道。本文研究了超声波、微波对SSP抗氧化性的影响,通过紫外、红外光谱扫描及氨基酸组成分析对其结构的变化进行了探讨。为进一步对SSP活性物质研究提供了理论依据,同时为胶原肽改性研究提供参考。
1 材料与方法
1.1 材料与仪器
鲑鱼胶原蛋白(Salmon collagen,SC) 武汉天天好有限公司提供;Tris-HCl上海浩然生物技术有限公司提供;碱性蛋白酶 庞博生物科技有限公司提供;L-色氨酸 上海国药化学试剂有限公司提供;所有其他试剂均为分析纯。
L-8800氨基酸自动分析仪日本日立公司;差示扫描量热仪 美国梅特勒公司;紫外可见分光光度计UV-2450 岛津国际贸易有限公司;红外分光光度计FTIR 1650 美国珀金埃尔默公司;荧光分光光度计970CRT 苏州江东精密仪器有限公司;台式PH计S20 瑞士梅特勒-托利多集团;电脑微波超声波组合催化合成/萃取仪XH-300A 北京祥鹄科技发展有限公司;真空冷冻干燥机FD-80 北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 鲑鱼胶原蛋白热稳定性的测定 使用高灵敏度的差示量热扫描仪(METTLER TOLEDO STARe系统DSC822e),其温度准确性为±0.1℃,量热灵敏度: 0.04mW(FRS5)/0.01mW(HSS7),温度范围:-150~700℃,升温速率:0.01~300℃/m in。使用前用铟进行单点温度校准,纯氮气作为载气,流速50m L/m in。在起始温度为20℃,终止温度为200℃,温度变化率为10℃/m in的条件下进行DSC扫描。
1.2.2 超声波、微波对SSP抗氧化性的影响
1.2.2.1 SSP的制备 用去离子水配制浓度为5mg/m L的鲑鱼胶原蛋白溶液。调节到酶的最适pH8.2,然后分成4份,分别加入碱性蛋白酶,酶解温度45℃,先放入45℃的水浴中酶解5m in,然后放入超声波催化合成/萃取仪中,一份在超声功率100W,41℃超声处理10m in,一份在微波功率500W,41℃条件下微波处理10m in,一份在超声波功率100W,微波功率500W的条件下处理10min。剩下的一份常规加热酶解作为对照。加酶2h后,离心分离,取上清液为抗氧化肽粗品,检测其超氧阴离子自由基的清除率。用冷冻干燥机FD-80将其分别冷冻干燥,作为SSP冻干粉待用。
1.2.2.2 超氧阴离子自由基清除能力的检测 取0.5mol/L Tris-HCl缓冲液(pH8.2)5m L,置于25℃水浴中预热20m in,分别加入1m L配好的样品蛋白溶液5mg/m L再加3.7m L去离子水和0.3m L 3mmol/L邻苯三酚溶液,混匀后于25℃水浴中,以HCl为空白,在327nm下测定其吸光度。

式中:A0为空白的吸光度值,Ai为样品的吸光度值。
1.2.3 超声波、微波对SSP结构的影响
1.2.3.1 SSP紫外光谱特性研究 将制备的SSP冻干粉样品溶解于0.5mol/L醋酸溶液中,分别配制成2g/L溶液,用UV-2450紫外分光光度计进行扫描。测试前先进行基线校正来设定当前选择的波长范围内的背景为零。然后将样品放入1cm石英比色皿中,设定波长间隔为0.5nm,以相应溶剂0.5mol/L醋酸溶液为空白,在200~400nm近紫外光区进行快速扫描测试。
1.2.3.2 SSP红外光谱特性研究 将制备的SSP冻干粉与KBr压片,在500~4000cm-1范围内用FTIR 1650扫描。
1.2.4 SSP氨基酸组成测定
1.2.4.1 SSP水解后氨基酸组成分析 称取制备的SSP冻干粉 0.050g放于 30m L水解管中,加入6.0mol/L的HCl溶液20m L,参照GB/T14965-1994《食品中氨基酸测定方法》[8]进行水解。水解液冷却后移入25m L容量瓶,用去离子水定容后取出2m L于10m L容量瓶中在真空干燥箱中45℃干燥,用0.02mol/L的盐酸溶解定容,用0.20μL的水系微孔滤膜过滤后,供氨基酸自动分析仪测定用。
1.2.4.2 SSP游离氨基酸组成分析 准确称SSP冻干粉0.010g,加入磺基水杨酸去蛋白离心取上清液,用0.02mol/L的盐酸溶解,定容至 50m L,然后用0.20μL的水系微孔滤膜过滤,供氨基酸自动分析仪测定用。
1.2.4.3 SSP水解后色氨酸的测定 配制1mg/m L的色氨酸样本母液,然后稀释为40、0.8、0.48μg/m L系列,各取1m L与样品管在相同条件下,同时水解。水解液冷却后,于10m L容量瓶中,用pH11的4mol/L尿素溶液定容至刻度[9]。扫描方式:灵敏度:1,EX的狭缝宽度:20nm,EM的狭缝宽度:10nm,发射波长EM为360nm,激发波长EX为210~420nm的范围内快速扫描,确定其激发波长。然后再将样本母液逐级稀释为0.8、0.48、0.32、0.16、0.08μg/m L的色氨酸标准系列。测定水解后各色氨酸标准系列的INT值绘制标准曲线,依据标准曲线,测定SSP水解后色氨酸的含量。
2 结果与分析
2.1 胶原蛋白热稳定性的研究
胶原蛋白螺旋的稳定性依赖于分子间和分子内各种作用的协同效应,在某些物理或化学因素作用下,其特定的空间结构容易被破坏,即破坏其三股螺旋的稳定性,从而导致其结构及理化性质的改变。当温度升高到胶原蛋白的热变性温度以上的时候,胶原蛋白吸收能量超过分子间作用力时,分子中的氢键结构发生变形,溶剂水分子作为氢键的受体或供体,与蛋白质分子骨架及侧链上的基团竞争形成氢键,最终导致胶原蛋白三股螺旋链被破坏,使得包埋在胶原蛋白结构内部的疏水性基团暴露出来,易于聚集、变性,胶原蛋白链从伸展的纤维状态转变成无规则卷曲状态[10-11]。
从图1观察,在升温过程中鲑鱼胶原蛋白有两个吸热峰:从47.08℃至52.04℃时,有一个吸热过程热焓发生变化ΔΗ为正,对温度敏感,胶原蛋白发生热变性,其热变性温度为50.5℃。第二个吸热峰位于103.8℃处,这是热变性后的胶原蛋白进一步升温后熔融的温度。在第一次扫描测量结束后将样品迅速冷却至20℃,然后进行再一次扫描,从图1中可以看出重复扫描后并没有出现吸热或放热峰,说明第一次加热扫描后鲑鱼胶原蛋白已经发生了不可逆性热变性[12]。
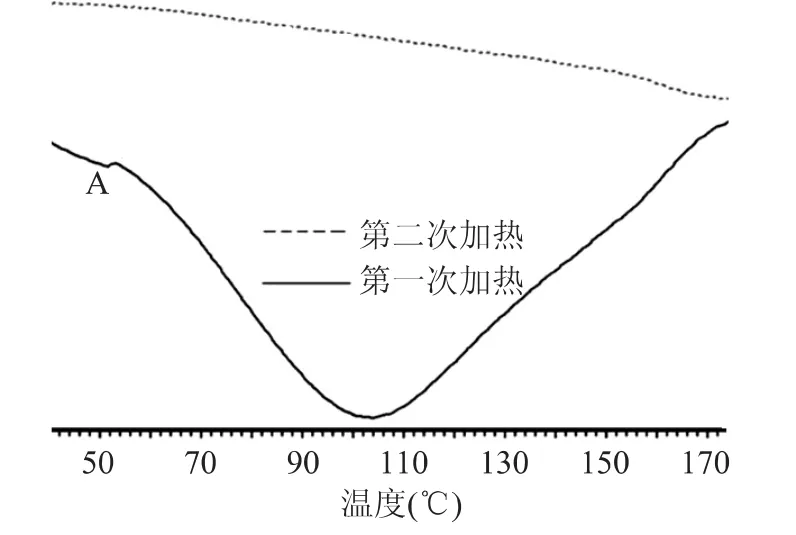
图1 鲑鱼胶原蛋白的DSC曲线Fig.1 The curve of salmon collagen on DSC
2.2 超声波、微波对SSP超氧阴离子自由基清除能力的影响
由图2可知:经超声波、微波处理后,SSP超氧阴离子自由基清除能力分别为57.64%和64.02%,明显高于常规加热处理的酶解液(54.4%)。说明在一定的条件下蛋白酶解液经超声波、微波处理后其超氧阴离子自由基清除能力均有一定程度的提高;这可能是由于微波加热极性物质,加速了分子之间的碰撞,使埋藏在蛋白质内部的基团断裂,降解成更小的肽段,使某些具有抗氧化性的氨基酸暴露使其超氧阴离子自由基清除能力增强[13]。这与崔蕊静等[14]报道的经微波辅助处理后的豆奶加酶水解效果显著提高相一致;而超声波具有空穴效应和热效应使得蛋白质一些活性基团暴露[15],从而使其超氧阴离子自由基清除能力增强[16];由图2知经超声波微波共同辅助处理后,SSP超氧阴离子自由基清除能力达到67.21%,说明在一定的条件下超声波与微波在制备抗氧化肽过程中具有协同效应。
2.3 超声波、微波对SSP结构的影响
为了探讨超声波、微波作用对超氧阴离子自由基清除能力影响的作用机理,对SSP的紫外吸收光谱及红外吸收光谱进行了研究。
2.3.1 SSP的紫外吸收光谱的研究 由图3(a)及(c)可知经微波及超声波-微波共同处理后鲑鱼肽的紫外吸收光谱为230.0nm,与对照组未经超声波、微波处理的SSP的最大吸收波长233.0nm相比均发生了蓝移,这说明了经微波及超声波-微波协同作用后的SSP构象发生了改变。而由图3(b)可知经超声波处理后的SSP的紫外吸收与对照组几乎完全重合。这可能是由于超声波作用引起鲑鱼肽构象的改变是可逆的,是具有时效性的。
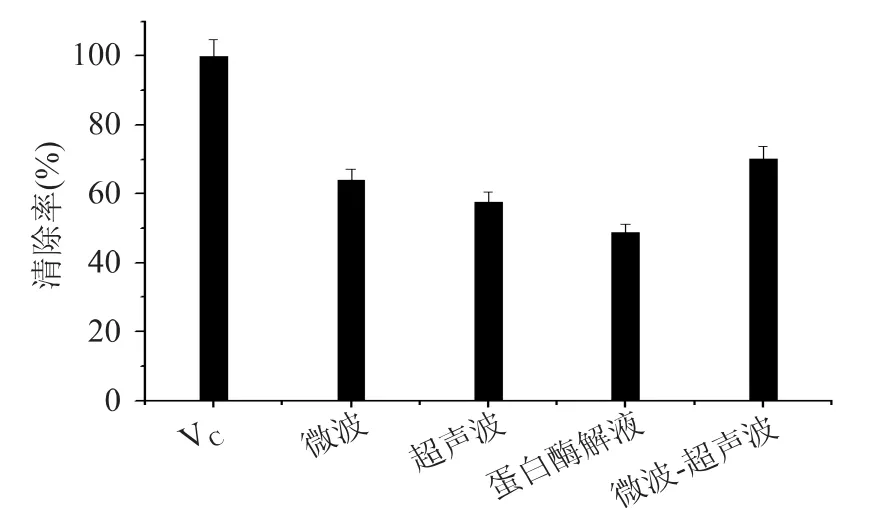
图2 超声波、微波对SSP超氧阴离子自由基清除率的影响Fig.2 Effect of ultrasound and microwave in salmon peptides on the scavenging activity
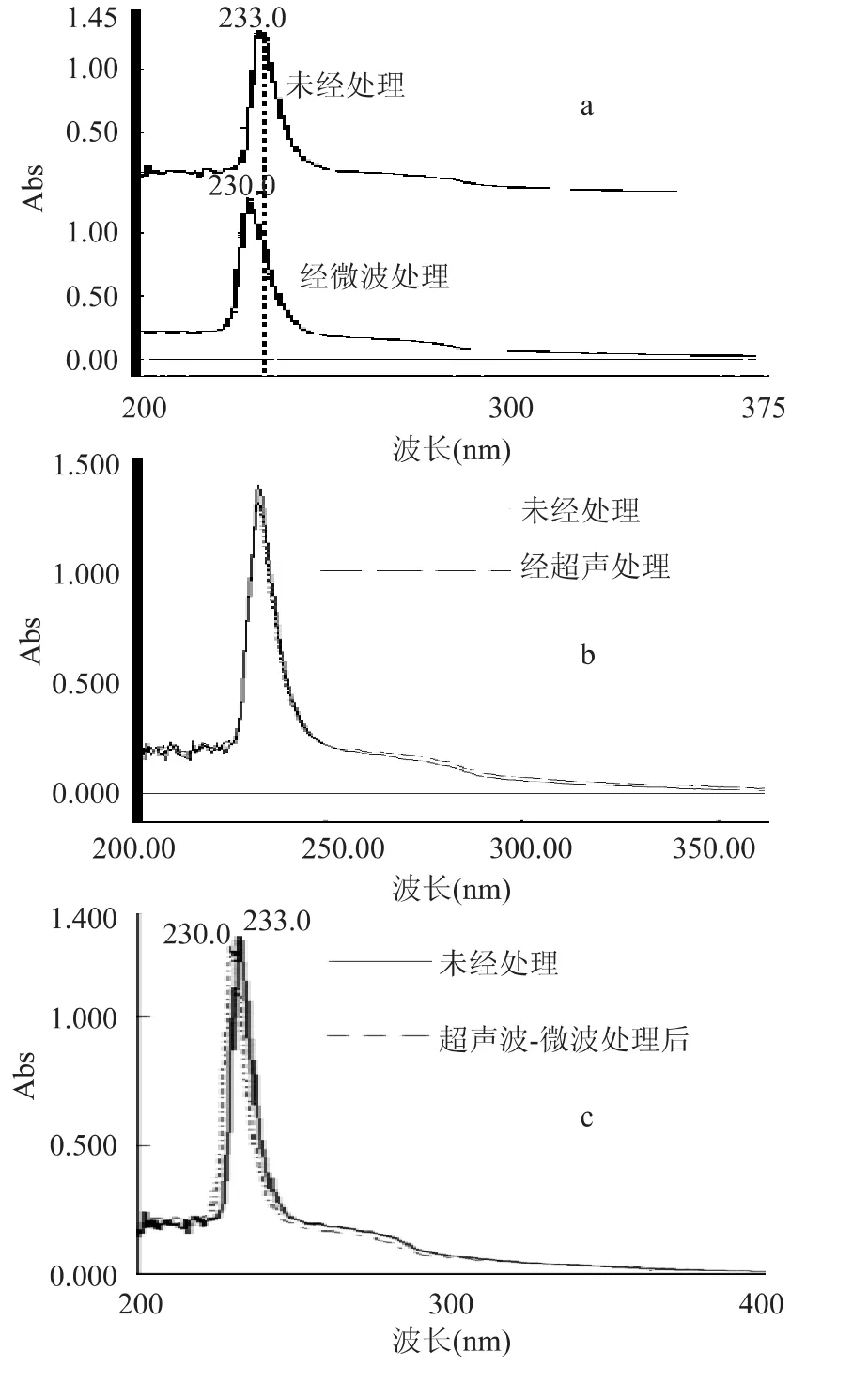
图3 SSP紫外吸收光谱图Fig.3 UV-Vis spectra of SSP
2.3.2 SSP红外吸收光谱的研究 在1700~1600cm-1区域内的红外光谱为蛋白质的酰胺I带,这与其特有的氢键形式密切相关,它反映了蛋白质二级结构的α螺旋、β折叠、无规则卷曲、转角结构等信息。如图4所示:与常规加热酶解制备的SSP相比,经超声波、微波、及超声波-微波共同处理后酶解制备的 SSP,在 1669cm-1处的 C=O伸缩峰,及1544cm-1处的N-H弯曲峰均发生偏移,且峰形变得更为尖锐,可以推测SSP的二级结构经过超声波、微波处理后均发生了变化[7,17]。在 1450~ 1230cm-1附近有吸收峰表明了SSP三股螺旋结构的完整性[18]。

图4 SSP红外吸收光谱图Fig.4 IR spectrum of SSP
2.4 SSP氨基酸组成分析
2.4.1 SSP水解后色氨酸的测定 在发射光谱为(EM)=360nm,在激发光谱为210~420nm的范围内快速扫描,确定其激发波长,如图5所示,其激发波长286.4nm。
在激发波长为286.4nm,发射波长为360nm下测定水解后SSP的荧光强度,根据标准色氨酸的荧光强度曲线,计算样品中色氨酸的质量百分比为0.0938%。

图5 不同浓度的色氨酸的荧光光谱图EM=360nm(在尿素溶液中)Fig.5 Fluorescence spectra of the Trp at different consistence EM=360nm(in urea solution)

图6 水解色氨酸标准曲线Fig.6 Standard curve of hydrolyzed tryptophan
2.4.2 SSP水解后氨基酸分析 抗氧化性氨基酸具有延缓运动性疲劳发生、快速消除运动后疲劳、改善肝功能、防止皮肤老化等功效,具有较高的营养保健功能[21-22]。2003年 Saiga等[23]报道了经不同的酶酶解的猪肌原纤维蛋白,其抗氧化性的差异与其水解后疏水性氨基酸Glu、Asp、Lys的组成有关。2007年Li B等[24]报道了Met、Tyr、Phe和H is四种与自由基清除效果有关的氨基酸。Met和Cys是含硫的氨基酸,其抗氧化保护作用可以通过其自身的抗氧化作用以及合成具有重要抗氧化作用的谷胱甘肽2种途径实现[25]。蛋白质及肽类物质的氨基酸种类、数量及排列顺序共同决定着其抗氧化性能。对SSP水解后游离氨基酸及经过微波、超声波处理后SSP游离氨基酸的测定结果如图7、图8和表1、表2。

图7 SSP的氨基酸分析图谱(吸收波长=570nm)Fig.7 Chromatogram showing the amino acid profiles in SSP(wavelength=570nm)

图8 SSP的脯氨酸分析图谱(吸收波长=440nm)Fig.8 Chromatogram showing the pro in SSP(wavelength=440nm)
由图7、图8及表1知,SSP氨基酸种类齐全,共有18种氨基酸(其中色氨酸通过荧光分光光度计测定),含有8种必需氨基酸,且氨基酸总量较高,为51.10%,其中必需氨基酸的含量为11.21%,可以作为保健品开发利用。
由表1知,抗氧化性氨基酸总量为18.02%:谷氨酸含量最为丰富,为6.45%,其次是疏水性氨基酸Asp、Lys、Leu含量较多,分别为 3.96%、2.17%、1.48%,Met和Cys含硫的氨基酸总量2.84%。由表2知 SSP游离氨基酸量较小,其质量分数仅为9.48%,而其水解后氨基酸总量达到51.10%(表1)。经过微波、超声波、超声波-微波共同处理后,SSP游离氨基酸中与抗氧化相关的氨基酸总量变化不显著。证实了其活性物质为小分子肽类物质,同时结合图2可以推测,SSP经微波、超声波及超声波-微波共同处理后其抗氧化性质的变化主要是影响了SSP肽的组成。

表1 SSP水解后氨基酸组成分析Table1 Composition and contents of amino acids in SSP
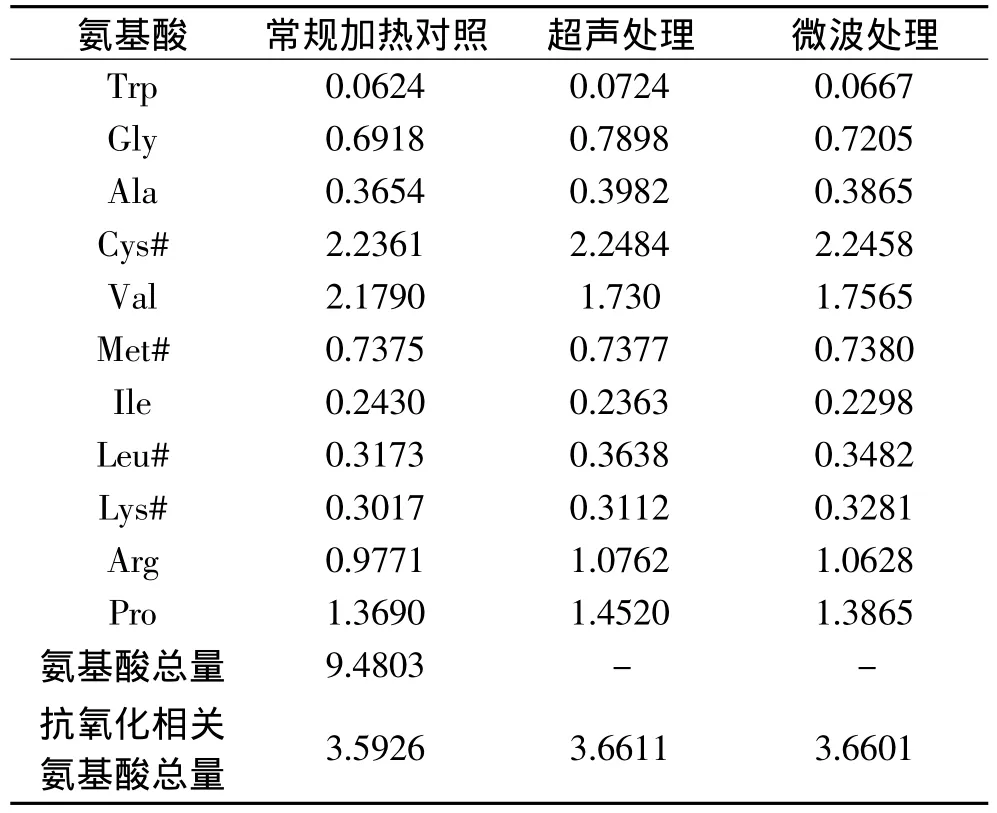
表2 不同处理的SSP游离氨基酸组成分析(%)Table2 Composition and contents of free amino acids in SSP through different treatment(%)
3 结论
在一定条件下鲑鱼胶原蛋白酶解液经超声波、微波处理其超氧阴离子自由基清除能力均得到一定程度的提高。通过紫外与红外等分析方法,发现经微波、超声波-微波共同处理后鲑鱼肽的紫外吸收光谱均发了蓝移,其红外吸收光谱在1669cm-1处C=O伸缩峰,及1544cm-1处的N-H弯曲峰均发生偏移,且峰形变得更为尖锐,可以推测鲑鱼肽的二级结构经过超声波、微波处理后均发生了变化。通过进一步分析鲑鱼肽的氨基酸组成发现:经过微波、超声波及超声波-微波共同处理后,鲑鱼肽游离氨基酸中与抗氧化相关的氨基酸总量变化不显著,证实了其活性物质为小分子肽类物质。
[1]姚理荣,林红,陈宇岳,等.胶原蛋白纤维的性能与应用[J].纺织学报,2006,27(9):106-107.
[2]Junhui Zhang,Hui Zhang,Li Wang,et al.Isolation and identication of antioxidative peptides from rice endosperm protein enzymatic hydrolysate by Consecutive chromatography[J].Food Chemistry,2010,119:226-234.
[3]Qian Liu,Baohua Kong,Youling,et al.Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J].Food Chemistry,2010,118:403-410.
[4]Xuejun Pan,Guoguang Niu,Huizhou Liu.Comparison of microwave-assisted extraction and conventional extraction techniques for the extraction of tanshinones from Salvia miltiorrhiza bunge[J].Biochemical Engineering Journal,2002,12:71-77.
[5]罗昭锋,瞿鑫,沐万孟,等.超声波和高脏处理对牛血清白蛋白结构的影响[J].中国生物工程杂志,2006,26(1):46-49.
[6]Rohit Upadhyay,K Ramalakshmi,L Jagan Mohan Rao.Microwave-assisted extraction of chlorogenic acids from green coffee beans[J].Food Chemistry,2012,130:184-188.
[7]L Contia,P Grimaldia,I Udroiu b,et al.Effects induced in cells by ultrasound revealed by ATR-FTIR spectroscopy[J].Vibrational Spectroscopy,2010,52:79-84.
[8]贾健斌,赵熙和.食物中氨基酸的测定方法中国:GB/ T14965-1994[P].1994-09-01.
[9]中国预防医学科学院营养与食品卫生研究所编.食物营养成分测定法[M].北京:人民卫生出版社,1991:2528.
[10]Takaki K,Daisuke Lh,Shinichi A,et al.Self-complementary peptides for the formation of collagen-like triple helical supramolecules[J].Bioorganic Medicinal Chemistry,2005,23 (15):5230-5233.
[11]李国英,张忠楷,付强,等.胶原的形态分类及其生理机能[J].陕西科技大学学报,2004,22(3):80-82.
[12]Domenico Grasso,Carmelo La Rosa.The effects of scan rate and protein concentration on DSC thermograms of bovine superoxide dismutase[J].Thermochimica Acta,1997,265,163-175.
[13]左继红.微波辅助蛋白酶水解反应工艺和反应器的研究[D].无锡:江南大学,2008.
[14]崔蕊静,杜茂宝,李汉臣,等.微波辅助处理在豆奶酶解技术中的应用研究[J].中国粮油学报,2007,22(4):54-57.
[15]潘牧,姜绍通,孙汉巨,等.醇法菜籽浓缩蛋白的超声波改性研究[J].农业机械学报,2009,40(9):143-147.
[16]刘振家,朱科学,周惠明.超声波辅助酶解脱脂小麦胚芽制备抗氧化肽的研究[J].中国油脂,2009,34(5):38-40.
[17]刘斌,马海乐,李树君,等.应用FTIR研究超声对牛血清白蛋白二级结构的影响[J].光谱学与光谱分析,2010,30(8): 2072-2076.
[18]周玉惠,叶正涛,肖立芳,等.猪皮胶原蛋白的提取及其结构表征[J].湖北大学学报,2008,30(3):287-289.
[19]李晓燕,刘志洪,蔡汝秀,等.荧光光谱PLS法同时测定氨基酸混合物[J].武汉大学学报,2002,48(4):423-426.
[20]许玲.支链氨基酸对大鼠运动力竭后血液中抗氧化系统的影响[J].解放军体育学院学报,2002,21(4):76-78.
[21]梁俊荣,秦巍,庞向龙.营养素的抗疲劳作用[J].山东农业大学学报,2005,36(3):345-347.
[22]Ai Saiga,Soighi Tanbae,Toshihide Nishimura.Antioxidant activity of peptides obtained from porcinemyofibrillar proteins byprotease treatment[J].Food Chemistry,2003,51:3661-3667.
[23]Li B,Chen F,Wang X,et al.Isolation and identification ofantioxidative peptides from Porcine collagen hydrolysate by consecutive chromatography and dectrospray ionization-Mass Spectrometry[J].Food Chemistry,2007,102:l135-l143.
[24]霍湘,王安利,杨建梅.含硫氨基酸的抗氧化作用[J].生物学通报,2006,41(4):3-4.

