经椎弓根内固定手术治疗退行性腰椎侧凸合并椎管狭窄症
官 建 (重庆建设医院骨科,重庆400016)
退行性腰椎侧凸合并椎管狭窄症(degenerative lumbar stenosis with scoliosis,DLSS)常于中老年发病,是指既往无脊柱侧凸病史、发生于骨骼成熟以后继发椎间盘和椎间小关节的非对称性退行性变而出现的脊柱侧凸[1]。退行性脊柱侧凸发病率占老年退行性腰椎疾病的6%左右,其发病机制尚不清楚。本研究回顾分析19 例DLSS 患者的临床资料,通过手术治疗取得了良好的疗效,现报告如下。
1 资料与方法
1.1 临床资料
本组收集2008 年6 月至2012 年6 月我院手术治疗的DLSS患者共19 例,男8 例,女11 例;年龄53 ~ 74 岁,平均62岁;病程4 ~28 年,平均11.1 年。所有患者术前均存在不同程度的下腰痛症状,长时间端坐、行走、劳累后加重,并伴有不同程度的由退行性变和侧凸共同导致腰椎椎管狭窄所致的间歇性跛行症状。单纯腰痛2 例(10.5%),腰痛伴有一侧或双侧下肢症状者17 例(89.5%),所有患者均无会阴部感觉、运动功能障碍。所有患者术前均行腰椎正、侧位X 线片检查,显示均有不同程度的骨质疏松、节段性失稳及退变性滑脱,侧凸Cobb 角12° ~44°,平均(24.32° ±10.52°)。腰椎 CT 及 MRI 示腰椎管狭窄,硬脊膜受压,关节突肥大,椎间盘退行性变,黄韧带肥厚。腰椎管狭窄部位及节段:L4、L5单节段狭窄6 例,L3~L5节段均有狭窄 9 例,L3~ L5、L5、S1节段均有狭窄 4 例。
1.2 手术方法
本组均为后路手术,患者俯卧位。全麻后取腰后正中切口,暴露弯曲脊柱的棘突、椎板、关节突关节,定位双侧椎弓根,插入定位针,常规C 型臂X 线机正侧位透视,调整进针点及方向,根据椎体及椎弓根情况选择合适的螺钉(术前CT 测量椎弓根宽度),双侧植入椎弓根螺钉,3D-C 型臂X 线机透视定位,确定螺钉位置良好,选择有下肢神经症状的一侧或者双侧进行开窗减压或全椎板切除,将切除的骨质打磨成小骨颗粒备用。而后切除增厚的黄韧带。结合患者术前症状及侧凸节段内椎体间稳定程度、椎间盘退行性变及突出情况,对部分患者行椎间盘及上下关节突摘除,扩大神经根管及侧隐窝以对神经根减压。根据固定节段长短,选取适宜长度钛棒,预先折弯呈生理曲度使之与患者的腰椎生理性前凸相符,置入双侧椎弓根钉“U”形槽内。拧入螺母,根据侧凸情况,应用旋棒技术矫正脊柱侧凸及椎体旋转畸形,恢复脊柱生理曲度。根据凹侧撑开、凸侧加压的原则,进一步矫正侧凸畸形,锁紧螺母。生理盐水冲洗视野后,将准备好的小骨颗粒置于各减压节段后外侧关节突间及横突间,放置引流管引流,依次缝合创口。
1.3 术后处理及康复
术后予以抗感染、脱水、激素、补液等对症治疗。术后72 h内或引流量小于50 mL 拔除引流管。术后2 d 开始进行直腿抬高锻炼,常规卧床2 周后下床活动、拆线,出院后佩戴腰围3 个月,鼓励患者行康复锻炼。6 个月内避免中、重体力劳动,避免弯腰负重。术后1、3、6、12 个月定期复查腰椎正侧位和过伸、过屈位X 线平片。
1.4 观测指标及统计学处理
比较患者手术前后及末次随访Cobb 角,采用症状视觉模拟评估表(VAS)、Oswestry 功能障碍指数评分表(ODI)对患者术前和随访时的症状缓解情况和生活质量进行评分。计算ODI评分改善率,改善率=(1 -随访时ODI 分数/术前ODI 分数)×100%。使用SPSS 19.0 软件包对以上数据进行分析。计量资料采用均数±标准差(±s)表示,采用配对t 检验,以P <0.05为差异有统计学意义。
2 结果
本组19 例患者均获随访,随访时间6 ~31 个月,平均13 个月;手术出血量200 ~3 000 mL,平均695 mL;住院时间平均22 d。所有病例术后切口正常愈合,未发生严重并发症或围手术期死亡的病例。出院后随访所有患者,其疼痛有显著缓解,生活质量有明显提高。患者在术前 VAS 评分5 ~8 分,平均(7.14 ±1.04)分;末次随访 VAS 评分 1 ~ 4 分,平均(2.35 ±0.98)分。末次随访时VAS 评分与术前比较,差异有统计学意义(P <0.05)。患者术前 ODI 评分 39.00% ~ 89.00%,平均(63.89 ±11.78)%;末次随访 ODI 评分 12.00% ~ 41.00%,平均(25.54 ±9.72)%。末次随访时 ODI 评分与术前比较,差异有统计学意义(P <0.05)。ODI 评分改善率大于75%为优,50% ~74%为良,25% ~49%为可,小于24%为差。末次随访中,14 例改善率为50% ~84%,优良率为73.68%。相对于术前侧凸的Cobb 角,术后脊柱侧凸Cobb 角有较明显的改善,冠状位 Cobb 角术前、术后、末次随访分别为(24.32° ± 10.52°)、(7.61° ± 5.48°)、(10.56° ± 7.12°)。随访时 Cobb 角与术前Cobb 角比较,差异有统计学意义(P <0.05)。所有患者的融合节段均已骨性愈合,无假关节形成,随访期间矫正角度无明显丢失及内固定断裂,植骨融合率100%。末次随访中亦无融合器移位、内固定松动及折断等情况(图1)。
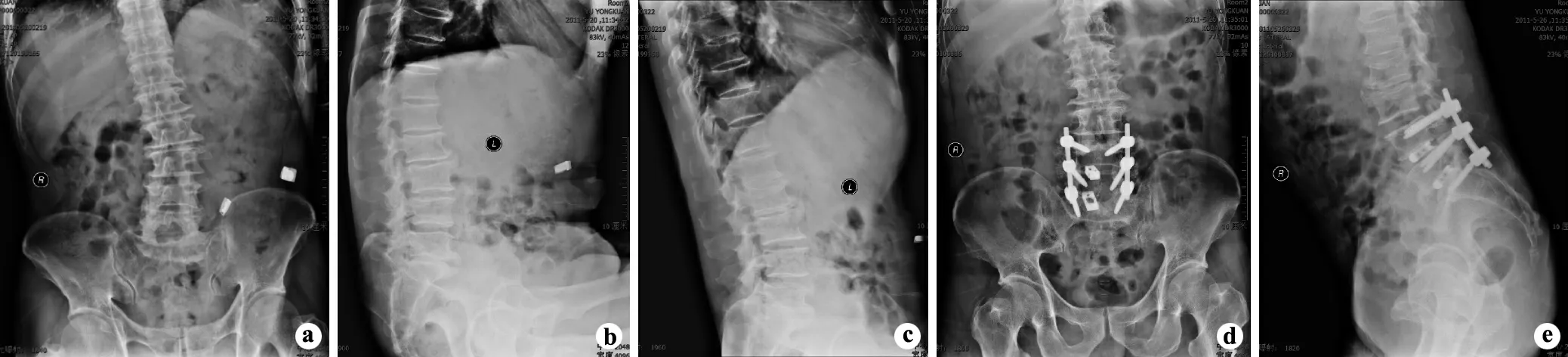
图1 典型病例(61 岁男性)术前、术后影像资料
3 讨论
Robin 等[2]对 554 例 60 岁以上的老年人的追踪随访发现,其中10%无外伤等情况下发生脊柱侧凸,但是结果却认为脊柱侧凸和骨质疏松等退行性变无直接因果关系,并且在老年性的脊柱侧凸较少引起临床症状。侧凸的角度一般是Cobb 角7° ~53°。本组病例,一般表现为节段性的冠状面与矢状面的失平衡,Cobb角在12° ~44°之间,有腰椎管狭窄,硬脊膜受压,关节突肥大,椎间盘退行性变,黄韧带肥厚等影像学表现,而临床症状多表现为单侧神经根性症状,L3和L4神经根常在凹侧受压,而L5和S1神经根受损常位于凸侧,与文献报道的一致[3]。这些症状、体征一般可以从影像学检查中找到原因,当影像学无法解释其症状时,应进一步行肌电图、椎管造影等检查。
李放[4]提出了阶段性治疗腰椎侧凸。张志成等[5]通过117 例患者的5 年随访发现,对于选择何种治疗原则来治疗DLSS,应以个体化、阶梯化的原则。退行性脊柱侧凸的患者治疗上首先以缓解症状为主,并且在适当的情况下尽量选择简单、方便、微创的治疗方法[6]。而针对以下几种情况,可以考虑手术治疗:①脊柱侧凸大于20°;②椎管狭窄严重,需要广泛减压;③合并节段性不稳定;④多个神经根受累,需要多节段切除关节突;⑤运动水平相对较高者。
Reinker 等[7]通过后路减压,用椎弓根系统进行矫正、融合来治疗DLSS 明显消除了93%患者的疼痛,侧凸角度从术前37°矫正到19°。使用多节段椎弓根固定,可以通过对两侧椎弓根螺钉间实施加压或撑开,达到矫正侧凸的目的。行手术治疗的过程中,要注意矫正侧凸的同时也要重视恢复腰椎的生理前凸,不然术后的腰痛症状缓解不佳,并容易导致胸腰段、腰骶段的退行性变加快。
有学者认为单纯椎管减压无内固定治疗LDSS 长期疗效不佳,因为单纯减压本身就是一种医源性的腰椎失稳原因,会导致腰椎更加畸形[8-9]。而前后路联合手术往往给合并较多内科系统疾病的老年患者带来较为严重的创伤,术后恢复较为困难。因此我们主要采用了责任节段的椎板切除及后路的椎间融合,其余矫形节段仅仅行开窗神经根减压、后外侧融合,这样既达到了病损节段的彻底减压,减小创伤,又能使后路器械及椎间融合器得以即刻稳定,提高融合率。
LDSS 手术方案制定中最为重要的就是确定融合节段的范围。其原则要求始于中立椎并终于稳定椎,尽量避免融合的临近节段在矢状面或冠状面上存在倾斜或半脱位等情形,否则很容易引起术后临近节段椎间盘加速退行性变。上固定椎(upper instrumented vertebra,UIV)的确定仍存争论。Kwon 等[10]认为 T10以上椎体由于胸廓保护可视为一个稳定结构,而T11和T12的浮肋结构相对不稳定,长节段上端固定若止于T11或T12容易使得临近节段形成应力集中。Cho 等[11]则指出在退行性侧凸患者中上固定椎不得低于上端椎(upper end vertebra)的位置,只要上固定椎的位置高于上端椎,固定至T11或者T12椎体是可以接受的,至于固定到T10位置,术后并发症与前两者并无太大差异。本文认为UIV 的选择应为稳定椎,即离冠状面中垂线±2 cm,不能止于畸形交界面。我们不太主张融合至T10及其以上节段,因为这样既延长了手术时间,容易增加手术风险,且相应增加了内固定费用,又过多地减少了运动节段,大大增加了胸腰段假关节的发生率。远端是否融合至骶骨同样存在较大争议。远端如果融合至骶骨,融合的脊柱节段与稳定的骨盆之间将形成较大的杠杆臂力导致L5和S1的应力集中。有报告[12]指出融合至S1,L5~S1平面假关节的形成率为5% ~30%。而如果选择融合至L5,因为一般退行性病变患者L5~S1椎间盘多已发生变性,术后因为应力负荷的增加容易导致该节段椎间盘突出,退变性滑脱或者整体矢状面的再失衡,导致二次手术的风险。本文认为如果L5~S1椎间隙高度正常,椎间盘退行性变不明显,腰椎前凸角基本正常可考虑融合至L5。一旦L5~S1椎间盘严重退行性变,L5~S1椎体滑脱,或者退行性侧凸范围超过了L5椎体可考虑选择融合至S1。
综上所述,DLSS 的手术治疗应彻底减压和重建稳定性,根据患者的临床表现,结合影像学检查准确判断责任节段,合理地制定手术方案。我们认为后路减压、矫形固定、融合手术能够解决大多数患者的临床症状,改善脊柱平衡以及提高生活质量。
[1]Gupta MC.Degenerative scoliosis.Options for surgical management[J].Orthop Clin North Am,2003,34(2):269 -279.
[2]Robin GC.Scoliosis in the elderly:idiopathic or osteoporotic?[J].Clin Orthop Relat Res,1986,(205):311 -312.
[3]Liu H,Ishihara H,Kanamori M,et al.Characteristics of nerve root compression caused by degenerative lumbar spinal stenosis with scoliosis[J].Spine J,2003,3(6):524 -529.
[4]李 放.退行性腰椎管狭窄症的病理基础与阶梯治疗[J].华北国防医药,2008,20(5):19 -22.
[5]张志成,任大江,孙天胜,等.退变性腰椎侧凸合并椎管狭窄的阶梯性治疗策略[J].中国修复重建外科杂志,2011,25(8):951 -955.
[6]Transfeldt EE,Topp R,Mehbod AA,et al.Surgical outcomes of decompression,decompression with limited fusion,and decompression with full curve fusion for degenerative scoliosis with radiculopathy[J].Spine(Phila Pa 1976),2010,35(20):1872 -1875.
[7]Reinker K,Simmons JW,Patil V,et al.Can VEPTR®control progression of early-onset kyphoscoliosis?A cohort study of VEPTR®patients with severe kyphoscoliosis[J].Clin Orthop Relat Res,2011,469(5):1342 -1348.
[8]Frazier DD,Lipson SJ,Fossel AH,et al.Associations between spinal deformity and outcomes after decompression for spinal stenosis[J].Spine(Phila Pa 1976),1997,22(17):2025 -2029.
[9]Simmons ED.Surgical treatment of patients with lumbar spinal stenosis with associated scoliosis[J].Clin Orthop Relat Res,2001,(384):45 -53.
[10]Kwon BK,Elgafy H,Keynan O,et al.Progressive junctional kyphosis at the caudal end of lumbar instrumented fusion:etiology,predictors,and treatment[J].Spine (Phila Pa 1976),2006,31(17):1943 -1951.
[11]Cho KJ,Suk SI,Park SR,et al.Selection of proximal fusion level for adult degenerative lumbar scoliosis[J].Eur Spine J,2013,22(2):394-401.
[12]Tsuchiya K,Bridwell KH,Kuklo TR,et al.Minimum 5-year analysis of L5-S1 fusion using sacropelvic fixation (bilateral S1 and iliac screws)for spinal deformity[J].Spine (Phila Pa 1976),2006,31(3):303 -308.

