梓醇通过上调p-Akt 表达抑制慢性脑缺血诱导的大鼠脑白质损伤
蔡其燕,姚忠祥 (第三军医大学基础部:.组织学与胚胎学教研室;.生理学教研室,重庆400038)
脑白质损伤常与神经退行性疾病伴发,但其发病机制目前尚未得到完全阐明。近来研究发现慢性脑缺血可导致脑白质出现广泛的少突胶质细胞凋亡、髓鞘脱失、轴突损伤等病理改变[1-2]。因此寻找有效的药物治疗慢性脑缺血将有助于延缓脑白质损伤及神经退行性疾病的发生。梓醇是一种环烯醚萜葡萄糖苷类化合物,主要存在于地黄等植物中。研究发现梓醇可抑制缺血诱导的神经元和星形胶质细胞凋亡[3-4]。但其对少突胶质细胞的保护作用,尚属未知。最近研究报道梓醇可通过Akt 通路抑制H2O2诱导的内皮细胞凋亡[5],这提示梓醇的保护作用可能与Akt 通路的激活有关。本研究通过永久性结扎大鼠双侧颈总动脉建立慢性脑缺血模型,检测梓醇对脑白质的保护作用及其与Akt 通路的相关性。
1 材料与方法
1.1 动物分组
18 只成年雄性 Wistar 大鼠,体质量 250 ~300 g,购于第三军医大学野战外科研究所实验动物中心。将大鼠随机分为假手术组(Sha 组),生理盐水处理组(Veh 组)和梓醇处理组(Cat组),每组 6 只。
1.2 大鼠慢性脑缺血模型制备和给药方法
大鼠术前禁食12 h、禁水4 h。腹腔注射1%戊巴比妥钠进行麻醉,采用颈部正中切口,暴露双侧颈总动脉,用双重丝线分别在近心端和远心端进行结扎,在结扎两端中间剪断。术中控制温度在36.5 ~37.5 ℃。Sha 组不结扎和剪断颈总动脉,其余步骤和模型组相同。Veh 组和Cat 组大鼠分别于术后腹腔注射生理盐水和梓醇(5 mg/kg),每天1 次,连续10 d。
1.3 脑组织切片的制备
慢性脑缺血30 d 后,用1%戊巴比妥钠麻醉大鼠,暴露心脏,用穿刺针插入右心室,同时剪开右心耳,生理盐水灌注,至流出液体变清后,再灌注2.5%的Zamboni’s 固定液约300 mL。断头取脑,置于Zamboni’s 液中固定24 h。脑组织块用30%蔗糖液脱水至沉入瓶底。OCT 包埋,在有胼胝体区域连续冠状冰冻切片,片厚20 μm。
1.4 卢卡斯快蓝染色
脑片经0.01 mol/L PBS 充分漂洗后裱片于铬钒明胶包被的载玻片上,37 ℃烤片2 h;置于1% 卢卡斯快蓝(luxol fast blue,LFB)染液中染色8 h(60 ℃);95%酒精洗去多于染液,转入蒸馏水中充分漂洗;0.05%碳酸锂溶液分色20 s,蒸馏水漂洗;70%酒精继续分色至灰质和白质能明显区分;自来水冲洗后,用梯度酒精脱水,二甲苯透明,中性树胶封片。
1.5 免疫组织化学检测
1.5.1 免疫酶标染色 脑片经 0.01 mol/L PBS 充分漂洗后,用3%双氧水于室温处理15 min,PBS 漂洗3 次(每次5 min),用5%BSA 于37 ℃作用30 min 封闭抗体的非特异性结合。加一抗(APC 小鼠单克隆抗体,1 ∶100,Calbiochem 公司;MBP 山羊多克隆抗体,1∶200,Santa Cruz 公司;p-Akt 兔多克隆抗体,1∶100,Cell signaling 公司),4 ℃ 过夜。生物素标记二抗(1∶100),37 ℃ 孵育 2 h,PBS 漂洗 3 次。SABC 复合物(Vector公司),37 ℃孵育 1 h,DAB 显色后,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察并照相。以0.01 mol/L PBS代替一抗作为阴性对照。用Image-Plus Pro 5.0 软件计算免疫阳性光密度值和免疫阳性细胞数。
1.5.2 免疫荧光双标染色 脑片经PBS 充分漂洗后,用5%BSA 于37 ℃作用30 min 封闭抗体的非特异性结合。切片同时加入 APC(1∶100)和 caspase-3(1∶100)抗体,或 APC(1∶100)和p-Akt(1∶100)抗体,37 ℃孵育 2 h 后,于 4 ℃孵育过夜。PBS 漂洗3 次后,同时加入Cy3 标记的兔抗小鼠和FITC 标记的山羊抗兔荧光二抗(1∶100,Abcam 公司),37 ℃ 避光孵育 3 h,PBS 漂洗,用水溶性封片剂封片,荧光显微镜下观察并照相。Image-Plus Pro 5.0 软件计算双阳性细胞数。
1.6 统计分析
2 结果
2.1 梓醇抑制脑白质少突胶质细胞凋亡
免疫组织化学染色结果显示(图1a、b、c、g)Sha 组胼胝体内APC 阳性的少突胶质细胞数较多,Veh 组的少突胶质细胞数与Sha 组比较明显减少(P <0.01)。梓醇治疗后,Cat 组胼胝体的少突胶质细胞数明显增多,与Veh 组比较,具有显著性差异(P <0.05)。APC 与 caspase-3 免疫荧光双标染色结果显示(图1d、e、f、h)Sha 组胼胝体内双阳性的凋亡少突胶质细胞数较少,Veh 组双阳性的凋亡细胞数与 Sha 组比较明显增多(P <0.01)。梓醇治疗后,凋亡的少突胶质细胞数明显降低,与Veh 组比较,有显著性差异(P <0.05)。

图1 免疫组织化学染色显示梓醇对慢性脑缺血大鼠胼胝体少突胶质细胞的影响
2.2 梓醇缓解脑白质髓鞘损伤
LFB 髓鞘染色和MBP 免疫组织化学染色结果见图2。在Sha 组中,LFB 染色和MBP 染色深、边界清晰明显。脑缺血损伤后,髓鞘稀疏,LFB 和MBP 染色变浅,两者的平均光密度值显著下降(与 Sha 组比较,P <0.01)。梓醇治疗后,LFB 和 MBP 染 色的平均光密度值明显升高(与 Veh 组比较,P <0.05)。

图2 LFB 和免疫组织化学染色显示梓醇对慢性脑缺血大鼠胼胝体髓鞘的影响
2.3 梓醇上调脑白质p-Akt 表达
p-Akt 免疫组织化学染色结果见图3。在Sha 组胼胝体中,p-Akt 阳性细胞数较少。缺血损伤后,p-Akt 阳性细胞数有少量增加,但与Sha 组比较无明显差异。梓醇治疗后,p-Akt 阳性细胞数明显增加,与Veh 组比较,差异显著(P <0.01)。免疫荧光双标染色结果进一步显示梓醇可明显增加胼胝体APC 和p-Akt双阳性细胞数,即梓醇促进p-Akt 在少突胶质细胞的表达(与Veh 组比较,P <0.01)。
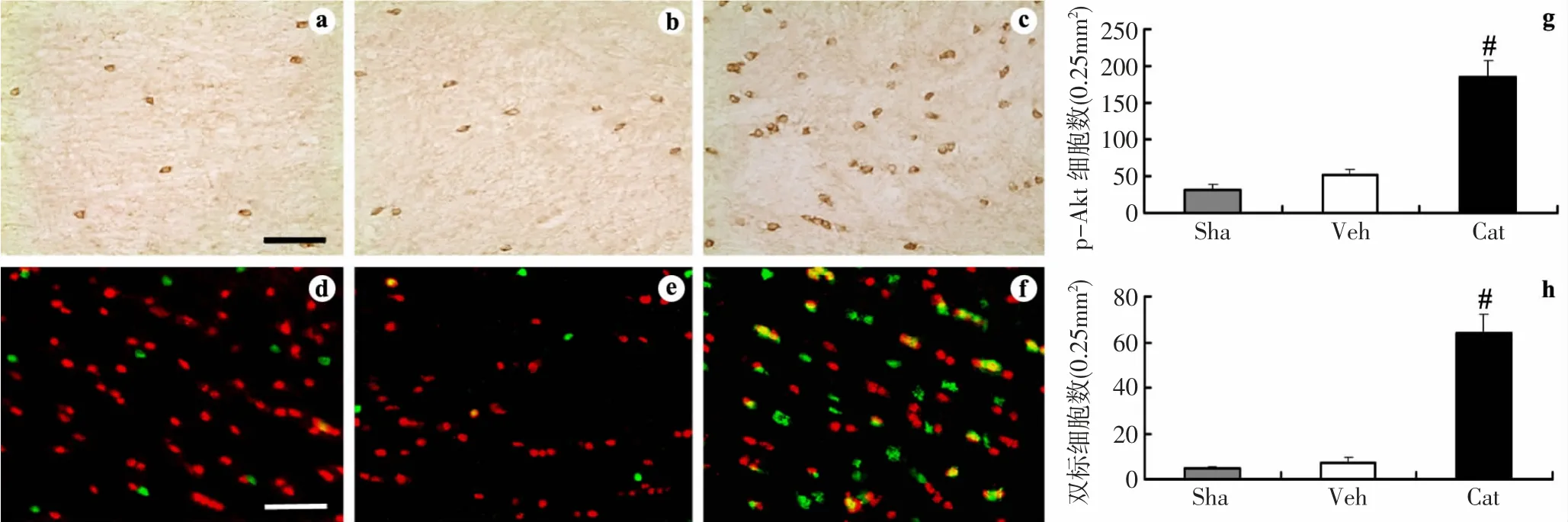
图3 免疫组织化学染色显示梓醇对慢性脑缺血大鼠胼胝体p-Akt 表达的影响
3 讨论
人类脑白质约占全脑组织的50%,轻度缺血即可造成脑白质损伤[6]。胼胝体作为脑白质的易损区域之一,在缺血后可通过损伤的神经纤维破坏白质与灰质之间的信号传递,造成全脑性的神经功能障碍[7]。在慢性脑缺血中,脑白质可由于少突胶质细胞凋亡、髓鞘脱失及神经纤维断裂,最终导致脑白质的疏松和空泡样病变[8]。少突胶质细胞作为中枢神经系统的髓鞘形成细胞,对体内外缺血损伤极其敏感,慢性、轻微、持续性脑缺血时少突胶质细胞较神经元更易受损[9]。少突胶质细胞受损或凋亡则可造成髓鞘的损伤,最终影响神经冲动的传导。因此,少突胶质细胞损害作为缺血时脑白质损伤的重要原因,正在受到更多的关注[10]。在本研究中,利用APC 和MBP 免疫组织化学染色及LFB 染色法检测脑白质的损伤情况,发现慢性脑缺血可诱导少突胶质细胞凋亡和髓鞘损伤,梓醇治疗后则可明显抑制少突胶质细胞凋亡和髓鞘损伤,这说明梓醇对脑白质的保护作用与其抗凋亡效应有关。
caspase-3 是细胞凋亡过程中最重要的一种半胱氨酸蛋白酶,受凋亡刺激因素作用后被激活,活化的caspase-3 可通过裂解其底物,直接激活其他的蛋白酶如caspase-2 和caspase-9,或诱导线粒体功能障碍等多条途径促进细胞凋亡[11]。研究发现通过脑室内注射caspase-3 抑制剂可获得对缺血性脑损伤的保护作用[12],这说明 caspase-3 的激活与脑缺血损 伤有关[13-14]。Walker 等[15]研究发现缺血缺氧可诱导少突胶质细胞内caspase-3 的激活,参与少突胶质细胞的缺血性损伤。Han 等[12]也报道了 caspase-3 激活对少突胶质细胞凋亡的诱导作用,抑制caspase-3 活性可促进少突胶质细胞的存活。本研究结果显示梓醇可明显抑制慢性脑缺血诱导的少突胶质细胞内caspase-3 表达的增多,这提示梓醇可通过降低caspase-3 的活性来抑制少突胶质细胞的凋亡。
丝氨酸/苏氨酸蛋白激酶Akt 被磷酯酰肌醇3 激酶(phosphoinositide-3-kinase,PI3K)磷酸化激活后,可通过不同途径调节细胞的存活和凋亡。活化的Akt(即p-Akt)一方面通过磷酸化一系列凋亡调控蛋白,如Bad、caspase-3 等,使这些促凋亡蛋白失活;另一方面通过促进抗凋亡基因的转录和表达,来促进细胞的存活,如p-Akt 使CREB 磷酸化后,激活 CREB 的转录功能,使Bcl-2、Bcl-xL 表达增强,稳定线粒体的功能状态,促进细胞存活[16]。在脑缺血损伤中,p-Akt 除了对神经元具有广泛的保护作用外,对于少突胶质细胞的存活也具有重要的调节作用,如Pang 等[17]发现p-Akt可明显抑制TNF-α 介导的少突胶质细胞损伤,促进少突胶质细胞存活。本实验结果显示,梓醇治疗可明显提高p-Akt 在少突胶质细胞的表达,抑制少突胶质细胞凋亡。这提示梓醇在慢性脑缺血中对少突胶质细胞的保护作用可能与Akt 通路的激活有关。
综上所述,梓醇可明显抑制慢性脑缺血诱导的少突胶质细胞凋亡和髓鞘损伤,梓醇对脑白质的保护作用与其上调p-Akt 的表达相关。本研究结果为临床治疗脑缺血损伤提供了新的研究思路和候选药物。
[1]Farkas E,Donka G,de Vos RA,et al.Experimental cerebral hypoperfusion induces white matter injury and microglial activation in the rat brain[J].Acta Neuropathol,2004,108(1):57 -64.
[2]Duan W,Gui L,Zhou ZJ,et al.Adenosine A2A receptor deficiency exacerbates white matter lesions and cognitive deficits induced by chronic cerebral hypoperfusion in mice[J].J Neurol Sci,2009,285(1 -2):39-45.
[3]Li YC,Bao YM,Jiang B,et al.Catalpol protects primary cultured astrocytes from in vitro ischemia-induced damage[J].Int J Devl Neurosci,2008,26(3 -4):309 -317.
[4]Zhu HF,Wan D,Luo Y,et al.Catalpol increases brain angiogenesis and up-regulates VEGF and EPO in the rat after permanent middle cerebral artery occlusion[J].Int J Biol Sci,2010,6(5):443 -453.
[5]Hu LG,Sun YK,Hu J.Catalpol inhibits apoptosis in hydrogen peroxideinduced endothelium by activating the PI3K/Akt signaling pathway and modulating expression of Bcl-2 and Bax[J].Eur J Pharmacol,2010,628(1 -3):155 -163.
[6]Dewar D,Underhill SM,Goldberg MP.Oligodendrocytes and ischemic brain injury[J].J Cerebr Blood F Met,2003,23(3):263 -274.
[7]Chida Y,Kokubo Y,Sato S,et al.The alterations of oligodendrocyte,myelin in corpus callosum,and cognitive dysfunction following chronic cerebral ischemia in rats[J].Brain Res,2011,1414(26):22 -31.
[8]Chen YZ,Yi Q,Liu G,et al.Cerebral white matter injury and damage to myelin sheath following whole-brain ischemia[J].Brain Res,2013,1495(13):11 -17.
[9]Mciver SR,Muccigrosso M,Gonzales ER,et al.Oligodendrocyte degeneration and recovery after focal cerebral ischemia[J].Neuroscience,2010,169(3):1364 -1375.
[10]Basile AM,Pantoni L,Pracucci G,et al.Age,hypertension,and lacunar stroke are the major determinants of the severity of age-related white matter changes[J].Cerebrovasc Dis,2006,21(5 -6):315 -322.
[11]Sugawara T,Lewen A,Noshita N,et al.Effect of global ischemia duration on neuronal,astroglial,oligoden droglial,and microglial reactions in the vulnerable hippocampal CA1 subregion in rats[J].J Neurotrauma,2002,19(1):85 -98.
[12]Han BH,Xu D,Choi J,et al.Selective,reversible caspase-3 inhibitor is neuroprotective and reveals distinct pathways of cell death after neonatal hypoxic-ischemic brain injury[J].J Biol Chem,2002,277(33):30128 -30136.
[13]Rothstein RP,Levison SW.Gray matter oligodendrocyte progenitors and neurons die caspase-3 mediated deaths subsequent to mild perinatal hypoxic/ischemic insults[J].Dev Neurosci,2005,27(2 -4):149 -159.
[14]Cao Y,Gunn AJ,Bennet L,et al.Insulin-like growth factor (IGF)-1 suppresses oligodendrocyte caspase-3 activation and increases glial proliferation after ischemia in near-term fetal sheep[J].J Cereb Blood Flow Metab,2003,23(6):739 -747.
[15]Walker EJ,Rosenberg GA.Divergent role for MMP-2 in myelin breakdown and oligodendrocyte death following transient global ischemia[J].J Neurosci Res,2010,88(4):764 -773.
[16]Badr G,Saad H,Waly H,et al.Type I interferon(IFN-α/β)rescues B-lymphocytes from apoptosis via PI3Kδ/Akt,Rho-A,NFκB and Bcl-2/Bcl(XL)[J].Cell Immunol,2010,263(1):31 -40.
[17]Pang Y,Zheng BY,Fan LW,et al.IGF-1 protects oligodendrocyte progenitors against TNFalpha-induced damage by activation of PI3K/Akt and interruption of the mitochondrial apoptotic pathway[J].Glia,2007,55(11):1099 -1107.

