livinβ-siRNA 表达载体的构建及其在人星形胶质瘤细胞中的稳定表达
石全红,詹 傲,崔荣周,王 佳 (.重庆医科大学附属第一医院神经外科,重庆40006;.重庆医科大学附属大学城医院妇产科,重庆4033)
livin 是凋亡抑制蛋白,livin 基因包括 livinα、livinβ 2 种亚型,有研究发现,胶质细胞瘤中livinβ mRNA 表达高于正常对照组。livinα、livinβ 2 亚型,分别编码298 个氨基酸和280 个氨基酸的不同亚型结构蛋白质。本研究采用RNA 干扰技术,构建了针对人livinβ基因的特异性短发卡RNA(siRNA)真核表达载体,将其转染人胶质瘤细胞,并观察其对胶质瘤细胞livinβ基因表达的影响。
1 材料与方法
1.1 主要试剂及仪器
人星形胶质瘤细胞(U251)购于中国典型培养物保藏中心(武汉大学);pGenesil-11 购于武汉晶赛公司,Tris 购于美国Promega公司,PVDF膜购于MILLIPORE,预染蛋白质分子量标准购于Fermentas 公司,Rabbit anti-human livin 抗体购于武汉博士德,Rabbit anti-GAPDH 多克隆抗体购于武汉晶赛公司,动物RNAout(Trizol RNA 提取试剂用于细胞RNA 的提取)天泽基因工程有限公司产品;ReverTra Ace-α-TM-RT-PCR Kit 用于以RNA 为模板,逆转录合成cDNA 第一条链,购自东洋纺(上海)生物科技有限公司;PCR 引物购于武汉博洁公司;DNA marker DL2000(TaKaRa)购于武汉亚法公司产品;Taq DNA 聚合酶购于MBI 公司,总RNA 提取试剂盒购于上海华舜公司,TaKaRa RNA PCR Kit 购于 TaKaRa 生物有限公司,DNA marker DL2000、DNA marker 均购于TaKaRa 生物有限公司,Gold View Nucleic Acid Stain 购于北京赛百盛基因技术公司。
1.2 方法
1.2.1 构建策略 pGenesil-11 是一种新型的真核表达载体,其以增强型绿色荧光蛋白(enhanced green fluorescent,EGFP)为报告基因,并同时表达2 条shRNA。采用PCR 方法合成2 条shRNA,用XcmⅠ限制性内切酶将pGenesil-11 酶切成线性质粒,用Ligation mixture 连接酶将2 条 shRNA 与线性质粒连接,转化感受态细菌DH5α,筛选阳性转化的DH5α,并应用酶切和基因测序鉴定质粒。构建的重组质粒命名pGenesil-11-livinβ-siRNA,见图1。
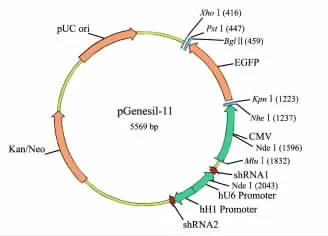
图1 同时表达2 条shRNA 和增强型绿色荧光蛋白的重组质粒
1.2.2 livinβ-siRNA 序列设计及合成 目的基因针对 livinβ基因序列设计:干扰序列 livinβ1 GGAAGAGACTTTGTCCACA,livinβ2 CCGTGTCCATCGTCTTTGT。设计并合成 PCR-F 引物BIRC71 和 PCR-R 引物 BIRC72:livinβ1 GGAAGAGACTTTGTCC ACA,livinβ1-F 5’CAAAAAGGAAGAGACTTTGTCCACATTCGTG TGGACAAAGTCTCTTCCGGTGTTTCGTC-3’,livinβ2 CCGTGTCC ATCGTCTTTGT,livinβ2-R 5’GAAAAACCGTGTCCATCGTCTTTG TTCTCACAAGACGATGGACACGGCGGGAAAGAGTG-3’。 分 别以 PCR-F 引物 livinβ1 和 PCR-R 引物 livinβ2 为上、下游引物,以质粒pENTR/K4-Shsample 为模板,体外35 ℃→45 ℃梯度1℃ 1 个循环,58 ℃ 30 s,72 ℃ 1 min 30 个循环 PCR 扩增 livinβ1+livinβ2 片段。1%Agarose 凝胶电泳回收 siRNA(图2)。经XcmⅠ酶切反应体系,凝胶电泳回收质粒pGenesil-11 XcmⅠ酶切大片段酶切分析(图3)。

图2 PCR 扩增获得的siRNA

图3 质粒pGenesil-11 XcmⅠ酶切分析
1.2.3 连接产物的转化 制备E.coli DH5α 感受态菌,进行连接产物的转化:取10 mL 过夜连接产物转化感受态DH5α,涂布于含Kanar 的LB 平板上,37 ℃恒温箱培养过夜,挑取3 个单菌落分别接种于5 mL 含Kanar 的LB 培养液中,37 ℃恒温摇床培养过夜。
1.2.4 重组质粒的抽提及鉴定 重组质粒抽提后,进行DNA 序列测定(由上海英骏公司完成)。将阳性菌株接种于含有 Kana(50 μg/mL)的 LB 液体培养基中,37 ℃,200 r/min 摇菌过夜,取1 mL 菌液移入灭菌的1.5 mL 离心管中,加入0.25 mL 100%灭菌甘油,混匀后-80 ℃保存重组质粒备用。
1.3 重组质粒在真核细胞中的表达分析
1.3.1 人星形胶质瘤细胞U251 的培养 采用含10%胎牛血清的RPMI-1640 培养液,传代培养后,制成单细胞悬液,显微镜下,用10 倍物镜观察计数板4 个象限中4 个大方格中的细胞数,代入公式:细胞悬液的浓度(个/毫升)=(4 大方格细胞数之和/2)×104计数。
1.3.2 重组质粒转染人星形胶质瘤细胞U251 按照Lipofectamine 2000 说明书配制转染液。人胶质瘤细胞U251 的转染:将细胞分为3 组,Ⅰ组为转染组,即转染液中含重组质粒;Ⅱ组为空载体组,即转染液中仅含pGenesil-11 质粒;Ⅲ组为对照组,即转染液中不含有质粒。细胞接种24 h 后,在24 孔板每孔中分别加入100 μl 转染液,置于37 ℃,含5%CO2的恒温孵箱内培养8 h 后,更换为含双抗的1640 +10%FBS 完全培养基,24 ~48 h 在荧光倒置显微镜下观察重组质粒在细胞中的表达。一个视野下数100 个细胞,数3 次取平均值。
1.3.3 RT-PCR 检测重组质粒转染 U251 后 livinβ 基因的表达RT-PCR 反应条件95 ℃ 5 min 1 个循环;95 ℃ 20 s;60 ℃20 s;72 ℃ 10 s;共35 个循环,72 ℃延长3 min 后结束扩增。按5︰1 比例,取 5 μl PCR 产物与 1 μl 缓冲液混合进行 2% 的琼脂糖凝胶电泳,100 V 35 min,电泳结束后,凝胶成像扫描仪分析,采用Quantity One 软件分析系统,对重组质粒转染 U251 后livinβ 基因产物进行光密度值分析。
1.3.4 Western blot 检测重组质粒转染 U251 后 livin 蛋白每106个细胞加入1 mL RIPA 蛋白提取液,收集裂解的细胞,转膜,封闭,稀释一抗,抗人 livin(1︰200),内参兔抗 - GAPDH(1︰10 000),稀释二抗羊抗兔 IgG/HRP,稀释比例均为 1︰2 500,按 0.2 mL/cm2分别加入二抗,PVDF 膜曝光成像,用Quantity One 软件分析蛋白区带,将livin 光密度值与内参GAPDH 光密度值相比,为livin 相对光密度值。
1.4 统计学方法
采用SPSS 10.0 统计软件,所有计量资料均采用方差分析,P <0.05 具有统计学意义。
2 结果
2.1 重组质粒的酶切鉴定
重组质粒经NdeⅠ双酶切后,电泳结果显示,能够被Nde I酶切出一条约447 bp DNA 小带的质粒即为克隆成功的质粒,第3、5 泳道分别有一条与我们预期结果相符合的明亮条带,见图4。

图4 重组质粒插入片段的限制性酶切分析
2.2 重组质粒的序列测定
重组质粒测序结果及质谱分析见图5,经BLAST 查询确定其分别为特异性序列。TTATGTaaCGCGGaaCTCCATATATGGGC TATGAACTAATGACCCCGTAATTGATTACTATTAATAACTACGC GTGGGATGTGCTGCAAGGCGATTAAGTTGGGTAACGCCAGGGT TTTCCCAGTCACGACGTTGTAAAACGACGGCCAGGAAAAACCG TGTCCATCGTCTTTGTTCTCACAAAGACGATGGACACGGCGGG AAAGAGTGATCTCATACAGAACTTATAAGATTCCCAAATCCAA AGACATTTCACGTTTATGATGATTTCCCAGAACACATAGCGAC ATGCAAATATTGCAGGGCGCCACTCCCCTGTCCCTCACAGCCA TCTTCCTGCCAGGGCGCACGCGCGCTGGGTGTTCCCGCCTGGT GACACTGGGCCCGCGATTCCTTGGAGCGGGTTGATGACGTCA GCGTTCAGATCGATCCAAGGTCGGGCAGGAAGAGGGCCTATT TCCCATGATTCCTTCATATTTGCATATACGATACAAGGCTGTT AGAGAGATAATTAGAATTAATTTGACTGTAAACACGAAGATA TTAGTACAAAATACGTGACGTAGAAAGTAATAATTTCTTGGG TAGTTTGCAGTTTTAAAATTATGCTTTAAAATGGACTATCATA TGCCTACCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATAT ATCTTGTGGAAAGGACGAAACACCGGAAGAGACTTTGTCCAC ACGAATGTGGACAAAGTCTCTTCCTTTTTGATGATTTCCCAGA ACACATAGCGACATGCAAATATTGCAGGGCGCCACTCCCCTG TCCCTCACAGCCATCTTCCTGCCAGGGCGCACGCGCGCTGGGT GTTCCCGCCTGGTGACACTGGGCCCGCGATTCCTTGGAGCGGG TTGATGACGTCAGCGTTCAGATCGATCCAATGTCGGGCAGGAA GAGGGCCTATTTCCCATGATTCCTTCATATTTGCATATACGATT ACAAGGCTGTTAGAGAGA。

图5 重组质粒pGenesil-11-livinβ-siRNA 的测序图谱
2.3 重组质粒的转染结果
转染24 ~48 h 荧光显微镜下观察,在对照组中未发现表达绿色荧光的细胞,在转染组和空载体组均可发现大量表达绿色荧光的细胞,见图6。荧光显微镜下一个视野下数100 个细胞,数3 次取平均值(59 +63 +60)/3 =60.7,照相确定转染效率约为60.7%。转染后48 ~72 h 为荧光表达的高峰期,一周后荧光表达开始减弱,至3 周时仍可观察到表达绿色荧光的个别细胞。
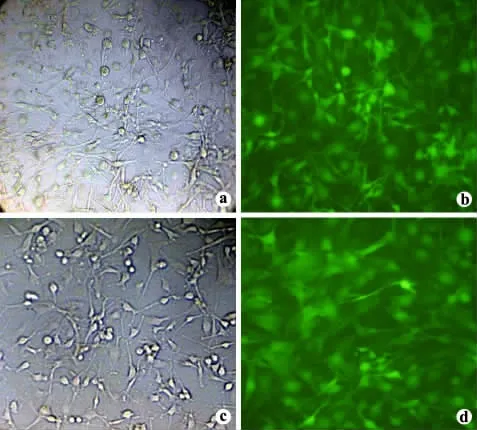
图6 转染后的胶质瘤细胞U251 镜下观察(×200)
2.4 重组质粒转染人胶质瘤细胞U251 livinβ mRNA 的表达
RT-PCR 检测重组质粒转染人胶质瘤细胞U251 后,细胞中livinβ mRNA 的表达,见图7。采用随机区组方差分析显示,3组之间表达差异有显著统计学意义(F=1 525.6,P <0.05),且转染组分别与空载体组、正常对照组有显著差异(P <0.05),而空载体组、正常对照组之间无差异(P >0.05),见表1。
2.5 重组质粒转染人胶质瘤细胞U251 livin 蛋白的表达
Western blot 检测重组质粒转染人胶质瘤细胞U251 后,细胞中livin 蛋白的表达,结果见图8。采用随机区组方差分析显示,3组之间表达差异有显著统计学意义(F=300.8,P <0.05),且转染组分别与空载体组、正常对照组有显著差异(P <0.05),而空载体组、正常对照组之间无差异(P >0.05),见表2。

图7 重组质粒转染人胶质瘤细胞U251 后,细胞中livinβ mRNA 的表达

表1 重组质粒转染人胶质瘤细胞U251 livinβ mRNA 的表达

图8 重组质粒转染人胶质瘤细胞U251 livin 蛋白表达
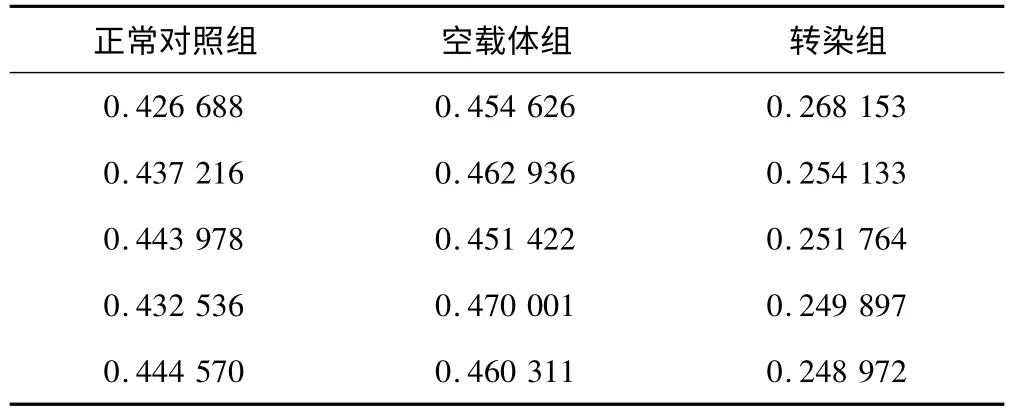
表2 重组质粒转染人胶质瘤细胞U251 livin 蛋白的表达
3 讨论
抑制基因表达目前多倾向于使用RNA 干扰(RNA interference,RNAi)技术,是应用 21 ~23 个碱基大小的小分子干扰RNA(small interfering RNA,siRNA)在体内高效、特异地阻断或者降低同源基因的表达,促使同源mRNA 降解,诱使细胞表现出特定基因缺失的表型,从而抑制基因的表达,或者说是引发转录后基因沉默(post-transcriptional gene silencing,PTGS)。
由于siRNA 可以在不影响非特异性干扰素途径的情况下抑制靶基因的表达,具有选择余地大和扩增放大效应,只需微量特异的siRNA 即可产生明显的抑制基因表达效果。但是siRNA 进入细胞后容易被降解,24 h 后阻抑效果降低,其作用时间仅持续约72 h,因此作用时间短暂是其致命缺陷。为克服此缺陷,人们设想利用载体介导siRNA 体内表达技术。其原理是将siRNA 对应的DNA 模板插入载体,位于RNA 聚合酶Ⅲ启动子下游,在RNA 聚合酶Ⅲ作用下转录产生含发夹状结构的siRNA,即shRNA[1]。设计针对靶基因的siRNA 模版DNA,将其与质粒连接后转染细胞,DNA 模版在细胞内转录形成的shRNA 具有与siRNA同样的抑制靶基因表达的作用,这种作用可持续数月之久[2],并且可以突破细胞界限,在不同细胞间长距离传递和维持,并可传递给子代。
目前国内外制备siRNA 的方法有很多种,包括化学合成、体外转录、PCR 合成、构建 shRNA 表达载体等[3]。PCR 合成可以快速筛选到有效的的 siRNA,而且由于PCR 产物表达框末端并限制性位点,使其更容易被克隆到质粒或病毒载体中,形成PCR 产物表达框表达载体[4]。本研究通过 PCR 方法成功获得了livinβ-siRNA,并发挥了抑制 livinβ 基因表达的作用。与其他方法相比,用PCR 方法获得siRNA 速度快,适用于快速筛选、研究特定基因,花费比较少,能有效抑制目的基因表达[5]。
本实验所用载体为pGenesil-11 线性化质粒。该质粒具有绿色荧光蛋白(GFP)报告基因。与普遍使用的酶类报告基因不同,GFP 具有以下优点:①易于检测,不需加任何底物,只需紫外线或蓝光激发即可发出绿色荧光。②相对分子量小,编码GFP 的基因序列约2.6 kb,便于载体构建,不至于由于质粒过大影响转化率。③大量表达对细胞无毒性。④将含有GFP 与目的基因的质粒转染细胞后,在荧光显微镜下可直接观察转染是否成功及转染效率。⑤可以作为转基因细胞移植后在体内的示踪剂,这将便于我们研究转染基因细胞在体内存活和分化情况。随着人们对GFP 研究的深入,已经得到了许多GFP 的突变型,如本实验中采用的载体-增强型绿色荧光蛋白(EGFP),其荧光强度是GFP 的35 倍,而且在激发16 ~24 h 后仍可稳定表达荧光[6]。
因此,本实验构建的livinβ-siRNA 表达载体pGenesil-11-livinβ-siRNA,可允许目的基因与报告基因(EGFP)同时以相同水平表达。直接可以在荧光显微镜下观察表达载体转染是否成功及转染效率,得出本实验转染效率约为60.7%。并且经酶切、测序鉴定证实本实验成功构建了livinβ-siRNA 表达载体pGenesil-11-livinβ-siRNA,并在真核细胞即人胶质瘤细胞U251中能正常表达。应用RT-PCR、Western blot 等实验证实pGenesil-11-livinβ 转染人胶质瘤细胞U251 后,可以在转录水平和翻译水平抑制livinβ 基因和蛋白表达。
[1]Sui G,Soohoo C,Affar elB,et a1.A DNA vector-based RNAi technology to suppress gene expression in mamalian cells[J].Proc Natl Acad Sci USA,2002,99(8):55l5 -5520.
[2]Brummelkamp TR,Bernards R,Agami R.A system for stable expressionof short interfering RNAs in mamalian cells[J].Science,2002,296(5567):550 -553.
[3]Banan M,Puri N.The ins and outs of RNAi in mammalian cells[J].Curr Pharm Biotechnol,2004,5(5):441 -450.
[4]洪 权,吴 镝,陈香美,等.利用PCR 方法获得shRNA 抑制内外源性基因的表达[J].解放军医学杂志,2005,30(9):800 -803.
[5]Castanotto D,Soberer L.Targeting cellular genes with PCR cassettes expressing short interfering RNAs[J].Methods Enzymol,2005,392:173-185.
[6]Yang TT,Sinai P,Green G,et al.Improved fluorescence and dual color detection with enhanced blue and green variants of the green fluorescent protein[J].J Biol Chem,1998,273(14):8212 -8217.

