好食脉孢霉液态发酵产木聚糖酶的研究
■ 邓永平 刘晓兰 艾瑞波 郑喜群 任 凭
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006;2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔 161006;3.黑龙江省齐齐哈尔市北方华安工业集团技术中心,黑龙江齐齐哈尔 161006)
木聚糖酶是可将木聚糖降解成木糖和低聚糖的一类木糖苷键水解酶,在造纸、食品、饲料、能源转化等领域都有重要应用[1-5],因此,国际上对木聚糖酶的研究十分重视。
Sorensen(1955)首先对动物瘤胃和土壤中的木聚糖酶进行了研究,目前已经可以通过微生物发酵生产木聚糖酶,例如在Bacillus subtilis、Bacillus subtilis ASH、Aspergillus nige、Paecilomyces ther⁃mophil等发酵产物中都得到了木聚糖酶[6-9]。木聚糖酶的研究应用中存在单位产量低、稳定性较差等问题,限制了木聚糖酶在某些领域的应用,因此,从工业化角度看,木聚糖酶的可开发空间很大。
本试验利用从南方小酒药中分离的微生物好食脉孢霉为生产菌种,以麸皮和豆渣这两种食品加工下脚料为主要培养基质,利用液态发酵的方法生产木聚糖酶,研究不同培养基、发酵温度和接种量对酶活力的影响,确定最适产酶条件,从而为来源安全、高活力、低成本的木聚糖酶的生产提供参考。
1 材料与方法
1.1 试验材料
菌种为好食脉孢霉(保藏号为CGMCC No.1836)。
斜面培养基:PDA培养基;液体种子培养基:3%麸皮水、1.5%蛋白胨,pH值5.0;液体发酵培养基:3%麸皮水为碳源,氮源种类及浓度根据试验而定。
1.2 试验方法
1.2.1 斜面培养
取好食脉孢霉菌种保藏斜面1支,用接种环转接入PDA斜面,28℃恒温培养3~5 d,于4℃冰箱中保存备用。
1.2.2 液体发酵种子制备
制备好食脉孢霉孢子悬液,将适量孢子悬液接入装有50 ml液体种子培养基的250 ml三角瓶中,在28~30 ℃、150 r/min条件下培养2 d,作为液体种子。
1.2.3 摇瓶发酵培养
将适量液体种子接入装有50 ml发酵培养基的250 ml三角瓶中,28~30 ℃、150 r/min振荡培养72 h。
1.2.4 粗酶液的制备
将发酵液用冷冻离心机在6 000 r/min、4℃条件下离心10 min,取上层清液即为粗酶液。
1.2.5 木聚糖酶活性的测定方法
采用3,5-二硝基水杨酸(DNS)法。底物为0.4%木聚糖溶液(pH值4.4),取0.5 ml适当稀释的酶液于比色管中,加入1.5 ml底物溶液,45℃水浴反应30 min,加入1.5 ml DNS溶液后在沸水浴中煮沸5 min。迅速用冷水冷却至室温,加蒸馏水定容至25 ml,540 nm测定吸光值,木糖标准曲线见图1。
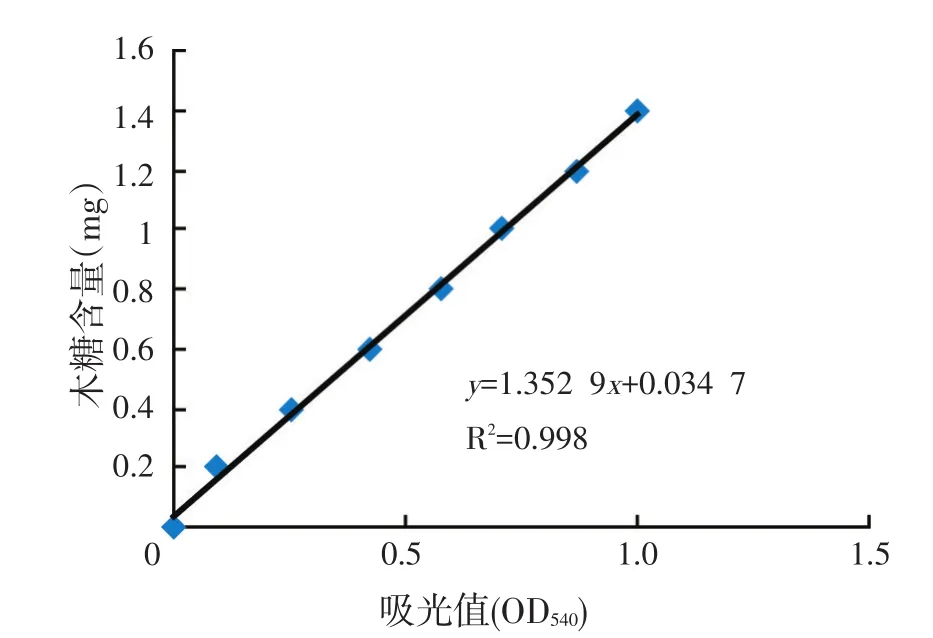
图1 木糖标准曲线
酶活力定义为:在45℃、pH值4.4条件下,每分钟分解木聚糖生成1 μg木糖所需的酶量为一个酶活力单位(U)。
1.2.6 测定种子生长曲线
采用称干重法测量种子生长曲线。
2 结果和讨论
2.1 种子生长曲线
将好食脉孢霉菌种接入种子培养液,在28℃、150 r/min的条件下培养48 h,每4 h取样1次,烘干至恒重,测干重,平行试验3次。以菌体干重为纵坐标,发酵时间为横坐标绘制种子生长曲线(见图2)。
由图2可知,在12 h时菌体进入快速生长期,到达40 h时进入衰退期,故接种最适时期为12~24 h。

图2 种子生长曲线
2.2 培养基组成成分对好食脉孢霉产木聚糖酶活力的影响
大多数真菌产生的木聚糖酶都是复合酶,也是诱导酶,通常半纤维素底物及类似物都是木聚糖酶的良好诱导物。试验中选用麸皮作为碳源,除了价格低廉的原因外,麸皮对木聚糖酶有着较好的诱导作用。豆渣和豆粕含有丰富的营养,既可以作为培养好食脉孢霉的氮源,又可以作为产酶诱导物。
试验以3%麸皮水为碳源,氮源种类及浓度见表1,培养基初始pH值自然。以l%接种量将种子分别接入装有50 ml不同发酵培养基的250 ml三角瓶中,在150 r/min、28℃条件下振荡培养72 h,测定木聚糖酶活力,不同培养基组成对木聚糖酶活力的影响见图3。

表1 发酵培养基氮源种类及浓度(%)
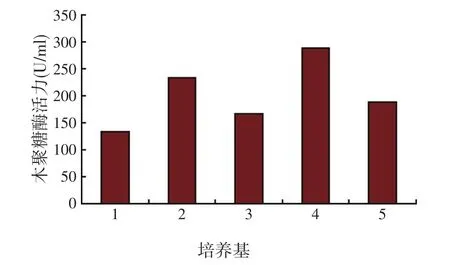
图3 培养基组成对好食脉孢霉产木聚糖酶活力的影响
由图3可以看出,采用单一氮源,产酶效果较差,而采用蛋白胨和豆渣(即4号培养基)作为复合氮源,效果很好,使用4号培养基发酵后产酶活力最高。
豆渣是豆制品加工下脚料,价格低廉,来源广泛,很适合作为生产原料,因此,改变培养基中豆渣的含量,即豆腐渣含量分别为6%、10%、15%、20%及25%,以3%麸皮水为碳源,蛋白胨含量均为0.5%,以期进一步提高酶活力。
以豆渣含量为横坐标,木聚糖酶活力为纵坐标作图,试验结果见图4。
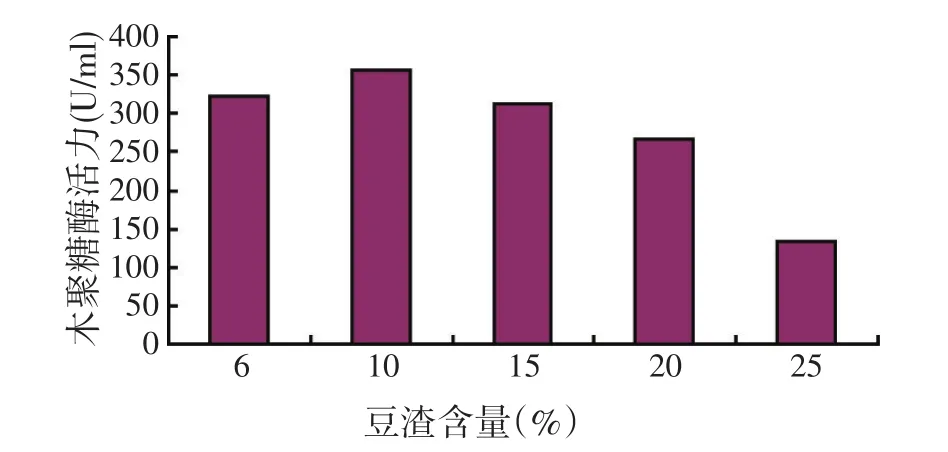
图4 不同豆渣含量对好食脉孢霉产木聚糖酶活力的影响
如图4所示,豆渣的含量对产酶影响较大,豆渣浓度为10%时,酶的活力最高,豆渣浓度高于10%时,木聚糖酶活力开始下降,豆渣浓度越高,酶活力越低,在试验中发现,当豆渣浓度高于10%后,培养液变得黏稠,不利于溶氧,不利于菌体生长和产酶。所以,选择培养基为3%麸皮水、0.5%蛋白胨、10%豆渣,pH值自然。
2.3 培养基初始pH值对好食脉孢霉产木聚糖酶活力的影响
培养基初始pH值影响微生物原生质膜所带的电荷以及某些营养物质的分解和电离程度,从而影响微生物对营养物质的吸收。发酵过程中pH值会随着培养时间不同而发生改变,从而影响产酶。因此,试验采用柠檬酸缓冲液将培养基调至特定的初始pH值,在菌株生长过程中不再加以控制。
将发酵培养基初始pH值分别调整为4.0、4.5、5.0、5.5、6.0、6.5、7.0,接种量1%,28 ℃、150 r/min振荡培养72 h后测定木聚糖酶活力(见图5)。
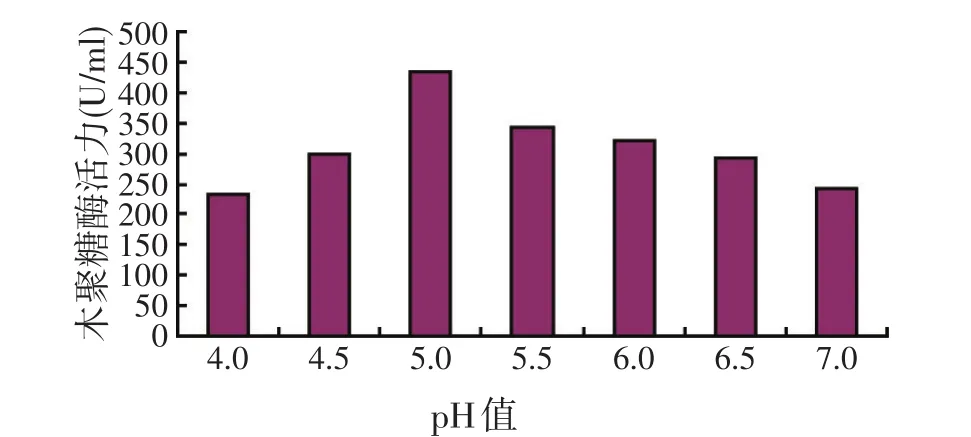
图5 培养基初始pH值对好食脉孢霉产木聚糖酶活力的影响
试验结果如图5所示,随着培养基初始pH值的不同,产木聚糖酶活力也有明显差别。这是由于细胞内的H+或OH-离子能够影响酶蛋白的解离度和电荷状况,改变酶的结构和功能,引起酶活性的改变。但培养基中的H+或OH-离子并不是直接作用在胞内酶蛋白上,而是首先作用在胞外的弱酸(或弱碱)上,使之成为易于透过细胞膜的分子状态的弱酸(或弱碱),它们进入细胞后,再进行解离,产生H+或OH-,改变胞内原先存在的中性状态,进而影响酶的结构和活性。当pH值为5.0时,产木聚糖酶活力达到最高,故选择该pH值作为最适宜的初始培养基pH值。
2.4 接种量对好食脉孢霉产木聚糖酶活力的影响
接种量是指接入发酵培养液中的种子培养液体积和发酵液体积之比。通常,较高的接种量可缩短发酵周期。但是,接种量过高会导致溶氧量不够,抑制菌体生长;接种量过低会使菌体生长缓慢,发酵延迟,导致产酶量降低。
发酵温度为28℃、转速为150 r/min、初始pH值自然条件下,分别选择接种量为0.5%、1.0%、3.0%、5.0%、7.0%进行试验,每组3个平行,发酵72 h后测定酶活。如图6所示,接种量以1.0%最佳,此时产生的木聚糖酶活力最高。
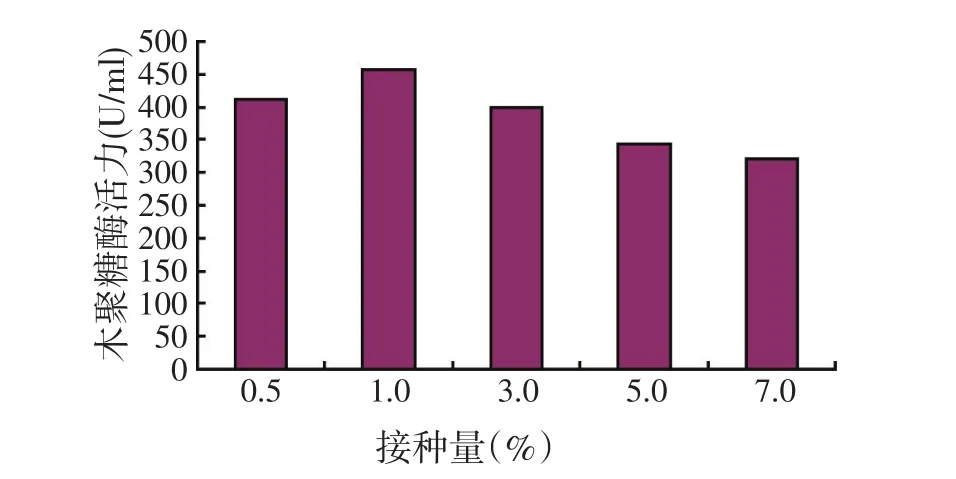
图6 接种量对好食脉孢霉产木聚糖酶活力的影响
2.5 培养时间对好食脉孢霉产木聚糖酶活力的影响
将液体种子以1%接种量接入装有50 ml发酵培养基的250 ml三角瓶中,在28℃、150 r/min培养24、48、60、72、84、96、108、120 h,测定木聚糖酶活力(见图 7)。
由图7可以看出,培养时间对该菌木聚糖酶的产生有显著影响。培养时间在72~84 h之内产酶活力较高,继续培养,酶活力逐渐下降,原因可能是培养液中可供好食脉孢霉利用的营养物质逐渐耗尽,微生物生长进入衰退期,故选择72 h为最佳发酵时间。
2.6 发酵温度对好食脉孢霉产木聚糖酶活力的影响
温度对好食脉孢霉生长代谢影响较大,低温会抑制其生长代谢,随着温度升高代谢速度加快,但是温度超过一定范围会引起菌体内酶的不可逆失活,从而引起菌体死亡。试验分别考察了菌株在20、25、28、32、36 ℃条件下产酶的情况(见图8)。

图7 培养时间对好食脉孢霉产木聚糖酶活力的影响

图8 发酵温度对好食脉孢霉产木聚糖酶活力的影响
如图8所示,温度对该菌木聚糖酶的生成有较大影响。培养温度为25~28℃时,有利于木聚糖酶的合成,此时木聚糖酶活力较高。低于25℃时温度偏低,菌体生长较慢,产酶活力较低;高于28℃时,菌体生长过于迅速,导致酶活力不高,所以选择在28℃下发酵。
2.7 摇床转速对好食脉孢霉产木聚糖酶活力的影响
好食脉孢霉为好氧微生物,其生长和产酶与氧气传递关系很大。摇瓶培养时,摇床的转速不仅决定了通气量,而且还会影响底物与菌体的接触。试验中对比了4种摇床转速(120、150、170、190 r/min)对菌体产酶的影响(见图9)。

图9 摇床转速对好食脉孢霉产木聚糖酶活力的影响
由图9可以看出,装液量相同的情况下,随着转速的增加,产酶活力发生先增大后减小的变化,这是由于转速对发酵液中溶解氧浓度、菌体与氧接触率两者有很大影响,需氧发酵并不是溶氧浓度越高越好,适当高的溶氧水平有利于菌体生长和产物合成。另外,转速过高产生的强剪切力作用不仅会使菌丝体受到损伤,不利于其生长,还会引起酶蛋白变性失活。当转速为150 r/min时,产木聚糖酶活力最高,达到476 U/ml,故选择150 r/min作为最佳转速。
3 结论
本文以豆渣和麸皮为主要原料,研究了好食脉孢霉菌株产木聚糖酶的液态发酵条件。以木聚糖酶的催化活力为指标,通过单因素试验法确定液态发酵培养基由3%麸皮水、10%豆渣和0.5%蛋白胨组成,用柠檬酸缓冲液调节培养基初始pH值为5.0,在28℃、150 r/min条件下培养72 h后木聚糖酶活力可达到476 U/ml。

