垂花百合鳞片离体培养研究
雷家军,徐 莹
(沈阳农业大学园艺学院,沈阳 110866)
垂花百合(Lilium cernuum Komar.)是百合科百合属多年生球根花卉,植株低矮,是百合属中少有的紫色种类,且有香味,是一种珍贵的野生百合资源。目前垂花百合自然分布的群体正在迅速减少[1]。由于垂花百合种子繁殖周期较长,鳞片扦插又很难在短期内获得大量植株。因此,有必要应用离体培养技术建立一套高效快繁体系,以利垂花百合资源的保存、研究和利用。国内外学者对百合离体培养进行了较多研究,从不同外植体愈伤组织诱导[2]、不同激素浓度[3]、蔗糖和活性炭[4-5]对不定芽的影响及杂种胚培养[6]等方面都有较多研究,但对垂花百合离体培养的研究却很少[7-9]。本试验以垂花百合鳞片为外植体进行诱导、增殖、生根和扦插试验,旨在为垂花百合离体快繁提供一套切实可行的技术措施,为其资源保护、快速繁殖及利用奠定基础。
1 材料与方法
1.1 材料
本试验于2010年5月~2011年7月进行。供试材料垂花百合(Lilium cernuum Komar.)取自辽宁省开原市,采集健壮的地下鳞茎,除去鳞茎表面泥土,去掉受损或发黄的鳞片,取中、外层鳞片为外植体。
1.2 方法
1.2.1 外植体消毒
将鳞片于流水下冲洗30 min,在超净工作台上用70%的酒精处理30 s后,用0.1%升汞分别浸泡8、10、12、14 min,然后用无菌水冲洗5遍,接种在培养基MS+BA 0.5 mg·L-1+NAA 0.5 mg·L-1上,统计外植体污染率和成活率,采用DPS软件进行数据分析,下同。污染率(%)=污染外植体数/接种外植体数×100%;成活率(%)=诱导不定芽外植体数/未污染外植体数×100%。
1.2.2 初代培养
垂花百合鳞片细长,将鳞片分为上、中、下三个部分,接种在MS+BA 0.5 mg·L-1+NAA 0.5 mg·L-1培养基上,30d后调查外植体诱导不定芽情况。诱导率(%)=诱导不定芽外植体数/接种外植体数×100%。
选中、下部鳞片为外植体,接种在6种培养基上:① MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1;② MS+BA 0.5 mg·L-1+NAA 0.5 mg·L-1;③ MS+BA 0.5 mg·L-1+NAA 1.0 mg·L-1;④ MS+BA 1.0 mg·L-1+NAA 0.1 mg·L-1;⑤ MS+BA 1.0 mg·L-1+NAA 0.5 mg·L-1;⑥ MS+BA 1.0 mg·L-1+NAA 1.0 mg·L-1。30 d后调查外植体诱导不定芽情况。离体培养条件为温度25℃,光照强度1 500 lx,光照时数12 h·d-1,下同。
1.2.3 继代培养
将初代培养诱导出的芽丛分成单株,转接在上述6种培养基上,30 d后调查不定芽增殖和生长情况。
1.2.4 生根培养
将继代增殖培养出的小苗分为单株,转接到3种培养基上:①1/2MS+IBA 0.5 mg·L-1;②1/2MS+IBA0.5mg·L-1+0.5g·L-1AC;③1/2MS+IBA1.0mg·L-1+0.5 g·L-1AC。20 d后调查组培苗生根情况。
1.2.5 炼苗移栽
在生根培养基中,待组培苗根系长至2~4 cm时,开瓶炼苗5~7 d后扦插于4种基质中:①草炭∶蛭石=1∶1;②草炭∶蛭石=2∶1;③河沙;④草炭,温室内正常管理。30 d后调查组培苗成活和生长情况。
2 结果与分析
2.1 不同消毒时间对鳞片消毒效果的影响
试验比较了70%酒精处理30 s后,再用0.1%升汞消毒不同时间对鳞片消毒效果的影响(见表1)。结果表明,用0.1%升汞浸泡12 min效果最好,污染率低(13.3%),且成活率高(92.6%);用0.1%升汞浸泡8 min,虽然外植体的成活率最高(100%),但其污染率(43.3%)极显著高于前者;用0.1%升汞浸泡14 min时,虽然污染率(8.3%)最低,但外植体成活率(65.6%)极显著低于其他各处理,因此消毒时间不宜过长。
2.2 鳞片不同部位对诱导不定芽的影响
鳞片接种7 d后逐渐由白色转为绿色,且部分鳞片表面呈现紫红色,20 d后鳞片边缘或表面出现白色或淡绿色粒状小突起,25 d后这些小突起相继长出浅绿色不定芽(见图1A)。鳞片不同部位的诱导率和再生芽数有较大差异(见表2)。下部鳞片诱导率最高(75.0%),且平均每个外植体可诱导出2.7个不定芽,极显著高于中部鳞片和上部鳞片。因此,下部鳞片是最佳的接种材料;其次为中部鳞片,诱导率为68.3%,平均每个外植体可诱导不定芽2.3个;而上部鳞片诱导率最低(38.3%),平均每个外植体诱导不定芽数极显著低于下部和中部鳞片,仅为1.5个。
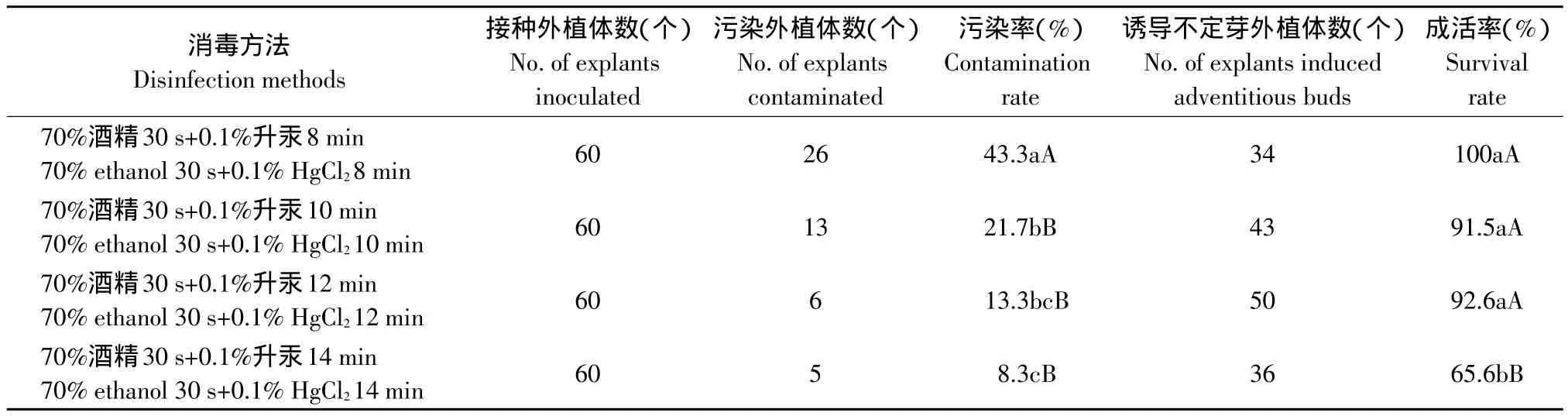
表1 不同消毒时间对垂花百合鳞片消毒效果的影响Table 1 Effect of different methods on disinfection of bulb scales of Lilium cernuum

图1 垂花百合鳞片不定芽的诱导(A)与增殖(B)Fig.1 Adventitious buds induction(A)and multiplication(B)in vitro from bulb scales of Lilium cernuum Komar.
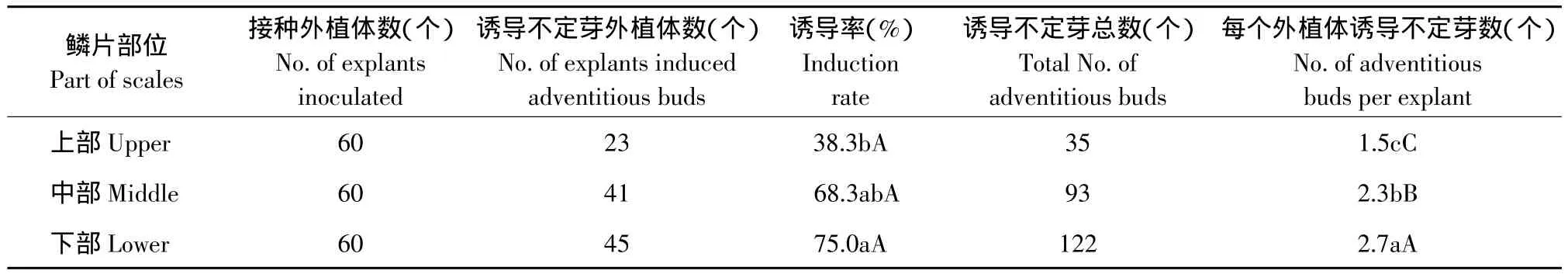
表2 垂花百合鳞片不同部位对诱导不定芽的影响Table 2 Effect of different parts of scales on inducing adventitious buds of Lilium cernuum
2.3 不同激素浓度对鳞片不定芽诱导和增殖的影响
垂花百合鳞片在6种培养基上均可诱导出不定芽,但不同激素浓度培养基上的诱导率和平均每外植体诱导不定芽数存在一定差异(见表3)。可以看出,随着BA/NAA的提高,诱导率逐渐降低,说明高比值的BA/NAA不利于垂花百合鳞片诱导不定芽。BA和NAA浓度同为0.5 mg·L-1或同为1.0 mg·L-1的两个培养基最适于鳞片诱导不定芽,即培养基MS+BA 0.5 mg·L-1+NAA 0.5 mg·L-1和 MS+BA 1.0 mg·L-1+NAA 1.0 mg·L-1是垂花百合鳞片最适诱导培养基,诱导率分别达到67.5%和72.5%,平均每外植体分别诱导2.4个和2.2个不定芽。垂花百合鳞片诱导出的不定芽转接在6种培养基上的增殖系数均在2.0以上(见表4)。试验观察到,虽然BA浓度变大时增殖系数变化不大,但植株生长缓慢,叶片稀少,因此,高浓度的BA不利于组培苗的生长。MS+BA 0.5 mg·L-1+NAA 1.0 mg·L-1为垂花百合最适增殖培养基,增殖系数为2.9,且植株生长健壮、整齐、生根多,平均株高可达6.8 cm(见图1B)。
2.4 不同激素浓度对组培苗生根的影响
垂花百合组培苗生根较快,15 d即可长出大量根系。组培苗接种在添加0.5 mg·L-1BA培养基上的生根率(99.4%)显著高于接种在添加1.0 mg·L-1IBA培养基(见表5),且根系生长健壮;随着IBA浓度升高,组培苗生根率下降,根较粗壮,有木质化现象,添加活性炭的培养基生根数显著少于不添加活性炭的培养基,根长度在各处理间无差异。因此,培养基1/2MS+IBA 0.5 mg·L-1较适宜诱导垂花百合组培苗生根。
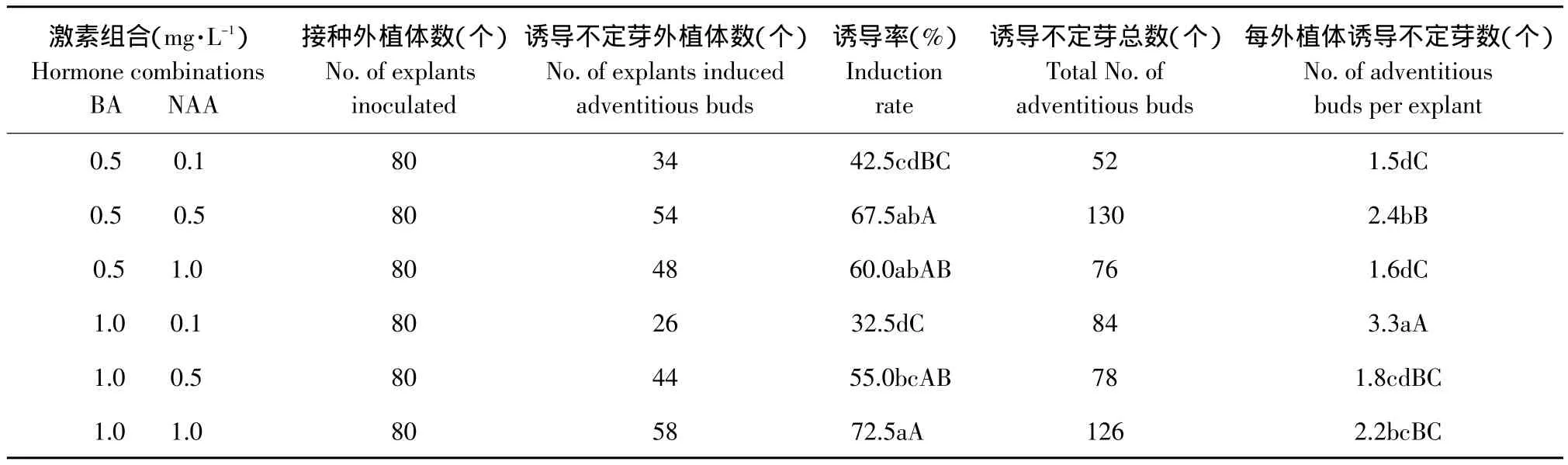
表3 不同激素浓度对垂花百合鳞片诱导不定芽的影响Table 3 Effect of different hormone concentration on inducing adventitious buds of Lilium cernuum
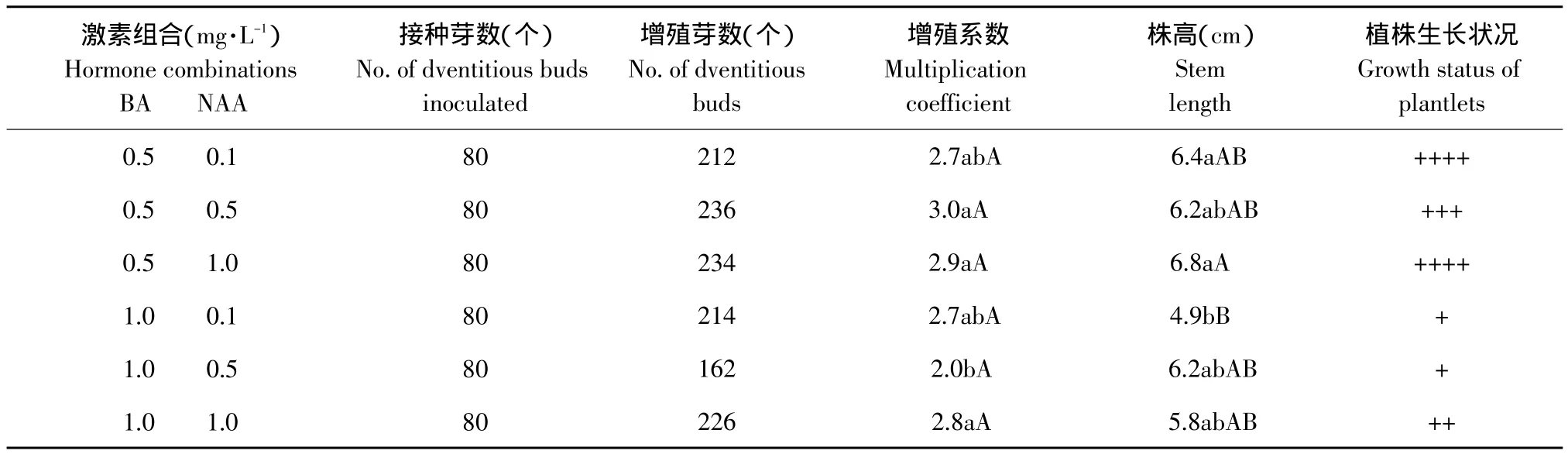
表4 不同激素浓度对垂花百合不定芽增殖的影响Table 4 Effect of different hormone concentration on adventitious buds multiplication of Lilium cernuum
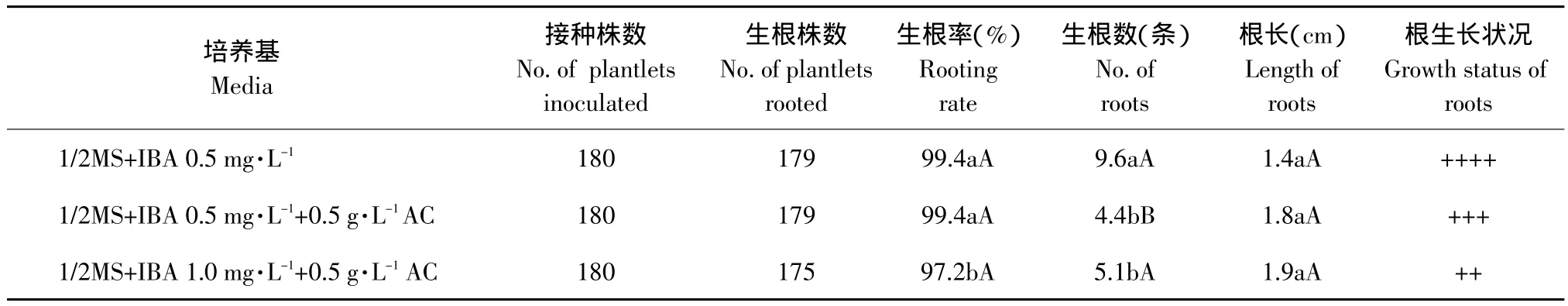
表5 不同激素浓度对垂花百合组培苗生根的影响Table 5 Effect of different hormone concentration on rooting of tube plantlets of Lilium cernuum
2.5 不同基质对组培苗扦插成活的影响
基质对垂花百合组培苗扦插成活有显著影响(见表6)。扦插在河沙上的组培苗成活率最高,达94.0%,且苗长势良好,其次是草炭∶蛭石(1∶1)和草炭∶蛭石(2∶1),而扦插在草炭上的组培苗成活率极显著低于其他各处理,仅为25%。
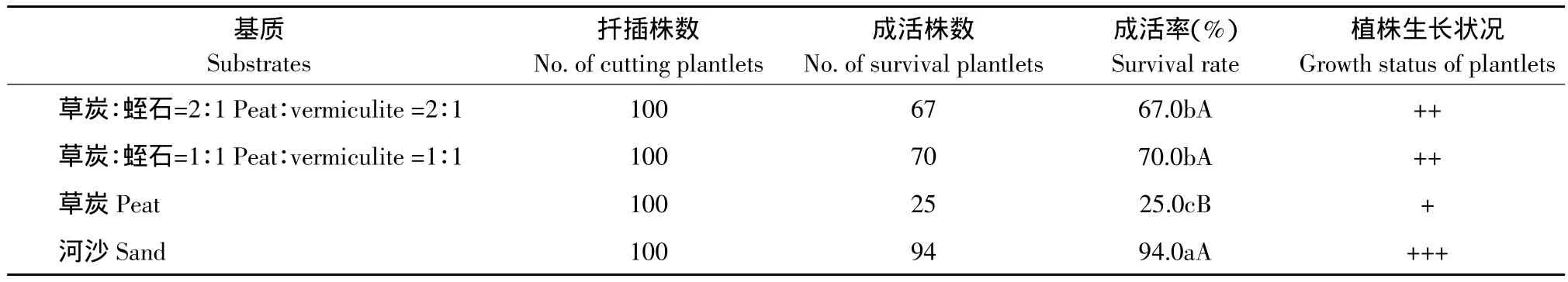
表6 不同基质对垂花百合组培苗扦插成活的影响Table 6 Effect of different media on tube plantlets survival of Lilium cernuum
3 讨论与结论
垂花百合可以采用鳞片离体培养短期内获得大量组培苗。其最佳消毒方法是70%酒精处理30 s再用0.1%升汞浸泡12 min,污染率低,且成活率高。随着消毒时间的延长,虽然污染率降低,但消毒液的毒害作用会导致外植体的成活率极显著降低。垂花百合鳞片不同部位诱导不定芽的能力差异显著,诱导能力从强到弱依次为:下部鳞片>中部鳞片>上部鳞片,可能是下部鳞片较肥厚,且细胞幼嫩,更易诱导出不定芽,而上部鳞片尖而薄,较老化,许多学者在松叶百合[7]、东方百合[10-11]、兰州百合和野百合[15]研究中也有类似的结论。合理的激素浓度配比是百合离体诱导的关键因素[11-12],垂花百合鳞片诱导不定芽对BA和NAA的浓度配比有一定要求,随着BA/NAA的增高,诱导率逐渐降低,这与王刚在兰州百合和野百合组培快繁中的结论一致[12],但与郭海滨在索邦百合鳞片离体诱导中的结果不一致[11],她认为BA/NAA为1.5/0.2时最适合不定芽分化,这可能与百合种类不同有关。
本试验观察到低浓度IBA有利于组培苗生根,IBA浓度过高,生根率下降,根变粗、且木质化,这与葛蓓孛等观察的细叶百合再生苗生根结果一致[13],同时,试验中发现:添加活性炭时,生根数明显减少,这与张素勤等在非洲菊研究中的结果[14]不一致,活性炭对不同植物生根的影响还需做进一步的研究和探讨。垂花百合组培苗扦插成活对基质有一定要求,在供试的三种基质中,河沙是最适合的扦插基质,这可能是因为河沙透气、排水性好,且较致密,有利于组培苗生根成活。
[1]雷家军,荣立苹,毕晓颖,等.辽宁省野生百合资源的调查与分类研究[J].沈阳农业大学学报,2008,39(2):161-164.
[2]柳玉晶,龚束芳,樊金萍,等.百合愈伤组织的诱导及植株再生[J].东北农业大学学报,2007,38(3):352-355.
[3]Dabrowski J,Dabski M,Kozak D.The influence of some growth regulators on regeneration of lily bulbs in vitro[J].Acta Horticulturae,1992,325:537-541.
[4]任亚萍,刘秀群,陈龙清.培养条件对卷丹试管鳞茎生长和膨大的影响[J].华中农业大学学报,2011,30(1):49-53.
[5]Langens-Gerrits M,Kuijpers A M,De Klerk G J,et al.Contribution of explant carbohydrate reserves and sucrose in the medium to bulb growth of lily regenerated on scale segments in vitro[J].Physiologia Plantarum,2003,117(2):245-255.
[6]雷家军,阮冰洁.大花卷丹与亚洲百合、东方百合种间杂交及胚培养研究[J].东北农业大学学报,2011,42(4):66-71.
[7]李海云,王中伟,刘艳芝,等.松叶百合的组织培养及其植株再生[J].中国球根花卉年报,2008:160-166.
[8]顾地周,赵淑玲,郭伟,等.条叶百合和垂花百合高效快繁体系的建立[J].福建农林大学学报:自然科学版,2009,38(3):243-247.
[9]王晓丽,韩立群,刘杰,等.活性炭和多效唑对垂花百合试管鳞茎膨大的影响[J].安徽农业科学,2011,39(19):11429-11430.
[10]侯娜,郭军战,王港,等.东方百合(Lilium oritential)组织培养研究[J].西北林学院学报,2008,23(3):120-122.
[11]郭海滨,雷家军,吴淑玲,等.索蚌百合鳞片的组织培养[J].东北林业大学学报,2011,39(8):30-32.
[12]王刚,杜捷,李桂英,等.兰州百合和野百合组织培养及快速繁殖研究[J].西北师范大学学报:自然科学版,2002,38(1):69-71.
[13]葛蓓孛,杨青杰,吴萍,等.细叶百合组织培养植株再生[J].东北林业大学学报,2010,38(5):54-59.
[14]张素勤,邹志荣,耿广东,等.几种因素对非洲菊试管苗生根的影响[J].西南大学学报:自然科学版,2007,29(8):76-78.

