cry2Aa9m抗虫基因植物表达载体构建及对大豆的遗传转化
朱延明,郜 庭,张 凤,柏 锡,才 华,纪 巍,罗 晓,3
(1.东北农业大学生命科学学院,哈尔滨 150030;2.塔里木大学生命科学学院,新疆 阿拉尔市 843300;3.中国科学院东北地理与农业生态研究所,哈尔滨 150081)
大豆(Glycine max L.Merr)是重要的油料作物和粮食作物,大豆食心虫(Leguminivora glycinivorella Mats.)在东北大豆产区普遍发生,给大豆生产带来重大损失。大豆食心虫属鳞翅目(Lepidoptera)小卷蛾科(Olethreutidae),是大豆的主要蛀荚害虫之一,其幼虫专门取食大豆荚部和籽粒,增加籽粒破损率,造成虫口和碎粒,严重影响大豆品质和产量。防治大豆食心虫的传统策略是喷洒化学农药和杂交育种培育抗虫新品种。喷洒化学农药防治,易破坏生态平衡造成污染环境;而杂交育种周期长、成本高,受基因资源的限制,不能在短期内获得理想的抗虫新品种。通过基因工程手段进行抗虫新品种培育,将是大豆新品种选育和种质资源创新的新方向。
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种革兰氏阳性土壤芽胞杆菌,在形成芽胞同时能产生杀虫晶体蛋白(Insecticidal crystal proteins,ICPs),又称伴胞晶体蛋白(Parasporal crystal protein)或δ-内毒素(δ-endotoxins)[1-2],其对鳞翅目(Lepidoptera)、双翅目(Diptera)、鞘翅目(Coleoptera)、膜翅目(Hymenoptera)、同翅目(Homoptera)、直翅目(Orthoptera)、食毛目(Mallophaga)等多种昆虫以及线虫、螨类和原生动物等具有特异性杀虫活性,而且各种Bt基因具独特的杀虫谱(Insecticide controlling spectrum)[3-4]。在众多的Bt基因中,cry2Aa基因编码的杀虫晶体蛋白对鳞翅目和双翅目幼虫具有显著杀虫活性[5],可防治大豆食心虫等害虫。
本研究构建了由豆荚特异性启动子Pmsg调控的cry2Aa9m基因的植物表达载体pCMB2A,以抗除草剂bar基因为筛选标记,通过农杆菌介导法对绥农28大豆子叶节进行遗传转化,获得抗性株系8株。经PCR和RT-PCR检测,结果证明cry2Aa9m基因已经整合到大豆基因组中并得以表达。
1 材料与方法
1.1 材料
植物材料选用绥农28大豆品种(由黑龙江省农业科学院绥化分院提供),大肠杆菌DH5α、农杆菌EHA105和植物表达载体pCMBA(均由东北农业大学生命科学学院植物生物工程研究室保存),质粒pUC57(含cry2Aa9m基因,由中国农科院植保所提供)。
1.2 方法
1.2.1 植物表达载体pCMB2A的构建
pUC57质粒和pCMBA质粒载体经大量提取与纯化后,分别用SacⅠ、XbaⅠ双酶切,酶切产物经1%TAE琼脂糖凝胶电泳,分别回收pUC57小片段和pCMBA大片段,通过T4DNA连接酶连接这两个片段,连接产物转化大肠杆菌DH5а感受态细胞,在含有Km的LB培养基平板上筛选转化菌落,提取质粒,SacⅠ、XbaⅠ双酶切鉴定转化子。经鉴定的重组子命名为pCMB2A。
1.2.2 重组载体转化农杆菌EHA105受体细胞
采用冻融法将已构建的植物表达载体pCMB2A转化根癌农杆菌EHA105,涂布在含有相应抗生素的YEB培养基上培养,待转化子长出后,随机挑选两个转化子的单菌落作为模板,用bar基因特异性 引 物(S: 5'TCTACCATGAGCCCAGAACG 3',AS:5'TCAAATCT CGGTGACGGGCA 3')对转化子进行PCR鉴定,扩增片段长度为570 bp,反应条件(25 μL体系)为:94℃预变性 10 min;94℃ 30 s,58℃30 s,72℃30 s,35个循环;72℃延伸10 min。
1.2.3 大豆遗传转化
1.2.3.1 外植体制备
挑选饱满、无病的大豆种子用氯气灭菌16 h,再置于萌发培养基,光周期18 h/6 h。萌发5 d后在子叶与下胚轴连接处切开,保留0.5 cm下胚轴,纵向平均分开2片子叶,去掉上胚轴和分化的顶芽、侧芽,在垂直于子叶与下胚轴连接处的有效分化部位轻划5~7刀,造成伤口。
1.2.3.2 菌液制备
从新鲜平板上挑取含有pCMB2A质粒的农杆菌单菌落,接种在含Kan 50 mg·mL-1,Sm 50 mg·mL-1,Rif 50 mg·mL-1的YEP液体培养基中,28℃,200 r·min-1振荡培养48 h。取出菌液,按1∶10进行第二次活化,28℃振荡培养,增殖至OD600=0.6,4 000 r·min-1离心5 min收集菌体,用液体共培养基重悬后备用。
1.2.3.3 遗传转化及筛选
将制备好的子叶节外植体置于菌液中,28℃,150 r·min-1振荡培养侵染30 min,再将侵染后的外植体进行共培养;3~5 d后取出外植体,用含有250 mg·L-1Cefotaxime和50 mg·L-1Amoxicillin的液体芽诱导培养基冲洗3遍,再用无菌滤纸吸掉多余液体,近轴面朝上30~45°接入不定芽诱导培养基;14 d后转入含2 mg·L-1Glufasinate的芽诱导培养基中进行筛选培养;经过28 d的不定芽诱导后,将外植体接入伸长培养基继续培养,每14 d继代1次。
1.2.3.4 伸长芽的生根及移栽
待不定芽伸长到3~5 cm时,将其从芽基部剪下,在1 mg·mL-1的IBA中浸润2 min后转至生根培养基中;至根长到2~3 cm时开瓶驯化,2~3 d后洗净根部培养基,移栽到混合土(蛭石∶珍珠岩∶上层土壤=1∶1∶1),散射光下覆膜保湿培养,约3~5 d后转入正常光下培养,培养条件为24℃,1 500 lx、每天光照16 h,80%湿度。
1.2.4 抗性植株的分子生物学检测
1.2.4.1 抗性植株的PCR检测
取大豆T0、T1代抗性植株叶片,用CTAB法提取基因组DNA;应用cry2Aa9m基因特异性引物(S:5'ATTTGCGATGCGTACAATGTGG 3',AS:5'CGTAAGGTTGCTGCTGAAATGC 3')进行 PCR检测,扩增片段长度为582 bp,反应条件(25 μL体系)为:94℃预变性10 min;94℃30 s,56℃30 s,72℃30 s,35个循环;72℃延伸10 min。PCR产物经2.0%琼脂糖电泳检测。
1.2.4.2 抗性植株的RT-PCR检测
取大豆T1代PCR阳性植株豆荚,用RNAprep Plant Kit试剂盒提取样品的总RNA,纯化后,以SuperScriptTMⅢReverse Transcriptase试剂盒进行反转录,合成cDNA第一条链,再以反转录产物为模板进行PCR反应,反应条件与对照同1.2.4.1,PCR产物经2.0%琼脂糖电泳检测。
2 结果与分析
2.1 植物表达载体的构建
植物表达载体的构建见图1。SacⅠ和XbaⅠ双酶切鉴定重组子,如图2泳道3所示,切出2.0 kb和11.0 kb两条带。证明该质粒确为重组质粒,命名为pCMB2A,其筛选标记基因为bar基因,目标基因cry2Aa9m的上游调控区包括Pmsg启动子和植物翻译起始密码子共有序列(AACAATG),下游包括大豆常用终止密码子TAA和一段多联终止密码子,以及Tnos终止子序列。
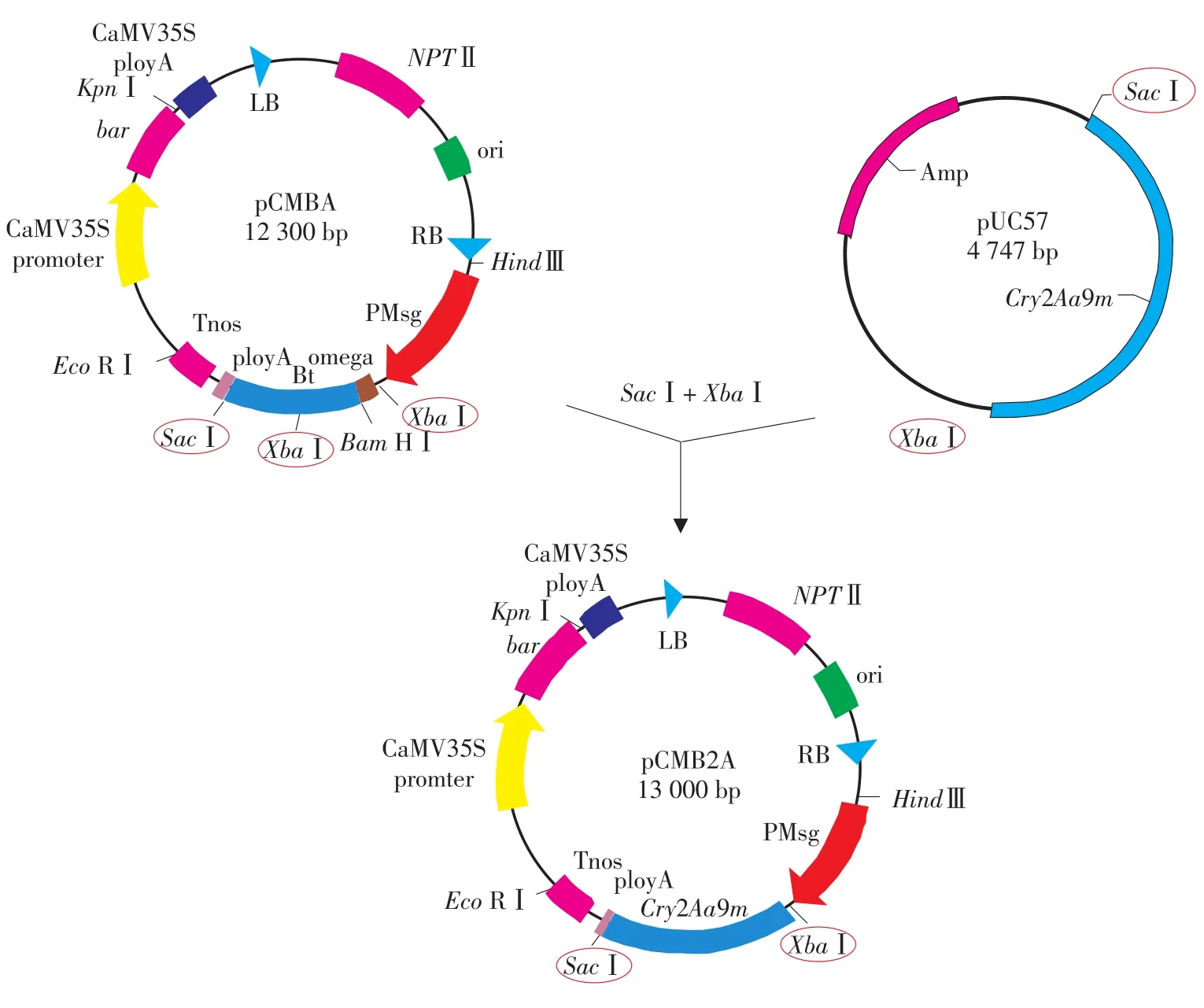
图1 植物表达载体pCMB2A的构建Fig.1 Construction of plant expression vector pCMB2A

图2 植物表达载体pCMB2A的酶切鉴定Fig.2 Characterization with endonucleases of plant expression vector pCMB2A
2.2 重组载体转化农杆菌EHA105受体细胞
待转化子长出后,以转化子的单菌落为模板,用bar基因特异性引物对转化子进行PCR检测。由图3可知,泳道1~2均扩增出约570 bp的条带,证明重组质粒pCMB2A已导入根癌农杆菌中,可用于下一步的遗传转化。
2.3 抗性植株的获得
经农杆菌侵染后,将外植体进行共培养(见图4A);3~5 d后取出外植体,洗净,转至不定芽诱导培养基(见图4B);14 d后接入含Glufasinate的芽诱导培养基中进行筛选培养(见图4C);经过28 d的不定芽诱导后,将外植体接入伸长培养基继续培养,每14 d继代1次(见图4D);待不定芽伸长到3~5 cm时,转至生根培养基中(见图4E);根长至约2~3 cm后,驯化、移栽(见图4F)。经过不定芽的诱导及筛选、不定芽的伸长、生根诱导,最终从1 000个绥农28子叶节外植体筛选获得8株抗性植株。

图3 植物表达载体转化农杆菌PCR鉴定结果Fig.3 PCR result of transforming Agrobacterium

图4 大豆遗传转化及再生Fig.4 Transformation and regeneration of soybean
2.4 抗性植株PCR检测
2.4.1 T0代植株PCR检测
CTAB法提取上述抗性植株的基因组DNA。以抗性植株的总DNA为模板,质粒pCMB2A为阳性对照,分别以水和同一品种未转化植株的总DNA为阴性对照I和阴性对照II,进行PCR检测。其中4株能扩增到与目的片段大小一致的条带(582bp),初步获得4株PCR呈阳性的转化植株。PCR部分结果见图5。
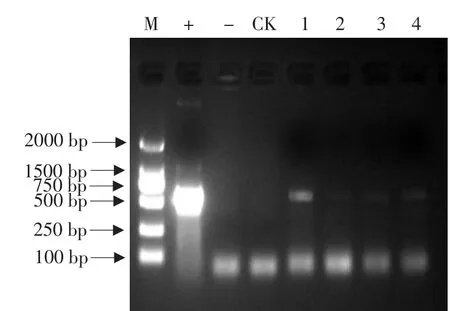
图5 抗性植株PCR检测Fig.5 PCR detection of Glufasinate resistant plants
2.4.2 T1代植株的PCR检测
收获T0代PCR阳性的转基因植株种子15粒,播于温室中,待长出第1片三出复叶时,提取抗性植株和未转化植株总DNA,用cry2Aa9m基因特异性引物进行PCR检测。其中4株能扩增到与目的片段大小一致的582 bp条带,获得4株PCR呈阳性的T1代植株。PCR结果见图6。

图6 T1代植株PCR检测Fig.6 PCR detection of T1 plants
2.5 T1代植株的RT-PCR检测
提取T1代4株PCR阳性植株和1株未转化植株豆荚的总RNA,经RT-PCR检测,4株PCR阳性植株均能扩增约582 bp相近的特异条带,未转化植株未能扩增目的片段,这说明外基因在这4株PCR阳性植株中能反转录成cDNA。RT-PCR电泳结果见图7。

图7 T1代植株RT-PCR检测Fig.7 RT-PCR detection of T1 plants
3 讨 论
3.1 cry2Aa9m抗虫基因的选择
目前已发现cry2Aa基因共14种[6],其ICPs的氨基酸序列同源性达95%以上,只是毒素稍有不同,且都具有知识产权。本研究所用cry2Aa9m基因是由中国农科院植保所从苏云金芽胞杆菌B-8-G菌株中克隆出野生型cry2Aa9基因后,再经人工改造而获得的在植物细胞中高效表达的一种cry基因[7]。
与其他cry基因相比,cry2Aa基因的氨基酸序列同源性只有17%~20%[8],系统生物学研究表明,在早期的进化过程中,cry2Aa基因有可能与cry11A、cry18A形成一个独立的群体而远离其他cry基因[9]。在众多cry基因中,cry2Aa基因以杀虫谱广、杀虫效率高而著称,其对鳞翅目和双翅目幼虫具有显著的杀虫活性。对于鳞翅目昆虫,Cry2Aa蛋白的毒力远高于现在广泛应用的Cry1A蛋白[10-11],而且通过BBMV结合试验表明[12],Cry2Aa蛋白与Cry1A蛋白具有不同的结合位点,昆虫对这两种蛋白不容易产生交互抗性。
应用基因工程技术,筛选和克隆毒力高、杀虫谱广的cry基因和基因组合,重组改造天然菌株基因,构建高产稳定的工程菌,扩大杀虫谱,增强杀虫效率,是解决大豆食心虫普遍发生的有效途径,因而本试验选用独特的cry2Aa9m基因对大豆进行遗传转化极具应用前景。
3.2 组织特异性启动子的选择
启动子是决定外源基因转录效率的关键因素,选择合适的启动子对于增强外源基因的表达量至关重要[13]。采用组成型启动子调控Bt基因,会导致杀虫毒蛋白在植物各个部位均表达并积累,不但浓度较低,还会杀死大量有益昆虫,而且外源基因在受体植物中非特异性的持续、高效表达往往造成浪费,却在需要该基因大量表达的时间或特定组织部位又因表达量过低而达不到预期效果[14],选择组织特异型启动子则可解决这一难题。在组织特异型启动子调控下,基因表达常常只发生在某些特定器官或组织部位,并表现出发育调节的特性。大豆食心虫具有入荚后先蛀食豆荚组织的习性,使用豆荚特异性启动子(Pmsg)调控cry2Aa9m基因[15],将其毒蛋白专一表达在豆荚上,则虫食豆荚后即摄入杀虫毒蛋白,而人食用不含该毒蛋白的大豆种子,这种策略不但可以控制大豆食心虫的危害,还可以解决食品安全性问题。
4 结论
a.构建了由豆荚特异性启动子Pmsg调控具有抗大豆食心虫功能的cry2Aa9m基因的植物表达载体pCMB2A。
b.以抗除草剂bar基因为筛选标记,通过农杆菌介导法转化绥农28大豆子叶节,获得抗性株系8株;经PCR和RT-PCR检测结果证明,cry2Aa9m基因已经整合到大豆基因组中并表达。
[1]Schnepe E,Crickmore N,Vanrie J,et al.Bacillus thuringiensis and its pesticidal crystal proteins[J].Microbiology and Molecular Biology Reviews,1998,62(3):775-806.
[2]Bravo A,Gill S,Soberon M.Mode of action of Bacillus Cry and Cyt toxins and their potential for insert[J].Toxicon,2007,49(4):423-435.
[3]黄大昉,林敏.农业微生物基因工程[M].北京:科学出版社,2001:175-270.
[4]李海燕,朱延明,马凤鸣.植物抗虫基因工程的研究进展[J].东北农业大学学报,2000,31(4):399-405.
[5]Donovan W P,Dankocsik C C,Gilber M P.Amino acid sequence and entomocidal activity of the P2 Crystal protein[J].The Journal of Biological Chemistry,1988,263(1):561-567.
[6]Bt toxin specificity database.Bacillus thuringiensis toxin nomenclature[EB/OL].[2011-03-24].http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt.
[7]李海涛,郭巍,宋福平,等.苏云金芽孢杆菌cry2Aa基因的克隆、表达与活性[J].农业生物技术学报,2005,13(6):787-791.
[8]Hofte H,Whiteley H R.Insecticidal Crystal proteins of Bacilllus thuringiensis[J].Microbiology and Molecular Biology Reviews,1989,53(2):242-255.
[9]de Maagd R A,Bravo A,Crickmore N.How Bacillus thuringiensis has evolved specific toxins to colonize the insect world[J].Trends Genet,2001,17(4):193-199.
[10]Kota M,Daniell H,Varma S,et al.Overexpression of the Bacillus thuringiensis(Bt)Cry2Aa2 protein in chloroplasts confers resistance to plants against susceptible and Bt-resistant insects[J].Agricultural Sciences,1999,96(5):1840-1845.
[11]吴洪福,郭淑元,李海涛,等.苏云金芽孢杆菌杀虫晶体蛋白结构和功能研究进展[J].东北农业大学学报,2009,40(2):118-122.
[12]Liang Y,Dean D H.Location of a lepidopteran specificity region in insecticidal crystal protein CryIIA from Bacillus thuringiensis[J].Molecular Microbiology,1994,13(4):569-575.
[13]朱祯.走向21世纪的植物分子生物学[M].北京:科学出版社,2000:121-122.
[14]皮灿辉,易自力,王志成.提高转基因植物外源基因表达效率的途径[J].中国生物工程杂志,2003,23(1):124.
[15]Stromvik M V,Sundararaman V P,Vodkin L O.A novel promoter from soybean that is active in a complex developmental pattern with and without its proximal 650 base pairs[J].Plant Molecular Biology,1999,41(2):217-231.

