大豆花柱和柱头的显微结构观察
王学东,于 洋,刘 岩,崔 琳
(东北农业大学生命中心,哈尔滨 150030)
大豆(Glycine maxL.Merr.)隶属于豆科(Fabaceae)蝶形花亚科(Papilionoideae)大豆属(Glycine),一年生草本植物[1]。它是重要的粮食作物和油料作物,也是人类和动物营养以及工业原料、脂肪酸和蛋白质的重要来源[2],在世界粮食作物构成和国际油料作物生产中占有重要地位,在我国农业生产和食物消费系统中起重要作用[3]。无限型开花大豆品种东农434由东北农业大学大豆研究所选育,它以高油资源作亲本,经有性杂交和后代加强油性测定选育而成,适合黑龙江省东南部地区种植。
雌蕊是植物重要的生殖结构,根据植物形态学概念,构成雌蕊的单位是心皮,无论是合生心皮还是离生心皮,均可以分化出下部能育的子房和上部不育的花柱,花柱上部扩展形成柱头。被子植物的有性生殖是一个复杂过程,它依赖花粉和雌蕊间的相互作用[4]。在被子植物受精过程中,花粉落到柱头上萌发,长出花粉管,花粉管通过花柱进入胚囊,最终完成雌雄配子的融合,由此可见花柱和柱头在受精过程的重要作用[5]。
不同植物种类柱头、花柱结构存在极大差异,通常把柱头分为干柱头和湿柱头2类,花柱分为实心、半实心和开放型3类[6]。不同类型的柱头、花柱在接受花粉萌发、花粉管在花柱中的生长方式不同[7]。目前对多数植物柱头和花柱所属的类型已基本清楚。大豆为湿柱头,中空花柱。但对大豆柱头和花柱显微结构的研究还很少,对大豆花柱和柱头细胞中细胞器分布情况也尚不清楚。本文对大豆柱头和花柱的超微结构进行观察,可作为大豆繁殖生物学研究内容的重要组成部分。
1 材料与方法
1.1 材料
大豆品种东农434(Glycinemax L.Merr.cv.Dongnong434)。
1.2 方法
试验材料于2011年4月29日在东北农业大学校内盆栽种植,并于2011年6月至7月间取植株三、四节部位不同发育时期的花蕾,剥其花萼及花瓣,将子房分别固定于pH 6.8、2.5%戊二醛固定液中。
扫描电镜样品制备:经pH 6.8、2.5%戊二醛固定、0.1 mol·L-1PBS冲洗、乙醇系列脱水、叔丁醇置换,ES-2030(HITACHI)型冷冻干燥仪干燥,粘样,E-1010(HITACHI)型离子溅射镀膜仪镀金膜,S-3400N(HITACHI)型扫描电镜观察。
透射电子镜样品制备:采用常规植物样品电镜制样方法,经戊二醛和四氧化锇双固定、乙醇系列脱水、环氧树脂812包埋,AO-ULTRACUTE型超薄切片机切片,柠檬酸铅和乙酸双氧铀双重染色,H-7650(HITACHI)型透射电镜观察。
光学显微镜样品制备:样品处理与透射电镜处理一致,然后将包埋块用AO-ULTRACUTE型超薄切片机进行半薄切片,切片厚度1 μm,切片用碱性品红和甲苯胺蓝进行定性染色[8],封片后置于DM/LS(LEICA)型光学显微镜下观察并记录图像。
2 结果与分析
2.1 柱头的形态结构
从大豆柱头的表面扫描电镜观察(见图版Ⅰ-1~4),大豆的柱头具乳突,柱头表面上的乳突细胞接近于圆形,但柱头与花柱交接处的乳突成棒状,表面非常光滑,排列2~3层,一般长度为22~25 μm。柱头表面的乳突上有分泌物存在,分泌物随着柱头的发育而不断增多。柱头表面的乳突上覆盖一层表膜,表膜很薄、很脆弱。同时,因为大豆为湿柱头,授粉后花粉粒落到柱头表面时被大量的分泌物所包围和覆盖,为花粉萌发提供适宜的环境条件。
从大豆柱头横切面观察(见图版Ⅰ-5~8),细胞排列紧密,外缘表皮细胞排列整齐,呈长的棒状;细胞壁之间有胞间连丝,细胞质稠密,细胞核较大,细胞质较稠密,含有大量叶绿体、质体,质体主要包含淀粉粒和小的稠密的脂质,一些质体包含蛋白晶体;液泡体积较大,大液泡内一般沉积有电子致密的贮藏物质,但是贮藏物质在液泡内存在形式不同,一类液泡内的贮藏物质均匀分布,另一类液泡内的物质则集中分布在液泡的边缘。柱头细胞从边缘向中心细胞体积逐渐减小,柱头内部细胞的体积较小,液泡体积也较小,内层细胞的液泡中几乎不含沉积的电子致密物。
2.2 花柱的形态结构
在扫描电镜下(见图版Ⅱ-1~3),大豆花柱成倒“J”形,靠近柱头部分发生弯曲。花柱表皮层由角质化的薄壁细胞构成,细胞多为长条形,排列规则,轮廓清晰,其长轴与花柱平行。花柱基部表皮表面有气孔,属无规则型,有的气孔突出表面。花柱基部有表皮毛,柱头下方则没有表皮毛。
从大豆花柱横切面观察(见图版Ⅱ-4),大豆花柱属于开放型花柱即空心花柱,花柱细胞横切面近似于椭圆形,细胞排列紧密。其中央部分有一个自上而下渐宽的中空花柱道,是一个心皮边缘结合形成的内部空间,花柱道一直延伸至子房中。从结构上看(见图版Ⅱ-5),花柱道周围有一层通道细胞。通道细胞的细胞质浓厚,细胞核较大;细胞内分布着小而多的液泡,液泡内含有较少的电子致密物质;通道细胞含有丰富线粒体和内质网,也含有质体,质体包含淀粉粒和小的脂质(见图版Ⅱ-6)。花柱的基本组织细胞较大,细胞内有大液泡,液泡内贮藏物质丰富,贮藏物质的形态与柱头相似(见图版Ⅱ-7)。基本组织细胞中分布有维管束,维管束与基本组织细胞相比,较小,而且是独立的;细胞壁之间有胞间连丝,细胞质稠密,核糖体和线粒体较丰富,也含有粗糙内质网,高尔基体和微体相对较少(见图版Ⅲ-1~2)。花柱表皮细胞是一层排列整齐,体积较大的薄壁细胞,表皮细胞包含大量叶绿体(见图版Ⅲ-3~4)。花柱中,无论是通道细胞还是基本组织细胞和表皮细胞,都包含丰富的淀粉粒,而且淀粉粒也包含膜结合的晶体。花柱细胞的细胞壁染色相对较浅。细胞壁上有发达的壁内突结构,细胞壁之间存在胞间连丝,使花柱细胞具有传递细胞的特征。
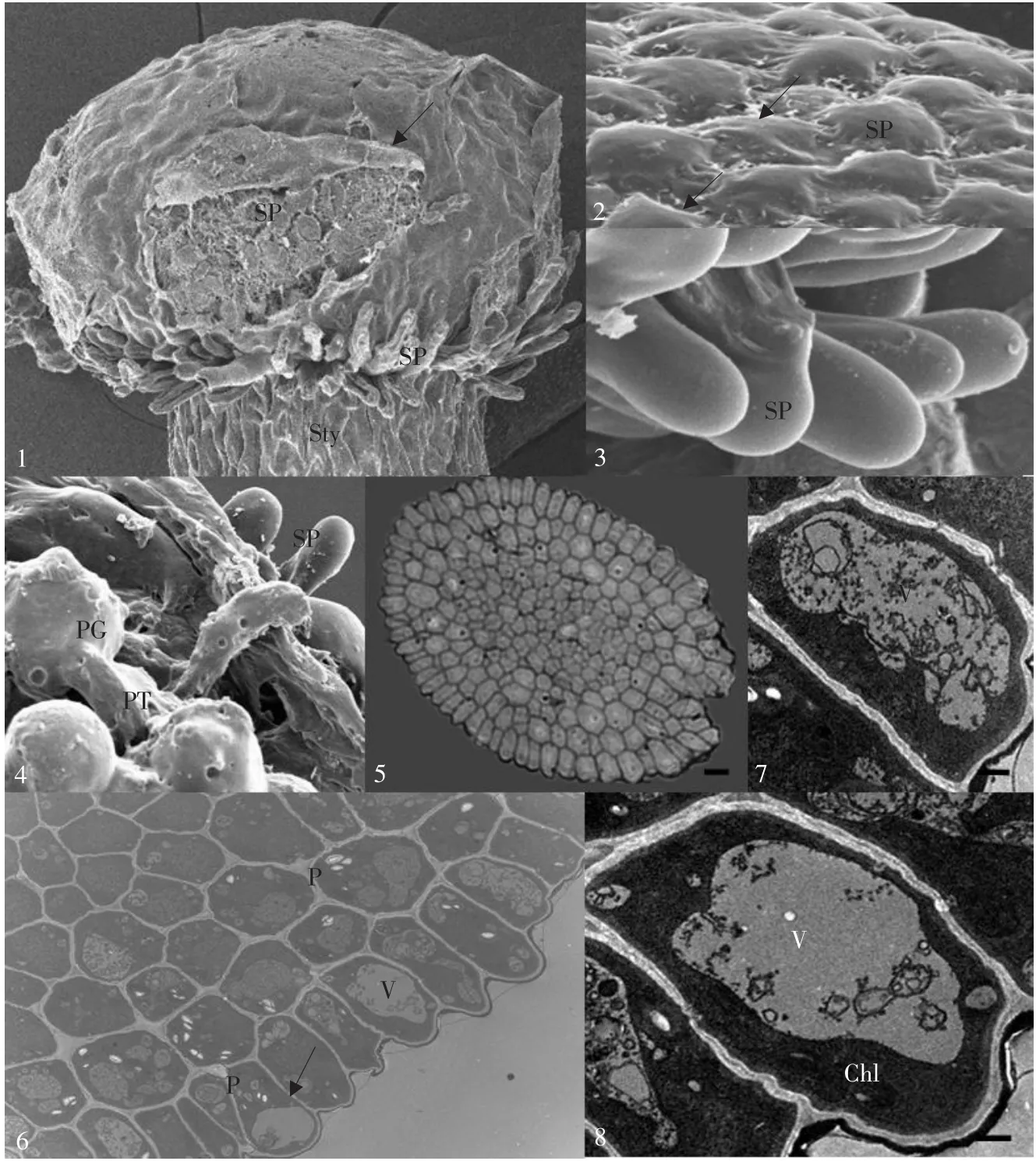
图版Ⅰ 大豆柱头显微结构PlateⅠMicrostructure of soybean stigma
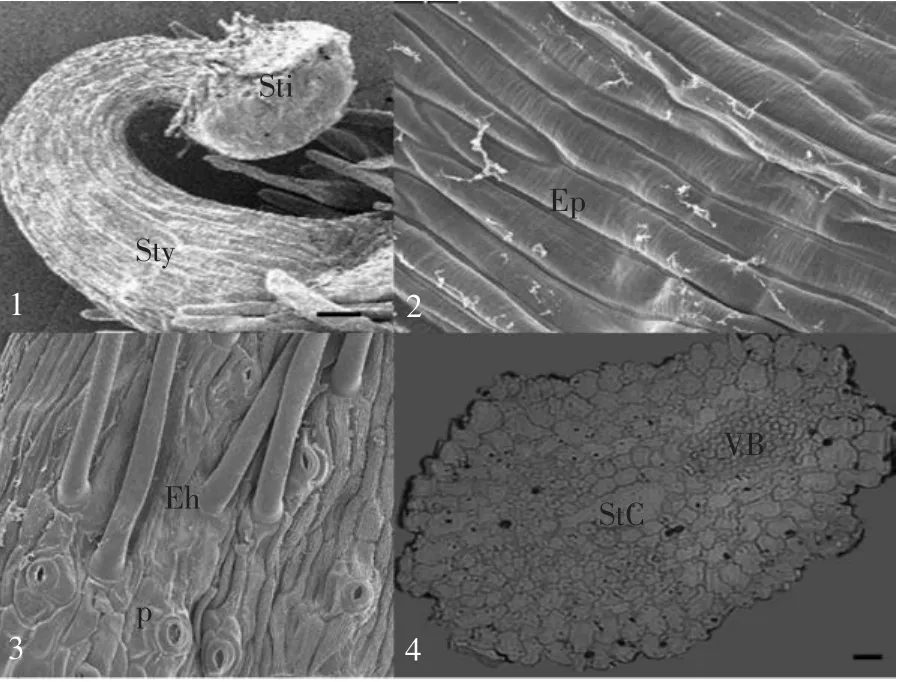
图版Ⅱ 大豆花柱的扫描电镜及光镜观察PlateⅡ Scanning electron microscopy and light microscope view of soybean style
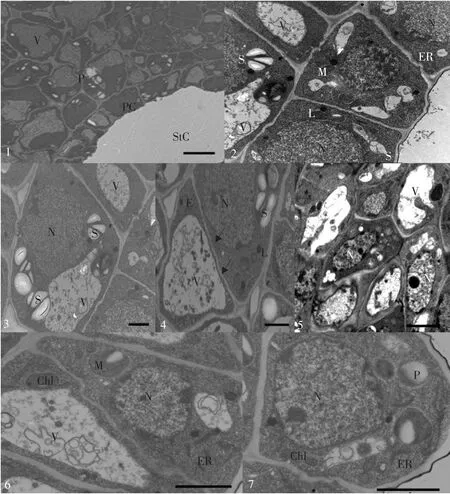
图版Ⅲ 大豆花柱表皮和基本组织的超微结构PlateⅢ Ultrastructure of epidermis and ground tissue of soybean style
3 讨论与结论
大多数被子植物的柱头都有乳突结构。一些植物乳突结构的角质膜外有一层蛋白质表膜,在花粉的附着吸水、花粉与柱头的相互识别过程中起重要作用[9]。本试验观察显示,大豆柱头表面的近圆形乳突上有一层蛋白质表膜;但是大豆柱头与花柱之间的棒状乳突并未被表膜覆盖,其上分泌物也较少,在处理样品过程中棒状乳突极易失水而变得干瘪。授粉时花粉一般不落到棒状乳突上,这说明棒状乳突并不参与花粉与柱头的相互识别过程,只有柱头表面的近圆形乳突参与这一识别过程。在观察不同时期的柱头表面时发现,柱头表面的近圆形乳突比棒状乳突发育较早。柱头上的表膜很薄,极易破碎,在花粉落到表膜上时,表膜易被分泌物所分解。通过观察大豆不同时期的柱头,发现分泌物随着柱头的不断成熟而增多,当花粉落到柱头上时,柱头乳突细胞会分泌大量渗出物,能够激活花粉并使花粉管持续增长。但还有较大比例的花粉管在花柱内生长过程中萎缩,并没有到达子房。根据前人研究结果[10],试验认为大豆中的这种现象也是自然选择结果,即花粉管增长速度和配子体遗传优势的竞争,能够调控其个体生长和影响受精。
大豆柱头表面细胞壁之间有胞间连丝,表明柱头细胞具有传递细胞的特征。传递细胞在生殖器官中分布广泛[11],其主要功能为:向周围环境或组织分泌物质,或者从周围环境或组织吸收物质[12]。大豆柱头细胞的传递细胞结构,可能有利于柱头细胞之间传递物质,并有利于柱头细胞向柱头表膜分泌参与花粉与柱头相互识别作用的物质。
柱头细胞和花柱细胞的液泡内有丰富的贮藏蛋白质,这些组织细胞内也含有丰富的多糖类物质,这些蛋白质及多糖类物质可能用于合成柱头分泌物,以及为花粉管在花柱中的生长提供营养。
大豆花柱中的通道细胞具有分泌功能,向着花柱道一面的细胞壁有十分显著的内突,质膜沿内突表面分布,增加细胞的表面积;通道细胞也具有传递细胞的功能,可以迅速地从周围细胞中吸收溶质并转运到花柱道中。花柱的基本组织细胞,特别是靠近通道细胞的薄壁细胞代谢活跃,并且含有丰富的淀粉粒,这些淀粉粒是营养物质的部分来源[13],而营养物分泌到细胞壁,并通过细胞壁上的胞间连丝向内运输,因而营养物在这些薄壁细胞的壁中由外向内形成一个梯度,最后由通道细胞内表面的壁释放到花柱道中,为萌发的花粉管提供营养。而且在开花期间,将粘性物质释放在花柱道的表面上,花粉管沿着花柱道的表面分泌液生长,直至到达子房。
[1]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1979.
[2]苗兴芬.多年多点条件下大豆脂肪酸含量QTL分析[D].哈尔滨:东北农业大学,2010:1-2.
[3]肖丹娜.中国大豆贸易地位及国际竞争力的研究[D].天津:天津财经大学,2010:9-10.
[4]Graa B H J,Derksen J W M,Mariani C.Pollen and pistil in the progamic phase[J].Sex Plant Reprod,2001,14:41-45.
[5]闫守伟,张素丽,张国军,等.不同葡萄品种柱头、花柱发育与种子形成的关系[J].西北植物学报,2007,27(3):435-441.
[6]刘宁.花柱和柱头的结构[J].植物学通报,1998,33(4):15-17.
[7]Anna F E,Rober S,Daphne P.Pollen and stigma structure and function:The role of diversity in pollination[J].Plant Cell,2004,16:84-97.
[8]胡适宜,徐丽云.显示环氧树脂厚切片中多糖蛋白质和脂类的细胞化学方法[J].植物学报,1990,32(11):841-846.
[9]孟金陵.植物生殖遗传学[M].北京:科学出版社,1995:50-53.
[10]Ottaviano E,Sari-Gorla M,Mulcahy D L.Pollen tube growth rates in Zea mays:Implications forgenetic improvement of crops[J].Science,1980,210:437-438.
[11]Folson M W,Cass D D.Changes in transfer cell distribution in the ovule of soybean after fertilization[J].Can J Bot,1986,64:965-972.
[12]李正理,张新英.植物解剖学[M].北京:高等教育出版社,1983:76-96.
[13]王艳杰,刘林德,孔冬瑞,等.刺五加雌、雄花的花柱引导组织结构观察[J].电子显微学报,2011,30(4/5):460-465.

