基于64排螺旋CT扫描数据的肝血管解剖变异分析
唐敏,杨尚文,王磊,何健,杨献峰,朱斌
近年来,随着科技的发展以及循证医学、人文医学等现代医学理念的兴起,肝脏外科逐渐跨入了精准肝切除时代。精准肝切除涵盖了以手术为核心的外科治疗全过程,包括术前评估、手术规划、术中操作和术后管理等[1]。其中基于数字外科平台的肝脏三维定量分析及模拟手术系统可在数分钟内对肝脏/肝段、肿瘤及血管进行自动化分割及定量分析,精确定位肝肿瘤,了解肿瘤与肝血管的关系,并在此基础上进行合理的手术设计,实施个体化的精准肝切除手术。本研究基于64排螺旋CT增强扫描数据,采用EDDA IQQA-liver CT影像解读分析系统三维定量分析与显示肝血管,观察其正常解剖及变异,探讨其应用价值。
材料与方法
连续搜集本院2012年1月-6月行64 MSCT行上腹部增强患者的CT资料,排除存在可能改变肝脏解剖结构的病理状态的病例(主要包括巨大肝肿瘤)和图像质量差(主要是血管增强幅度不够)的病例。最后共纳入200例,其中正常者68例,肝细胞癌49例,肝小囊肿19例,血管瘤35例,胆囊癌9例,胆管细胞癌7例,转移瘤10 例,肝局灶性结节增生3 例。男112例,女88例,年龄22~76岁,平均53岁。
采用GE LightSpeed 64VCT扫描仪,扫描参数:管电压120kV,管电流580mA,球管旋转时间0.8s/r,层厚5mm,螺距1.375。标准重建,层厚1.25mm,矩阵512×512。对比剂使用欧乃派克(350mg I/ml)1.5ml/kg,注射速率4.0~4.5ml/s,动脉期采用智能追踪技术,以腹主动脉腹腔干层面为兴趣区,设定触发阈值150HU,触发后延迟时间为5~6s。门静脉与肝动脉时间间隔17~18s、肝静脉与门静脉时间间隔18~19s。
将原始数据传送至EDDA IQQA-liver肝脏CT诊断辅助分析系统。按要求导入动脉期、静脉期数据,选择大三维模式,先进行肝脏分割,再进行血管分割,包括动脉分割、肝脏静脉分割。
门静脉分型:根据Couinaud[2]和Atri等[3]的方法分为4 型。Ⅰ型:普通型。Ⅱ型:门静脉主干(main portal vein,MPV)呈三叉状分为门脉左支(left portal vein,LPV)、右 前 支(right anterior portal vein,RAPV)和 右 后 支(right posterior portal vein,RPPV);Ⅲ型:MPV 先发出RPPV,继续向右上行分为RAPV 和LPV。Ⅳ型:MPV 先发出RPPV,RAPV 起自LPV。其他变异包括门脉左支水平段缺如及门脉右支缺如。
肝静脉分型:根据其汇入下腔静脉(inferior veno cava,IVC)的不同方式分为两型:Ⅰ型:肝右静脉(right hepatic vein,RHV)单独汇入IVC,肝左静脉(1eft hepatic vein,LHV)和肝中静脉(middle hepatic vein,MHV)合并后汇入IVC;Ⅱ型:RHV、MHV 和LHV 分别单独汇入IVC。根据Nakamura[4]分型标准,对RHV 分型:Ⅰ型RHV 粗大,引流肝右叶大部分,伴有小的或不伴右后下肝静脉(inferior right hepatic vein,IRHV);Ⅱ型RHV 中等大小,IRHV 中等大小;Ⅲ型只有引流Ⅶ段的短小的RHV,MHV 粗大,IRHV 较粗大。
肝动脉分型:采用Michels 分型标准分为10型[5]。Ⅰ型:正常型。Ⅱ型:替代肝左动脉(replaced left hepatic artery,rLHA)起自胃左动脉(left gastric artery,LGA)。Ⅲ型:替代肝右动脉(replaced right hepatic artery,rRHA)起自肠系膜上动脉(superior mesenteric artery,SMA)。Ⅳ型:Ⅱ+Ⅲ。Ⅴ型:副肝左动脉(accessory left hepatic artery,aLHA)起自LGA。Ⅵ型:副肝右动脉(accessory right hepatic artery,aRHA)起自SMA。Ⅶ型:Ⅴ+Ⅵ。Ⅷ型:Ⅱ+Ⅵ/Ⅲ+Ⅴ。Ⅸ型:肝总动脉(common hepatic artery,CHA)起自SMA。Ⅹ型:CHA 起自LGA。
结 果
1.基于CT数据的三维定量分析与显示
利用IQQA-Liver实时交互工具辅助医生进行自动化分割及标记血管,血管形态逼真,立体感强,血管的分布、走形以及相互关系明晰,各套血管可分别着色、透明、独立或任意搭配显示,真实反映了肝脏三套血管系统间的复杂解剖关系。
2.肝血管解剖分型结果
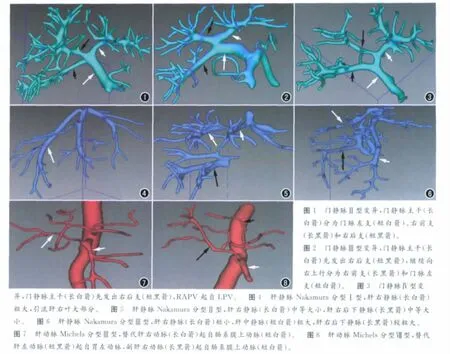
门静脉解剖分型结果:Ⅰ型143例(71.5%),Ⅱ型19例(9.5%)(图1),Ⅲ型18例(9%)(图2),Ⅳ型6例(3%)(图3),未见门脉左支水平段缺如及门脉右支缺如。未能分型变异14例(7%),包括RPV 主干三分叉8例(4%),RPV 主干四分叉3例(1.5%),RPV 主干分为右上叶支、右下叶支1例(0.5%),右后上叶支、右后下叶支起自MPV,RAPV 起自LPV 2例(1%)。
肝静脉解剖分型:LHV 与MHV 共干或共口148例(74%),非 共 干 或 共 口52 例(26%),大 于3mm IRHV 出 现73 例(36.5%)。Nakamara Ⅰ型156 例(78%)(图4),Ⅱ型28 例(14%)(图5),Ⅲ型11 例(5.5%)(图6)。除了这3型之外,我们观察到当RHV较粗时,5例(2.5%)出现了较粗的IRHV,独立于这三种类型。
肝动脉解剖分型:正常型134 例(67%),变异66例(33%)。Michels Ⅱ型17 例(8.5%),Ⅲ型10 例(5%)(图7),Ⅳ型2例(1%),Ⅴ型9例(4.5%),Ⅵ型2例(1%),Ⅶ型2例(1%),Ⅷ型3例(1.5%)(图8),Ⅸ型4例(2%),未见Ⅹ型变异;未能分型的变异17例(8.5%),包括rLHA 来自腹腔干(celiac artery,CA)1例,来自CHA 4例,来自胃十二指肠动脉(gastroduodenal artery,GDA)1例;肝固有动脉(proper hepatic artery,PHA)缺如,CHA 呈三叉状6例;CHA 发自主动脉(aorta,AO)3例;rRHA 发自CA 1例;rRHA 发自AO 伴rLHA 发自CHA 1例。
讨 论
1.IQQA-Liver工具的优势
近年来学者们研究肝血管的方法多为MSCT血管成像,而本研究采用的方法为IQQA 系统三维影像解读及全量化分析,该方法是应用独创四维图像处理分析技术,使用符合要求的原始CT数据,辅助医生实时使用IQQA-Liver工具即可在几分钟内对肝内三套血管进行自动化分割、标记及量化分析,分割出的肝血管结构清楚,形态逼真,立体感强,可实时交互观测测量肝血管的分布、走行以及相互关系,是真正的三维量化模型;并且可以对模型放大、缩小、绕任意轴旋转,方便地观察全方位的三维图像。
IQQA-Liver工具与CT自带的后处理软件的区别在于,后者属于三维重建软件或称可视化软件,分割肝脏、血管等大多依靠手动完成,耗时多,而IQQALiver不是三维重建软件,也不是可视化软件,关键优势在于操作便捷、实时性、智能性、只需几分钟即可将肝静脉、门静脉、肝动脉、下腔静脉、胆管等自动分割及标记,远远超出CT三维重建软件和可视化软件的功能,打破了三维重建和可视化软件耗时多、繁琐、只能看、不能全量化等的局限性。还可根据需要任意角度、任意方位、任意显示或隐藏某根血管去观察另一血管,且能量化血管管径、长度、两血管之间的三维空间距离、肿瘤与最近一支血管的三维空间距离等。笔者认为该方法的血管生成效果比CT重建图像更清晰、空间立体感更强。真实性及末梢小血管三维显示则完全依赖于CT原始数据质量,软件可进行2D 与3D 高级融合显示来点对点的验证三维血管模型与原始DICOM 图像的真实吻合性。该软件只要肝静脉、门静脉与肝实质间的密度值差≥30HU,即可实现良好的静脉自动分割,而通常在如此小的密度差异下,CT重建图像质量不佳。通过3D 显示模式、透明化技术,从各个角度观察肝脏和门静脉、肝静脉等立体结构。该软件可以显示4~6级门静脉和肝静脉的分支,可在此基础上进行个性化的肝脏分段、模拟肝切除,观察断面的动静脉、胆管,制订调整手术规划和预后风险分析,自动、准确测量拟切除和残余的肝脏体积,并且可重复性高,从而可预测术后发生肝脏功能衰竭的风险,提供较CT后处理软件更有价值的个体化信息。该软件可安装于个人电脑,方便手术医生自行操作,甚至可在手术台旁展示肝脏三维模型,在手术进行中进行视觉导航。
2.肝动脉解剖和变异及其临床意义
肝动脉解剖变异的分型有Michels分型[5]、Hiatt分型[6]等。1955年,Michels[7]将肝动脉的解剖变异分为10种,此分型至今仍被视为研究肝动脉解剖变异的主要标准。但随着肝脏介入和肝移植手术的开展,发现了一些未包含在Michels分型中的变异,例如本组中的rLHA 起源于LGA 以外动脉等变异,而这些变异也并不罕见,本组约占8.5%。肝动脉变异较为常见,变异率约为19.1%~42.0%[8-10],本组变异率为33%。本组最常见的变异包括rLHA 或aLHA 起源于LGA(占13%)、rRHA 或aRHA 起源于SMA(占12%)。
肝切除术前了解肝动脉解剖变异可缩短手术时间,避免术中误切、误扎造成肝功能不必要的损害。肝肿瘤介入治疗前检查其供血动脉,可提高选择性肝动脉插管的速度和准确;并可防止术中出现误栓或漏栓,提高疗效。肝移植术前了解供受体肝血管解剖变异,有助于手术方案制定,保证术后肝脏的正常动脉供血,降低术后肝动脉并发症如肝动脉栓塞、肝动脉狭窄等发生的可能性。
3.门静脉及肝静脉解剖和变异及其临床意义
门静脉最常见的变异为Ⅱ型[8]。Akgul等[11]研究发现门静脉变异率为13.8%,其中Ⅱ型变异为12.3%。Soyer等[12]研究发现变异率为6%,其中Ⅱ型变异为4%。Atri等[3]研究发现变异率为20%,其中Ⅱ型变异为10.8%。本研究利用IQQA-Liver自动化分割门静脉,变异率达到28.5%,其中Ⅱ型占9.5%。与文献相比,变异率偏高。
本组74%MHV 和LHV 形成共干或共口注入IVC,说明MHV、LHV 共干或共口发生率较高。NakamuraⅠ型78%,Ⅱ型14%,Ⅲ型5.5%,IRHV 的显示率36.5%,与文献结果近似[13],提示国人肝静脉类型以RHV 粗大型为主。同时,我们观察到当RHV较粗大时,5 例(2.5%)也出现了较为粗大的IRHV,刘本菊等也报道了类似结果[14]。可见Nakamara分型方法仅考虑到RHV 和IRHV 的关系,忽略了肝右叶体积大小的个体差异和与MHV 的关系。
经典Couinaud肝脏分段法有明显缺陷,它是基于离体肝铸型的研究结果,且段间的分割面为平面。Rieker等[15]研究显示采用病灶归属于最近门静脉分支法定位病灶与传统的Couinaud分段法相比,发现16%(20/126)病灶定位与传统方法不符。这些差异主要是由于肝血管变异情况复杂多见。随着计算机三维重建可视化技术应用和发展,产生了个体化分段的软件,例如本研究的IQQA-liver,该软件在手动赋予不同门静脉肝段分支不同颜色的基础上,可自动划分出门静脉每个肝段分支分布的相应肝段范围,生成个体化的肝段三维模型。在此模型基础上更有利于肝脏病变术前的正确定位及进一步的虚拟解剖性肝切除。
肝肿瘤切除术前可通过门静脉及肝静脉为病变定位,为肝叶段切除提供解剖学资料。术前了解血管的走行与病变的关系,可减少不必要的血管损伤,在完全切除病灶的基础上保留更多的肝脏。术前了解肝内静脉解剖变异可减低介入操作的难度。
如果MPV 呈三叉状或RAPV 发自LPV,肝右叶移植至受体时需2次吻合,增加术后门静脉血栓形成的机率[16]。MHV 和LHV 共干、共口的高发生率(本组为74%)要求扩大肝右叶切除时须慎重,以防损伤LHV;另外,在左叶切除时须避免损伤MHV。IRHV存在是最常见的肝静脉变异,在行右后叶切除时须结扎粗大的IRHV。如果其直径大于5mm,肝移植时需重建,以免供体肝淤血[17]。
总之,IQQA-liver三维定量分析与显示肝血管系统可真实反应血管的形态结构,清晰显示其正常解剖及变异,为虚拟手术研究提供了血管解剖变异各种3D模型,为上腹部脏器介入治疗提供了活体解剖学依据。
[1]董家鸿,黄志强.精准肝切除-21世纪肝脏外科新理念[J].中华外科杂志,2009,47(21):1601-1605.
[2]Couinaud C.The liver:anatomic and surgical studies[M].Paris:Masson,1957:71-118.
[3]Atri M,Bret PM,Fraser-Hill MA.Intrahepatic portal venous variations:prevalence with US[J].Radiology,1992,184(1):157-158.
[4]Nakamura S,Tsuzuki T.Surgical anatomy of the hepatic veins and the inferior vena cava[J].Surg Gynecol Obstet,1981,152(1):43-50.
[5]Michels NA.Newer anatomy of the liver and its variant blood supply and collateral circulation[J].AmJ Surg,1966,112(3):337-347.
[6]Hiatt JR,Gabbay J,Busuttil RW.Surgical anatomy of the hepatic arteries in 1000cases[J].Ann Surg,1994,220(1):50-52.
[7]Michels NA.Blood supply and anatomy of the upper abdominal organs with a descriptive atlas[J].Philadelphia:Lippincott,1955:40.
[8]Schroeder T,Radtke A,Kuehl H,et al.Evaluation of lifing liver donors with an all-inclusive 3D multi-detector row CTprotocol[J].Radiology,2006,238(3):900-910.
[9]Stemmler BJ,Paulson EK,Thornton FJ,et al.Dual-phase 3D MSCTangiography for evaluation ofthe liver before hepatic resection[J].AJR,2004,183(6):1551-1557.
[10]Alonso-Tortes A,Femdez-Cuadrado J,Pinilla I,et al.Multi-detector CTin the evaluation ofpotential living donors for liver transplantation[J].Radio Graphics,2005,25(4):1017-1030.
[11]Akgul E,Inal M,Soyupak S,et al.Portal venous variations:prevalence with contrast enhanced helical CT[J].Acta Radiol,2002,43(3):315-319.
[12]Soyer P,Bluemke DA,Choti MA,et al.Variations in the intrahepatic portions of the hepatic and portal veins:findings on helical CTscans during arterial portography[J].AJR,1995,164(1):103-108.
[13]刘静,李忠华,王兴海,等.右叶部分肝移植肝静脉的临床应用解剖[J].中国临床解剖学杂志,2004,22(3):234-236.
[14]刘本菊,周庭永,钱学华,等.活体肝移植肝右静脉的临床解剖研究[J].中国临床解剖学杂志,2009,27(3):270-274.
[15]Rieker O,Mildenberger P,Hintze C,et al.Segmental anatomy of the liver in computed tomography:do we localize the lesion accurately?[J].Rofo,2000,172(2):147-152.
[16]Certin A,Elif O.Prevalence and types of Main and right portal vein branching varitations on MDCT[J].AJR,2006,187(9):676-681.
[17]Kubota T,Togo S,Shizawa R,et al.Indications for hepatic vein reconstruction in living donor liver transplantation of right liver grafts[J].Transplantation Proceedings,2004,36(8):2263-2266.