药物中间体S-苯基-L-半胱氨酸的酶法合成
赵春晖,徐 洁,曹 瀛,冯 斌
(1.辽宁师范大学生命科学学院,辽宁大连 116081;2大连医科大学生物技术系,辽宁 大连 116044)
药物中间体S-苯基-L-半胱氨酸的酶法合成
赵春晖1,徐 洁1,曹 瀛1,冯 斌2
(1.辽宁师范大学生命科学学院,辽宁大连 116081;2大连医科大学生物技术系,辽宁 大连 116044)
目的 利用在大肠杆菌中高效重组表达的O-乙酰丝氨酸(硫醇)裂解酶A(OASS-A)合成药物中间体S-苯基-L-半胱氨酸,并对合成产物进行纯度及结构鉴定。方法 通过PCR扩增目的基因 Cys K,并连接到pET-22b(+)载体上构建原核表达质粒,重组体转到感受态大肠杆菌BL21(DE3)中进行蛋白诱导表达,重组蛋白采用Ni2+-树脂柱亲和层析纯化,利用SDS-PAGE鉴定表达纯化蛋白,通过HPLC对合成产物纯度进行检测,应用1H NMR技术对化合物进行结构鉴定。结果 成功构建了OASS-A原核表达载体,在IPTG诱导下获得了高效表达。重组酶高效合成非蛋白质氨基酸S-苯基-L-半胱氨酸。合成的化合物以晶体形式析出,采用HPLC和1H NMR技术对其结构进行了鉴定,合成产物的纯度为100%。结论 利用大肠杆菌中重组表达的OASS-A能够高效合成药物中间体S-苯基-L-半胱氨酸。
S-苯基-L-半胱氨酸;酶法合成;O-乙酰丝氨酸(硫醇)裂解酶;非蛋白质氨基酸
非蛋白质氨基酸(又称非天然氨基酸)是自然界存在的蛋白质中发现的20种氨基酸以外的其他氨基酸,其在科研和医药领域均有广泛的用途[1-2]。非蛋白质氨基酸丰富了肽链的多样性,为跨越20种天然氨基酸屏障,人工合成蛋白质提供了基础材料。非蛋白质氨基酸是国内外合成肽类、类肽类药物的主要成分,是众多新药的关键中间体,广泛用于合成治疗老年痴呆症药物和肽类止痛药,制备人体激素类似物,合成NMDA受体药物、抗肿瘤药、抗癫痫药、脑啡呔类药物等[2-3]。
非蛋白质氨基酸的来源有两个途径:一是来源于植物或其他生物,二是人工合成。在植物中,已经鉴定出超过250种非蛋白质氨基酸,它们是天然氨基酸在合成和分解代谢过程中的中间产物,可能参与植物对植食性动物及昆虫的防御体系[4];在动物中发现50多种,在微生物中发现100多种非蛋白质氨基酸。但是,非蛋白质氨基酸在植物或其他生物中的含量极低,分离提纯困难,所以根本无法应用于大量生产。
植物和微生物利用丝氨酸乙酰转移酶(SAT)和O-乙酰丝氨酸(硫醇)裂解酶(OASS)将环境中的无机硫还原成-2价的硫,掺入到半胱氨酸中。半胱氨酸的合成通过两步反应完成:第一步是在丝氨酸乙酰转移酶(SAT)催化下,由丝氨酸和乙酰辅酶A合成O-乙酰丝氨酸(O-acetylserine,OAS)(反应式1:L-丝氨酸+乙酰辅酶酸+辅酶A),第二步是在O-乙酰丝氨酸(硫醇)裂解酶(OASS)的催化下,由OAS和硫化物(S2-)合成半胱氨酸(反应式2:O-乙酰丝氨酸+硫化物)。OASS能够利用各种亲核试剂和硫醇代替S2-合成出各种非蛋白质氨基酸(反应式3:O-乙酰丝氨酸+亲核试剂白质氨基酸 + 醋酸盐)[5-7]。
非蛋白质氨基酸S-苯基-L-半胱氨酸(S-phenyl-L-cysteine,S-PC,CAS:34317-61-8)广泛应用于食品添加剂、化妆品添加剂及医药等各个领域,同时也是一种HIV蛋白酶抑制剂类抗艾滋病药物的基础原料,具有重要的药用价值。本研究利用在大肠杆菌中高效表达的O-乙酰丝氨酸(硫醇)裂解酶A(OASS-A),得到大量的活性稳定的重组酶(生物催化剂);并获得高效率合成非蛋白质氨基酸的有效途径。此项研究建立的新模式,可以通过改变亲核试剂而用于其他非蛋白质氨基酸的合成。
1 材料和方法
1.1 材 料
1.1.1 菌株与质粒:大肠杆菌克隆菌株Escherichia coli(E.coli)DH5α、E.coliJM109及表达菌株 E.coli BL21均由本实验室保存,原核表达载体pET-22b(+)为本实验室提供。
1.1.2 主要试剂:限制性内切酶、T4DNA连接酶、Taq DNA聚合酶、基因组DNA提取试剂盒、DNA切胶回收试剂盒、DNA Marker等购自宝生物(TaKa-Ra)工程大连有限公司;蛋白Marker购自NEB公司;HisPur镍螯合树脂(HisPurtmNi-NTA Resin)及离心柱购自Thermo公司;O-乙酰丝氨酸盐酸盐和S-苯基-L-半胱氨酸标准样品购自Sigma公司;其他试剂均为国产或进口分析纯。
1.2 方 法
1.2.1 目的基因的获得:应用基因组DNA提取试剂盒(MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0,TaKaRa)提取大肠杆菌E.coliDH5α基因组DNA。
根据原核表达载体pET22b(+)和OASS-A基因片段Cys K的序列特点,设计带有Nde I、Xho I酶切位点的 PCR引物如下:CysK-N:5'-CGCCCATATGAGTAAGATTTTTGAAG -3';CysK - X:5'-CCGCTCGAGCTGTTGCAATTC -3'。以大肠杆菌DH5α基因组 DNA为模板,使用 TaKaRa Taq HS PCR扩增获得带有NdeI、XhoI酶切位点的Cys K基因片段。PCR反应条件为:94℃预变性2 min;94℃变性 1 min,65℃退火1 min,72延伸1 min,循环30次,72℃ 延伸 5 min。PCR产物使用 TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.3.0切胶回收,命名为N-Cys K-X。
1.2.2 原核表达质粒的构建及诱导表达:N-Cys K-X基因片段与载体pET-22b(+)分别用Nde I和Xho I双酶切处理,酶切产物进行连接后转入克隆菌E.coliJM109,并进行菌落PCR筛选阳性克隆,随后提质粒进行双酶切鉴定及测序。重组质粒由生工生物工程(上海)有限公司测序。
测序后的重组表达载体转入感受态细菌E.coliBL21(DE3)中进行蛋白表达。挑选单克隆后,接种于含有氨苄的LB培养基中,于37℃培养至OD600≈0.6,加IPTG至终浓度1 mmol/L,进行12 h的诱导表达。得到的菌体冰浴超声破菌,采用镍柱亲和层析纯化蛋白,SDS-PAGE电泳鉴定。
1.2.3 OASS的酶活力分析:O- 乙酰丝氨酸(硫醇)裂解酶(OASS)的活力单位定义为:在25℃,pH 7.5条件下,1 min内催化生成1μmol/L半胱氨酸的酶量。OASS活性的测定方法:取0.03 mL 200 mmol/L OAS溶液,加入到0.27 mL的反应混合液中,反应混合液包括 0.11 mmol/L PLP、2.2 mmol/L Na2S和适量的酶(用缓冲液A稀释到适当浓度)的缓冲液A,调节pH值到7.5。反应5 min后,加入0.15 mL 20%(w/v)的三氯醋酸终止反应,然后加入0.3mL的浓醋酸和0.6mL的茚三酮试剂。混合液煮沸10 min,立刻加入1.8 mL预冷的乙醇。通过检测560 nm处光吸收值来测定半胱氨酸的浓度。
1.2.4 S-苯基 -L-半胱氨酸的合成:参考相关文献[1-2]合成目标化合物(反应式4:OAS+thiophe-在50 mL反应瓶中加入pH 7.0,50 mmol/L磷酸缓冲液,再依次加入终浓度为20 mmol/L的苯硫酚(Thiophenol),5 mmol/L OAS,0.1 mmol/L PLP,和400 U/mL的OASS-A,总体积为10 mL。滴加浓盐酸保持pH 7.0,保温反应2 h,HPLC监测原料消耗完毕后,将反应液降温至-20℃,白色晶体析出,抽滤,洗涤,干燥,称重。
1.2.5 S-苯基-L-半胱氨酸的鉴定:S-苯基-L-半胱氨酸的HPLC谱图的具体分析条件包括:进样量为5μL;检测时间为60 min;检测波长为220 nm;色谱柱型号为Discovery C18 column(250×4.6 mm I.D.);流速为 1.0 mL/min;流动性 Buffer A 为0.10%TFA+H2O;流动相 Buffer B 为 0.10%TFA+CH3CN;梯度洗脱条件为0.1% ~50%B,0~15 min。采用1H NMR(AVANCE500MHz超导核磁共振谱仪,瑞士Bruker公司)技术对所合成化合物进行结构表征。
2 结果
2.1 OASS-A原核表达质粒的构建
以大肠杆菌DH5α基因组DNA为模板,用PCR扩增带有Nde I和Xho I酶切位点的Cys K基因片段N-Cys K-X,产物以1%琼脂糖凝胶电泳检测,片段大小为985 bp(图1)。将N-Cys K-X基因片段克隆入原核表达载体PET-22b(+)后,经Nde I和Xho I双酶切,得到985 bp目的片段(图2)。测序结果显示载入基因序列未发生变异,说明成功将Cys K基因构建入到pET-22b(+)中。
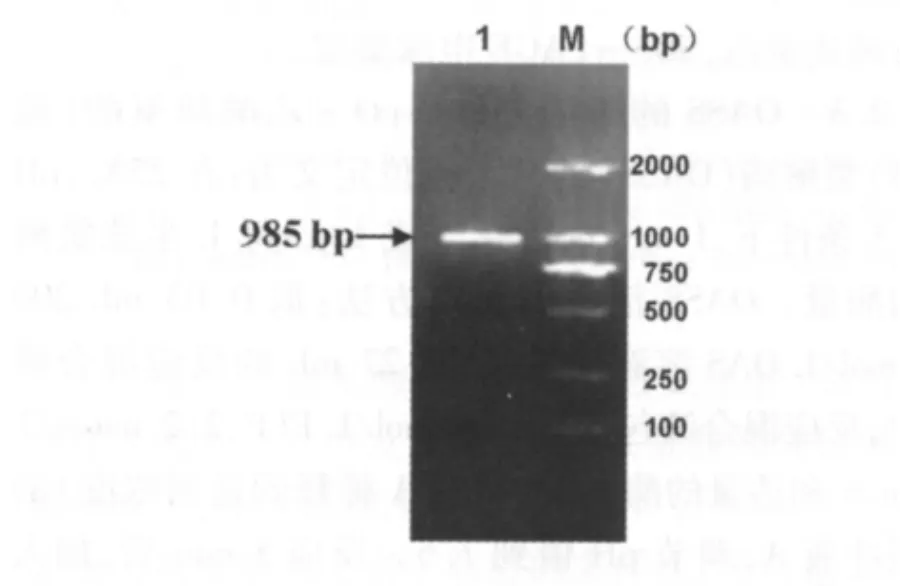
图1 N-Cys K-X PCR扩增片段电泳图Fig 1 PCR of N-Cys K-XM:DL2000 DNA Maker;1:Cys K的PCR扩增
2.2 重组OASS-A的获得及鉴定
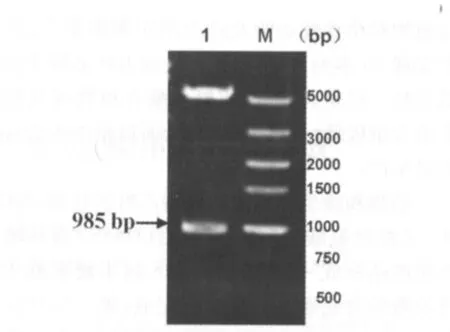
图2 pET22b(+)-Cys K双酶切鉴定Fig 2 Enzyme digestion of pET22b(+)-Cys KM:DL5000 DNA Maker;1:重组质粒pET22b(+)-Cys K双酶切
含有表达载体pET22b(+)-Cys K的工程菌经IPTG诱导后提取蛋白,SDS-PAGE电泳表明:经IPTG诱导的总蛋白中,在33kD可以见到明显的OASS-A表达条带(图3泳道2),而没加IPTG诱导的总蛋白中未见相应的条带(图3泳道1)。目的蛋白OASS-A以可溶性蛋白的形式存在于上清液中,重组蛋白约占总蛋白的55%。OASS-A的分子量与软件预测的相同。利用镍亲和层析柱纯化后获得了高浓度的纯化OASS-A蛋白(图3泳道3)。经检测其酶的活性单位为750 U/mg。
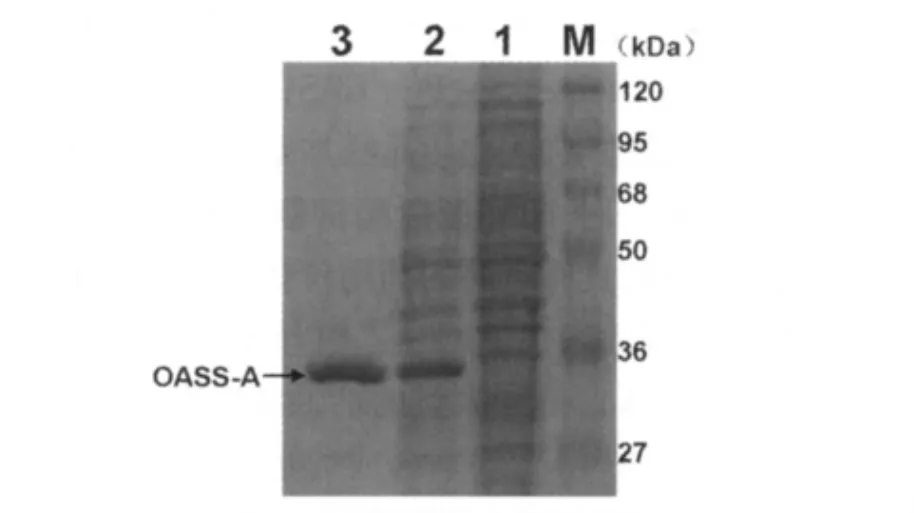
图3 OASS-A表达和纯化的SDS-PAGE结果Fig 3 SDS-PAGE analysis of expression and purification of OASS-AM.蛋白分子量标准;1:无IPTG诱导OASS-A表达(对照);2:IPTG诱导OASS-A表达;3:纯化的OASS-A
2.3 S-苯基-L-半胱氨酸的鉴定
重组OASS-A合成的S-苯基-L-半胱氨酸以白色晶体析出,经过抽滤,洗涤,干燥,称重得固体粉末8.5 mg。分别进样标准品溶液、样品溶液和流动相空白溶液,按照色谱条件分别测定。HPLC检测结果显示:S-苯基-L-半胱氨酸的保留时间在9.789 min左右,空白溶液在该时间无吸收。样品溶液在该时间有吸收峰,且纯度为100%。当在样品溶液中加入标准品后测定,仅是峰值增大,未发生峰分裂,表明该峰为S-苯基-L-半胱氨酸的特征峰,如图4所示。
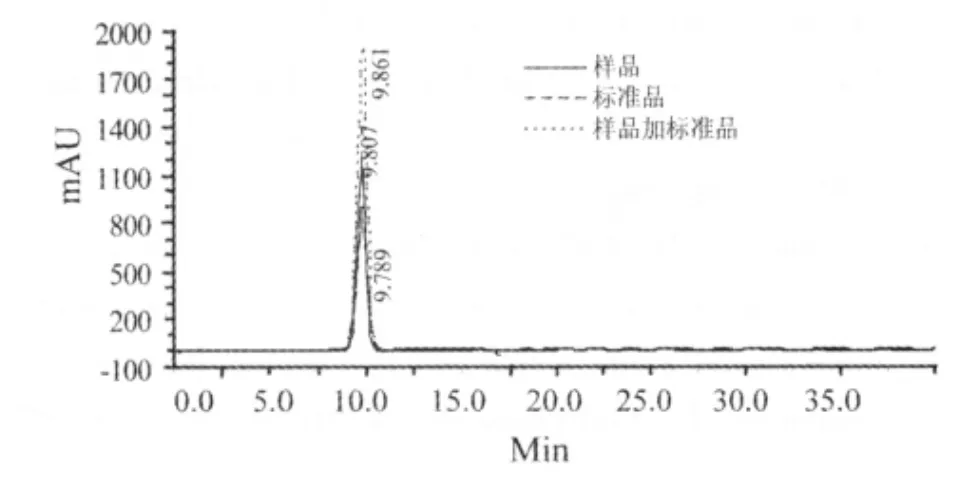
图4 S-苯基-L-半胱氨酸HPLC色谱图Fig 4 HPLC data of S-phenyl-L-cysteine
进一步并利用1H NMR对其结构进行了表征,如图 5,1H NMR 谱数据(CDCl3,500Hz)如下:δ7.6(d,J=7.65Hz,2H,苯环 H -3’,H -5’),7.5(t,J=7.6Hz,2H,苯环 H -2’,H -6’),7.48(t,J=7.2Hz,1H,苯环 H -4’),3.9(dd,J1=3.75 Hz,J2=3.8Hz,1H, - CH - COOH),3.7(dd,J1=3.75Hz,J2=3.8Hz,1H,H - 3),3.38(dd,J1=8.7Hz,J2=8.65Hz,1H,H -3)。
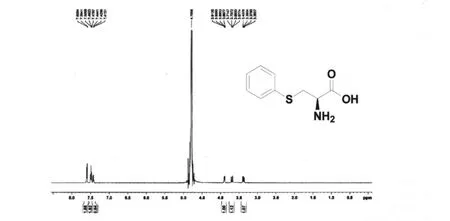
图5 S-苯基-L-半胱氨酸1 H NMR谱图Fig 5 1 H NMR spectrum of S-phenyl-L-cysteine
3 讨论
近年来,以非蛋白质氨基酸为“建筑材料”合成“人工蛋白质”是新兴的科学领域。由设计组装的生物元件与系统使生物体执行新的功能,在医学、制药、化工、能源、材料、农业等领域都有广阔的应用前景和极大的应用潜力[6-7]。以非蛋白质氨基酸为元件合成肽类、类肽类药物[4,8],以及为研究和控制细胞内的生化过程而将非蛋白质氨基酸引入类病毒或真核细胞等方面的研究都取得了很多进展[9-11]。但在非蛋白质氨基酸元件本身的合成方面的研究却非常少。非蛋白质氨基酸的生产要远比蛋白质氨基酸的生产复杂并且昂贵得多[3,12-13]。
人工合成是非蛋白质氨基酸生产的可行途径,包括化学合成和生物催化合成。由于化学合成法存在底物合成复杂,催化剂昂贵,成本高,副产物多,反应条件复杂,纯化步骤复杂等问题,使生物催化在生产中占有越来越重要的地位。生物催化反应的特点是反应立体选择性强,反应条件温和,大部分是在水相进行的,是一种绿色的合成工艺。采用生物技术提高酶的产量、活性、选择性及适应性,提高目标代谢产物的生产效率和生产能力将使生物催化得到更为广泛的应用。同时,酶法合成的非蛋白质氨基酸纯度高,效率高,比生物发酵的方法有更大的优势。
本实验中携带重组质粒pET22b(+)-Cys K的菌体高效地表达了研究所需要的目的蛋白OASS-A,并以可溶性蛋白的形式存在于上清液中,重组蛋白约占总蛋白的55%。菌体破碎后,经离心得到酶的粗提液,测得OASS-A的比活性为400 U/mg。实验中发现,采用酶的粗提液同样能够高效合成S-苯基-L-半胱氨酸。合成的化合物以晶体形式析出,具有产物纯度高、耗能低、工艺简单、便于操作、粒度分布较窄且易于规模化生产等优点。
酶的生物催化很大程度上依赖于特定性能酶的开发,因此能否提高酶的产量、活性、稳定性及适应性,解决酶来源受限的问题非常关键。本研究获得的重组酶产量高,活性稳定,对温度和pH适应范围广[14],在温度为0 ~60℃、pH 7.0 ~9.5 范围内都可以保持高效的催化活性。说明OASS-A极有可能成为生物催化合成非蛋白质氨基酸的有效工具酶。通过改变亲核试剂可以使建立的新模式应用于其他各种非蛋白质氨基酸的合成,从而为应用生物技术生产各种非蛋白质氨基酸提供理论依据。
致谢:核磁共振谱图测试得到了赵龙铉老师的帮助,在此表示衷心的感谢!
[1]Zhao C,Ohno K,Sogoh K,et al.Production of nonproteinaceous amino acids using recombinantEscherichia colicells expressing cysteine synthase and related enzymeswith or without the secretion ofO-acetyl-L-serine[J].J Biosci Bioeng,2004,97(5):322-328.
[2] Maier TH.Semisynthetic production of unnatural L-alpha-amino acids bymetabolic engineering of the cysteine -biosynthetic pathway[J].Nat Biotechnol,2003,21(4):422-427.
[3]王德心.活性多肽与药物开发[M].第1版,北京:中国医药科技出版社,2008:46-61.
[4]Swain,T.Secondary compounds as protective agents[J].Annu Rev Plant Physiol,1977,28:479 -501.
[5]Zhao C,Moriga Y,Feng B,et al.On the interaction site of serine acetyltransferase in the cysteine synthase complex fromEscherichia coli[J].Biochem Biophys Res Commun,2006,341(4):911-916.
[6]Ayyadurai N,Deepankumar K,Prabhu NS,et al.A facile and efficientmethod for the incorporation ofmultiple unnatural amino acids into a single protein[J].Chem Commun(Camb),2011,47(12):3430-3432.
[7]Wang L,Brock A,Herberich B,et al.Expanding the genetic code ofEscherichia coli[J].Science,2001,292(5516):498-500.
[8]Gentilucci L,De Marco R,Cerisoli L.Chemicalmodifications designed to improve peptide stability:incorporation of non-natural amino acids,pseudo-peptide bonds,and cyclization[J].Curr Pharm Des,2010,16(28):3185-3203.
[9]Hutchins BM,Kazane SA,Staflin K,et al.Site-specific coupling and sterically controlled formation of multimeric antibody fab fragments with unnatural amino acids[J].J Mol Biol,2011,406(4):595 -603.
[10]Liu CC,Qi L,Yanofsky C,etal.Regulation of transcription by unnatural amino acids[J].Nat Biotechnol,2011,29(2):164-168.
[11]Ugwumba IN,Ozawa K,Xu ZQ,etal.Improving a natural enzyme activity through incorporation of unnatural amino acids[J].J Am Chem Soc,2011,133(2):326 -333.
[12]Boto A,Gallardo JA,Hernández D,et al.Synthesis of unnatural amino acids from serine derivatives by betafragmentation of primary alkoxyl radicals[J].JOrg Chem,2007,72(19):7260-7269.
[13]Gellett AM,Huber PW,Higgins PJ.Synthesis of the unnatural amino acid N-N-(ferrocene-1-acetyl)-llysine:a novel organometallic nuclease[J].JOrganomet Chem,2008,693(18):2959-2962.
[14]Zhao C,Kumada Y,Imanaka H,et al.Cloning,overexpression,purification,and characterization ofO-acetylserine sulfhydrylase-B fromEscherichia coli[J].Protein Expr Purif,2006,47(2):607 -613.
Enzymatic synthesis of pharmaceutical intermediates S-phenyl-L-cysteine
ZHAO Chun - hui1,XU Jie1,CAO Ying1,FENG Bin2
(1.College of Life Science,Liaoning Normal University,Dalian 116081,China;2.Department of Biotechnology,Dalian Medical University,Dalian 116044,China)
Objective To construct expression vector of O -acetylserine sulfhydrylase A(OASS-A),purify and determine its chemical structure.Methods Full-length Cys K gene was amplified by polymerase chain reaction(PCR)and ligated with pET-22b(+)expression vector to construct prokaryotic expression plasmid.The recombinantwas transformed into competent E.coli BL21(DE3)for protein expression with IPTG induction.Recombinant protein was purified with Ni2+-resin affinity chromatography and identified by SDS-PAGE.The purity and chemical structure of the synthesized compound were determined using HPLC and1H NMR techniques.Results The prokaryotic expression vector for OASS - A was successfully constructed and fusion protein was expressed at a high level with IPTG induction.The unnatural amino acids S-phenyl-L-cysteinewas effectively synthesized by recombinantOASS-A.Conclusion The pharmaceutical intermediate S-phenyl-L-cysteine was effectively synthesized by recombinant OASS-A from E.coli.
S-phenyl-L-cysteine;enzymatic synthesis;O-acetylserine sulfhydrylase;unnatural amino acids
Q599
A
1671-7295(2013)01-0018-05
10.11724/jdmu.2013.01.04
国家自然科学基金(21102067,81071248)
赵春晖(1974 -),女,辽宁营口人,副教授。E -mail:chunhuiz@hotmail.com
冯 斌,副教授。E-mail:binfeng70@hotmail.com
赵春晖,徐洁,曹瀛,等.药物中间体S-苯基-L-半胱氨酸的酶法合成[J].大连医科大学学报,2013,35(1):18 -22.
2012-10-08;
2012-12-04)

