烟草赤星病菌的拮抗放线菌筛选
王丽红, 陈世伟, 张 帅, 孔 阳
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
烟草赤星病由烟草赤星病菌引起,是世界各烟草产区烟草生产上威胁最大的病害之一[1],在我国各烟区均有发生, 每年发病面积约占我国种植面积的30~35%,2007~2009年全国烟区因赤星病造成的产值损失达41 856.47万元[2].近年来,对烟草赤星病菌的研究随着烟草生产技术的改进,特别是施肥量的增加、严格规范掌握烟草采收成熟度,相应地延长了烟株大田生长期,因而病害的发生及其危害程度呈上升趋势,已成为优质烟生产的重要障碍因素之一.目前主要采用化学防治为主的防治技术,但农药残留、病原菌抗药性以及对卷烟卫生的影响,限制了农药的大规模利用.分离筛选出对赤星病菌具有良好抑制作用和防治效果的拮抗菌是实施生物防治的一项重要工作[3].近年来一些学者对此病害进行了生物防治研究[4-7],但真正应用离实际生产还有较大的距离.因此,筛选出对烟草赤星病菌具有较强拮抗作用并应用于烟草赤星病菌防治是亟需解决的问题,本文通过在烟草赤星病感染区、秦岭山区采集的土壤样品中分离纯化,拟筛选出可以产生抗烟草赤星病原真菌抗生素的放线菌.
1 材料与方法
1.1 实验材料
烟草赤星病原真菌(Alternariaalternata(Fries)Keissler)、辣椒疫霉菌(PhytophthoracapsiciLeon)、黄瓜枯萎菌(Fusariumoxysporumf.sp.cucumerinum)、苹果轮纹菌(Macrophomakawatrukaii)、 金黄色葡萄球菌、大肠杆菌、酿酒酵母由陕西科技大学制药工程实验室分离保存.
土壤样品:采自烟草种植区烟草赤星病菌感染区的健康烟草植物根际及秦岭山区海拔1 100~1 300 m森林中的土壤.
1.2 培养基
(1)PDA培养基(检定菌培养),高氏一号培养基(放线菌筛选及保存).
(2)种子培养基(%):可溶性淀粉1.5,葡萄糖0.5,蛋白胨1.0,MgSO4·7H2O 0.05,CaCO30.1,NaCl 0.05,(NH4)2SO40.05,蒸馏水,pH7.0~7.5,115 ℃灭菌30 min.
(3)发酵培养基(%):可溶性淀粉4.0,葡萄糖0.5,蛋白胨1.0,MgSO4·7H2O 0.05,CaCO30.1,(NH4)2SO40.05,K2HPO40.05,FeSO4·7H2O 0.001,玉米粉1.0,蒸馏水,pH7.0~7.5,115 ℃灭菌30 min.
1.3 实验方法
(1)试验步骤:
土壤样品采集→土壤预处理→放线菌富集培养→平板初筛→抑菌率测定→发酵液复筛→其它病原菌抑制作用测定.
将采集土壤置于无菌平皿中风干8天,称取1 g风干后的土样,研钵内研磨,土壤颗粒均匀即可.然后采用高氏一号液体培养基富集土壤中放线菌,同时加入100μg/mL重铬酸钾为抑制剂,进行30 ℃摇瓶富集培养,5 h后将土壤富集液10-1~10-3梯度稀释,取0.1 mL稀释液倒入平皿,倾注高氏一号培养基,30 ℃恒温培养,挑取放线菌斜面保存.
(2)平板初筛及抑菌率测定
初筛采用平板对峙法[8], 在高氏一号培养基平皿上点接烟草赤星病菌和富集保存的放线菌斜面菌种,30 ℃恒温培养,观察平皿中菌落生长状况,根据检定菌与平皿中的放线菌生长情况挑取有拮抗作用的菌落纯化保存.
对有抑菌活性的菌种进行抑菌率测定,以烟草赤星病菌为中心,四周点接放线菌,每种菌做三个重复,并同时点接烟草赤星病菌作为空白,30 ℃培养,三天后测量被抑制的烟草赤星病菌平均直径以及空白实验中烟草赤星病菌的直径.再根据公式计算抑菌率[9].
抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
式中:对照菌落直径-三天培养的烟草赤星病菌病原真菌直径,mm;处理菌落直径-三天培养的对峙检定菌菌落直径,mm.
(3)初筛放线菌发酵液抑菌活性复筛
采用扩散法[10]测定菌株发酵液抑菌活性.将烟草赤星病菌成熟孢子从斜面培养基洗孢子, 与冷却到45 ℃左右的PDA培养基混匀,用吸管吸取12 mL倒成平板,凝固后放入自制的塑料管.将初筛抑菌率较高的放线菌斜面洗孢子后,接种于种子培养基中,于28 ℃、150 rpm摇瓶培养48 h后,种子培养液以10%接种量接入发酵培养基中,30 ℃、200 rpm下摇瓶培养,分别培养48 h、72 h、96 h、120 h、144 h,发酵液于12 000 rpm转速下离心15 min,取上清液加入上述制作的塑料管中,每个塑料管点样280μL,重复3次,28 ℃培养3 d后,测量抑菌圈直径,根据抑菌圈确定拮抗效果最好的菌株.
(4)对其它病原菌的抑制作用鉴定
将复筛抗菌活性较好的放线菌菌株分别采用扩散法检测其发酵液对辣椒疫霉菌、黄瓜枯萎菌、苹果轮纹菌、金黄色葡萄球菌、大肠杆菌、酿酒酵母的抑菌活性.
2 结果与分析
2.1 平板初筛
试验土样采自烟草种植区烟草赤星病菌感染区的健康烟草植物根际及秦岭山区森林中的土壤.主要考虑在烟草赤星病菌感染区,未被感染的烟草可能是其根际土壤中含有某些抗菌活性物质.而秦岭山区森林中的土壤,由于微生物菌群常年积累种类较为丰富,因此从这两方面考虑采集土样.试验主要从土壤中筛选放线菌,一方面是因为放线菌是目前产生抗生素的主要来源,另一方面本实验在前期筛选研究中,发现能产生拮抗作用的主要是放线菌,真菌和细菌较少.因此,主要分离能产生抗生素的放线菌.
通过平板对峙法,发现有49株放线菌到对烟草赤星病菌有不同强度的抑菌作用.将49株菌株进一步分离纯化,有些菌落在初次对峙中有较好的抑制作用,但由于菌落不纯,经多次分离纯化后有抑菌作用的菌株丢失,或由于培养条件影响抑菌作用不稳定,经多次重复平板对峙试验,最终筛选到有稳定抑制作用的菌株31株,分别以筛选时间及序号命名,部分对峙效果图如图1所示.
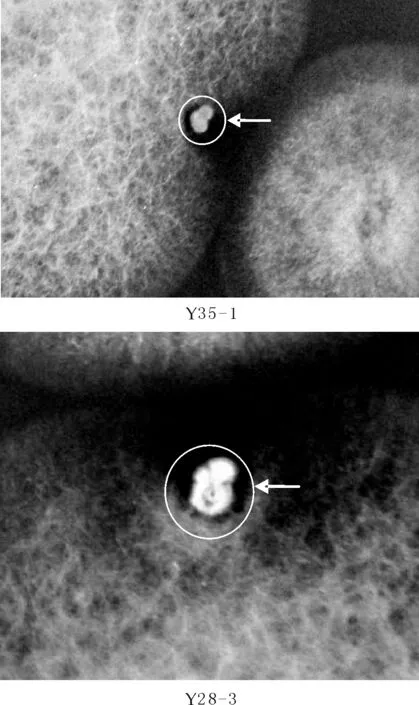
图1 部分菌株对烟草赤星病菌病原真菌的抑菌作用(抑菌圈如图所指)
2.2 抑菌率测定
为了准确描述初筛菌株的抑菌效果,将31株菌株分别采用平板对峙法检测其对烟草赤星病菌的抑菌强弱,采用三天培养后检测,试验结果抑菌率都较高,其中有19株抑菌率达到了20%以上,12株菌株抑菌率大于30%,具体数据如表1所示.
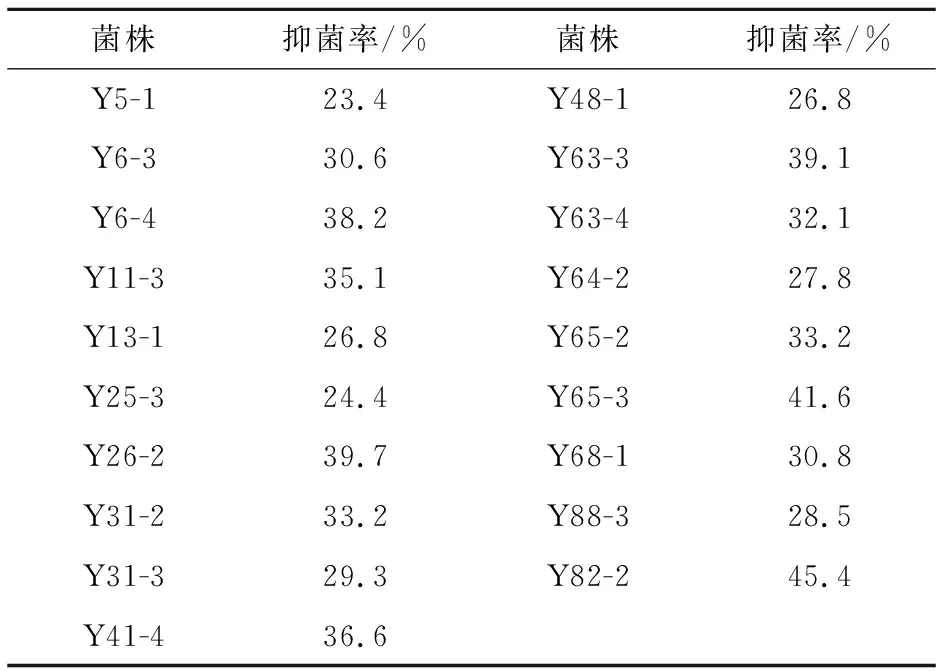
表1 19株菌对烟草赤星病菌病原真菌的抑菌率
2.3 发酵液抗菌活性复筛
将初筛抑菌率大于30%的12株菌株发酵,分别发酵48 h、72 h、96 h、120 h、144 h后检测抑菌圈,试验发现96 h和120 h的发酵液对检定菌具有明显抑菌作用,主要因为抗生素为次级代谢产物,在菌体进入稳定期后才会大量合成,而且抗生素不稳定进入衰退期易分解,而96 h和120 h时这几株菌株发酵可能处于稳定期,相比抗生素抑菌作用较强.因此主要测定96 h和120 h时发酵液对烟草赤星病菌抑菌作用,但也有3株菌株发酵液未检测到抑菌作用,可能因为菌体培养后未产生抗生素而平板中的抑菌作用仅为菌体之间的拮抗作用,或者是抗生素不稳定易分解导致,因此只有9株菌株检测到发酵液的抑菌作用,结果如图2所示,抑菌圈直径检测具体数据如表2所示.

图2 发酵液对烟草赤星病菌抑菌效果
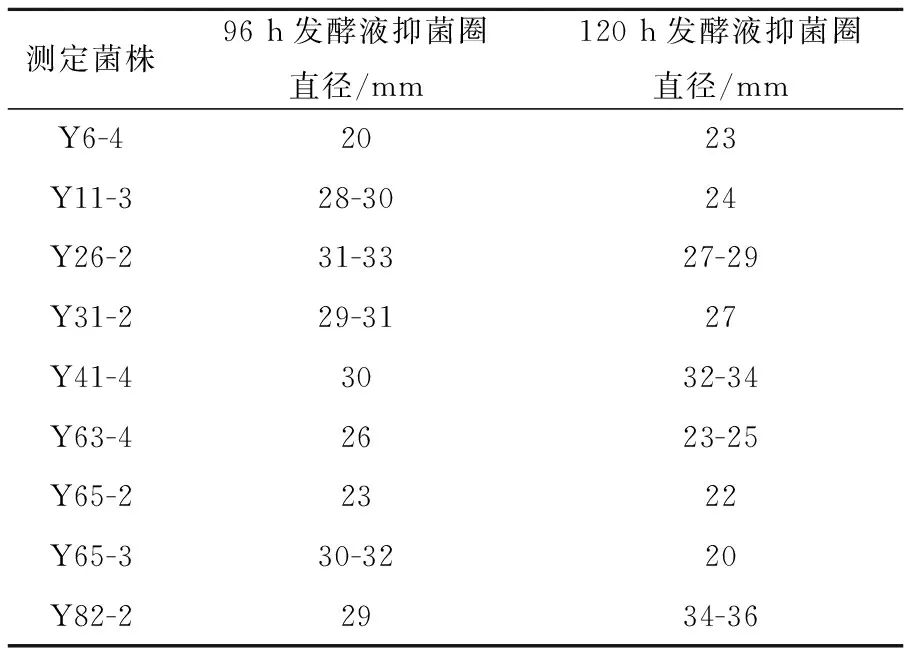
表2 发酵液对烟草赤星病菌抑菌圈效果
从表2中可以看出9株菌的发酵液都有一定的抑菌作用,由于真菌生长的蔓延性和试验的误差,菌落直径检测有一定的范围,但基本能反应抑菌圈的大小,其中Y26-2和Y82-2抑菌圈直径较大且产生的抗生素物质作用时效较长,不宜分解,相对较稳定,因此是2株较好的对烟草赤星病菌病原真菌有抑制作用的菌株.
2.4 对其它病原菌的抑制作用鉴定
将Y26-2和Y82-2菌株分别采用扩散法检测其培养96 h后发酵液对辣椒疫霉菌、黄瓜枯萎菌、苹果轮纹菌、金黄色葡萄球菌、大肠杆菌、酿酒酵母的抑菌活性.试验结果显示, Y26-2和Y82-2菌株代谢产物具有选择性抑制作用效果,都对金黄色葡萄球菌、大肠杆菌、酿酒酵母没有抑制作用,对辣椒疫霉菌、黄瓜枯萎菌、苹果轮纹菌植物病原真菌有一定抑菌作用,其中Y26-2对辣椒疫霉菌抑菌作用较强,Y82-2对黄瓜枯萎菌抑菌作用最弱.
3 结束语
通过平板对峙和发酵液扩散筛选最终筛选到2株放线菌Y26-2和Y82-2,能够产生较稳定的对烟草赤星病菌有较强抑制作用的抗生素.并且对辣椒疫霉菌、黄瓜枯萎菌、苹果轮纹菌植物病原真菌有一定拮抗作用,能产生针对植物病原真菌的抗生素物质.但由于采样点较少只能分离、纯化到部分菌株,缺乏广泛性,同时有关菌株的发酵工艺及代谢产物需要进一步深入试验和研究.
[1] 谌爱东,严位中,杨家鸾,等.赤星病为害烤烟产量损失率测定[J].植物保护,2001,27(6):11-13.
[2] 刘 洋,曾 琛,向红琼.贵州省烟草赤星病菌生物学特性研究[J].广东农业科学,2012,39(9):77-79.
[3] 王 革,方敦煌,马永凯,等.云南省烟草赤星病菌致病力分化及生物防治研究[J].中国烟草学报,2000,4(4):31-37.
[4] 方敦煌,王 革,马永凯,等.烟草赤星病菌拮抗微生物的筛选及其对病原菌的抑制作用[J].西南农业学,2002,15(2):59-61.
[5] 易 龙,肖崇刚,马冠华,等.防治烟草赤星病有益内生细菌的筛选及抑菌作用[J].微生物学报,2004,44(1):19-22.
[6] 易 龙,马冠华,杨水英,等.拮抗菌Ata28对烟草赤星病菌的抑制及种类鉴定[J].西南大学学报(自然科学版),2007,29(3):100-103.
[7] 吴元华,文才艺,朱春玉,等.农抗TS99对烟草赤星病菌作用的研究[J].中国烟草学报,2004,10(4):20-23.
[8] 刘 秋,吴元华,于基成.东北地区保护地土壤拮抗放线菌的筛选[J].土壤,2004,36(5):574.
[9] 赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002:86.
[10] 郑雅楠,杨 宇,吕国忠,等.土壤放线菌分离方法研究[J].安徽农业科学,2006,34(6):1 167-1 170.

