掺硅碳羟基磷灰石的制备及其对Pb2+的吸附性能
唐文清,冯泳兰,李小明
(1.衡阳师范学院化学与材料科学系,湖南 衡阳 421008;2.湖南大学环境科学与工程学院,湖南 长沙 410082)
环境中铅主要来源于冶炼、电镀、造纸、纺织等行业,它是一种多亲和性毒物,常分布在机体的骨骼和血液中,人体一旦过量摄入将会造成铅性贫血以及神经系统、骨骼造血系统、消化系统、肾脏及生殖系统严重的损害,因此,含铅废水的治理一直深受关注[1-2].在已见报道含铅废水处理方法中,吸附法被一致认为是高效、经济、环保的方法,同时也因为原材料成本低廉、来源丰富、制备工艺简单等优点而倍受青睐[3-5].近年来文献报道净化含铅废水的吸附剂有磁性壳聚糖[6]、介孔活性炭[7]、槟榔壳[8]、碳羟基磷灰石[9]、斜长石[10]等,对比这些材料发现,自然磷灰石(HA)同晶异构体的羟基磷灰石(HAP)、碳羟基磷灰石(CHAP)和硅羟基磷灰石(Si-HAP)因表面活性高、孔隙发育结构、粒径细小且团聚程度轻、比表面积大等优点,对重金属离子具有优越的吸附性能[11-13].
本研究将在课题组制备碳羟基磷灰石CHAP的前期基础上,植入SiO44-替代 CHAP晶体结构中的PO43-,制备新型功能材料掺硅碳羟基磷灰石(Si-CHAP),用于去除含铅废水,采用BET、XRD、SEM、FTIR等多种表征手段对其进行物化性质分析,探讨了pH值、温度、时间等环境因子对吸附的影响,深入地研究其吸附规律,为含铅废水治理提供重要的理论依据.
1 材料与方法
1.1 试剂和仪器
实验所用试剂均为分析纯,1g/L Pb2+储备液用分析纯的Pb(NO3)2加二次蒸馏水配制而成,其他浓度的Pb2+均由储备液稀释而得.
主要实验仪器:PH330i精密酸度计(德国WTW公司),BL600电子天平(上海精密科学仪器有限公司),PE700原子吸收分光光度计(美国PE公司),ASAP2010型比表面积和孔结构测试仪(美国Micromeritics公司),IRAffinity-1傅里叶红外光谱仪(日本岛津公司),Rigaku MiniFlex 600型X衍射仪(日本Rigaku公司),JSM-6700F扫描电镜(日本电子株式会社),TGL-16GA台式高速离心机(湖南星科科学仪器有限公司).
1.2 Si-CHAP制备与表征
1.2.1 Si-CHAP的制备 将废弃蛋壳清洗后,放入10%HAc溶液中加热至40℃脱内膜,再用蒸馏水清洗,烘干,碾碎成粉末.将预处理过的蛋壳粉末,投入H3PO4溶液中,调节pH值为3~4,置入超声波发生器中,控制温度30℃为,反应2h,制备过渡态磷灰石(HA),反应方程式为:CaCO3+H3PO4=CaHPO4+CO2+H2O.待蛋壳粉末溶解后,在机械搅拌下加入少量糊状Ca(OH)2,用氨水调节pH值至10,配制成A液.称取一定量Na2SiO3和尿素,加入适量蒸馏水溶解制得B液;将A和B液混合,搅拌10min,转入反应釜,150℃下反应10h,得产物,待产物冷却后,用1%NH4Cl洗涤至中性,在60℃下干燥3~4h得到掺硅碳羟基磷灰石(Si-CHAP).化学方程式为:

1.2.2 Si-CHAP样品的表征 样品的BET比表面积和孔径分布在吸附仪上通过N2吸附测定,比表面积采用BET方程由N2吸附等温线求得.采用傅里叶红外光谱仪对样品进行分析,用KBr压片测定波数范围4000~400cm-1的红外光谱,分辨率为4cm-1.样品的物相分析在X射线衍射仪上测定,测试的条件为:Cu靶激发Ka辐射为射线源,扫描范围为 10~70°(2θ),扫描速度为 4°/min.用扫描电镜观察样品的表面形态.
1.3 吸附实验
1.3.1 pH值对Pb2+吸附的影响 配制一系列pH值为 2~8、体积 50mL、Pb2+初始浓度为300mg/L的溶液入250mL锥形瓶中,各加入0.1g Si-CHAP,密封,置入293K的振荡器中振荡速率为120r/min,反应90min,离心分离,取上清液测定残余Pb2+含量.按公式(1)和(2)分别计算去除率w(%)和吸附容量qe(mg/g):

式中:C0为Pb2+初始浓度,mg/L;Ce为吸附后Pb2+平衡浓度,mg/L;V为溶液体积,L;m为吸附剂用量,g.
1.3.2 吸附等温线的测定 分别称取0.1g Si-CHAP于一系列250mL锥形瓶中,加入pH值为6.0具有一定浓度梯度(50,100,150,200,250,300,350,400,500mg/L)的 Pb2+溶液 50mL,密封放入293,303,313K的振荡器中120r/min振荡,90min后测定溶液中Pb2+的浓度,计算吸附容量.
1.3.3 吸附动力学的测定 分别称取0.1g Si-CHAP于一系列 250mL锥形瓶中,加入pH值为6.0,浓度为300mg/L的Pb2+溶液50mL,密封放入293,303,313K的振荡器中120r/min振荡,在不同时间下测定溶液中Pb2+的浓度,计算吸附容量.
2 结果与讨论
2.1 Si-CHAP表征
采用全自动比表面积及孔隙度分析仪对Si-CHAP的进行表征,测得该材料BET比表面积为323.35m2/g,平均孔径和孔容分别为6.34nm和0.83cm3/g.参照多孔物质材料的分类,孔径在2~20nm的为介孔(即中孔),说明本实验制备材料为介孔材料,具有较大的比表面积.
由图1可见,在3357cm-1和1654cm-1两处分别为Si—CHAP羟基的吸收峰和水的吸收峰.1072,472,565cm-1分别为 PO43-的v1、v2、v3振动吸收峰.1473,1416cm-1为晶体结构中CO32-的两个分裂峰,是区别于CO32-单峰明显标志[9].875,823cm-1分别出现了SiO44-的v1和v2特征振动吸收峰.从Si—CHAP红外特征图谱分析可知,CO32-和SiO44-均不同程度地替代了部分PO43-.
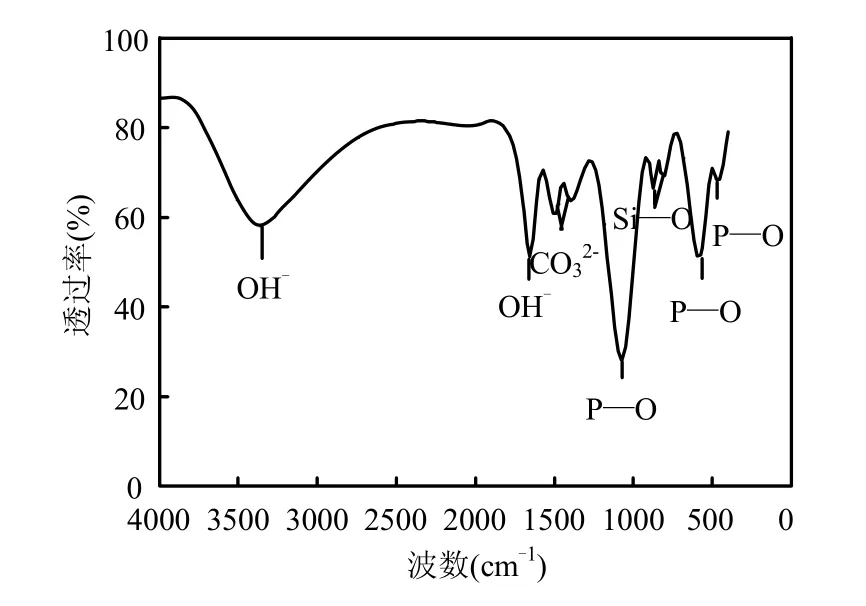
图1 硅碳羟基磷灰石的红外光谱图Fig.1 FTIR spectra of the Si-CHAP sample
采用X衍射对Si-CHAP的晶体结构进行分析,结果如图2所示.Si-CHAP微粒的XRD图谱显示其特征峰位与羟基磷灰石(HAP)、碳羟基磷灰石(CHAP)和硅羟基磷灰石(Si-HAP)的特征峰基本吻合[14-15],图中同时出现了碳酸盐和硅酸盐的衍射峰,说明部分SiO44-和CO32-均进入羟基磷灰石的晶格替代了PO43-,形成了新的HAP同晶异构体Si-CHAP.由于SiO44-和CO32-替代了部分PO43-,导致HAP羟基的空缺,使得颗粒的结晶度下降,团聚现象减弱;同时也使得HAP的晶格发生畸变,不利于晶粒发育长大,引起峰叠合宽化,颗粒的尺寸变小.
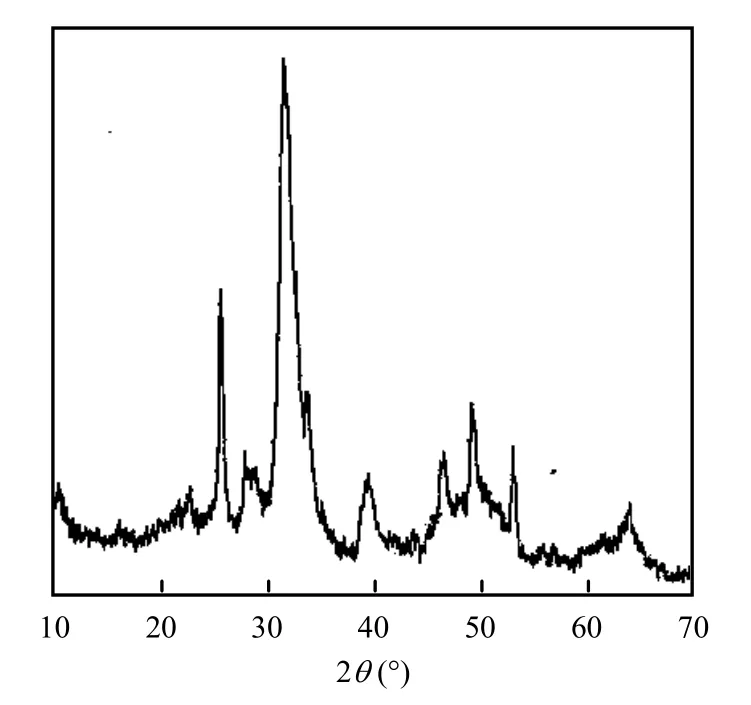
图2Si-CHAP的XRD图Fig.2 X-ray diffraction pattern of Si-CHAP
由Si-CHAP的扫描电镜图谱(图3)可见,产品形状类似棉花絮状,有大量不规则孔状结构,属于多孔状材料,很有利于溶液中吸附质快速进入孔隙内部与Si-CHAP表面的活性位点接触而被吸附,说明是一种良好的吸附材料.

图3 Si-CHAP的扫描电镜照片(×50000)Fig.3 SEM image of Si-CHAP(×50000)
2.2 pH值对吸附效果的影响
如图4所示,Si-CHAP对Pb2+的去除率和吸附容量都随溶液pH值的增加而增大.当pH>6.0时,曲线变化趋势趋于平缓,去除率超过99%;进一步增大溶液pH值,去除率及吸附容量提升幅度微小.Si-CHAP吸附溶液中Pb2+主要为两种途径,其一是Pb2+与Si-CHAP的Ca2+进行离子交换而被吸附,其二为表面络合作用而被吸附.在pH值<6.0时,溶液中 Pb2+主要以 Pb2+和少部分Pb(OH)+两种形式存在,同时也存在大量的H+与铅离子发生竞争吸附,由于H+很容易被吸附并快速占领Si-CHAP表面吸附位,使得Si-CHAP表面正电荷增加,与同性的Pb2+产生排斥,抑制了铅离子交换的进行和表面络合,从而导致Si-CHAP对铅离子的吸附容量随pH值降低而显著下降.pH值>6.0时,Pb2+的竞争吸附作用占主导地位,促使Si-CHAP对Pb2+的吸附量增大.继续增加pH,随溶液碱度的提高,增加了铅离子的水解可能性,部分Pb2+转变成Pb2(OH)3+和Pb(OH)2沉淀,影响Pb2+的交换及表面络合,降低Si-CHAP对这两种形式的铅吸附能力.因此,本研究其他吸附实验pH值均为6.0.
2.3 吸附等温线
平衡吸附等温线是反映吸附剂对吸附质吸附特性的重要方法,同时也是吸附体系实际应用的理论依据.常见等温方程为Langmuir和Freundlich方程,前者是基于吸附剂的表面只能发生单分子层吸附的假设提出,后者则是提供了一种单组分吸附平衡的经验描述.

式中:qm为饱和吸附容量,mg/g;KL为Langmuir吸附系数;Kf为Freundlich吸附系数;n为常数.

图4 pH值对Si-CHAP吸附Pb2+的影响Fig.4 Effect of pH on the adsorption of Pb2+onto Si-CHAP

表1 Langmuir和Freundlich等温吸附参数Table 1 Adsorption parameters of Langmuir and Freundlich equations
分别利用Langmuir和Freundlich等温方程对不同温度下的等温吸附实验数据进行拟合,结果如表1.由表1可知,Langmuir等温方程拟合的相关系数R2均高于0.99,说明此方程能较好地描述Si-CHAP对Pb2+的吸附行为.Freundlich等温方程拟合结果中n均大于1,表示吸附为优惠吸附[16].另外,利用Langmuir等温方程常数KL计算出没有量纲的吸附平衡常数RL,根据RL数值大小推断Pb2+在Si-CHAP上的吸附类型,RL值介于0~1之间,说明此条件下吸附是非常容易进行,且吸附剂自身表现出优良的吸附能力.
表2为近来报道各类吸附剂对Pb2+吸附的对比表,可以看出,Si-CHAP对溶液中的Pb2+吸附能力具有明显的优势.

表2 各类吸附剂对Pb2+吸附性能Table 2 Adsorption capacities of Pb2+ions by various adsorbents
2.4 表面覆盖率
覆盖率(θ)是揭示吸附质在吸附剂表面达到吸附平衡后的覆盖状况,同时也是验证吸附质在吸附剂表面的吸附性能的重要手段,其计算式如式(6)和式(7)[24].
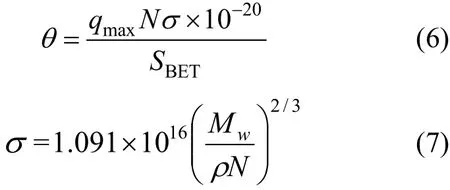
式中:θ代表Pb2+在Si-CHAP表面达到吸附平衡状态后的覆盖率,θ=1表示基本覆盖完;qmax是Langmuir吸附等温方程计算得到最大单层吸附量,mg/g;σ是单个 Pb2+占据的面积,Å2/分子;N是阿佛加德罗常数,6.022×1023;SBET(m2/g)是 Si-CHAP的比表面积;Mw为铅的摩尔质量,207.2g/mol;ρ为铅的密度,11.3g/cm3.
从上节分析可知,Langmuir吸附等温方程能很好地描述Si-CHAP对Pb2+的吸附行为,说明Pb2+在Si-CHAP表面的吸附以单层吸附为主,因此,Pb2+在Si-CHAP表面的覆盖率(θ)可以用式(6)进行计算.计算得到3个不同温度下Pb2+在Si-CHAP表面的铅覆盖率分别为0.2433(20℃)、0.2329(30℃)和 0.2273(40℃),随温度升高,Pb2+覆盖率减少,是由于Pb2+吸附容量降低造成,此结果与2.3节计算结果相吻合;同时也说明Si-CHAP未能实现在所有表面上对Pb2+的吸附.
2.5 吸附动力学
研究吸附过程的动力学主要目的是揭示吸附剂对吸附质的吸附速率.图5为Si-CHAP静态吸附Pb2+的动力学曲线,反映了吸附容量随反应时间的变化趋势.从图5可知,吸附前期阶段吸附容量增加十分迅速,到90min后,吸附基本达到平衡.吸附前期,大量吸附质被吸附在吸附剂表面;吸附后期,吸附质进入吸附剂孔隙内,由于吸附剂表面已有的吸附质对内扩散层离子产生同质排斥,导致吸附饱和后吸附容量变化较小,从而达到平衡.另外,也说明比表面积较大且孔隙结构发育的吸附剂,具有更大的饱和吸附容量.

图5 Si-CHAP对Pb2+的吸附动力学曲线Fig.5 Kinetics plots for the adsorption of Pb2+onto Si-CHAP
为进一步考察Si-CHAP对Pb2+的吸附机制,分别采用准一级动力学方程[17](式8)、准二级动力学方程[17](式9)、Elovich方程[25](式10)和内部颗粒扩散方程(IPD)(式11)对不同温度下的吸附实验数据进行拟合,结果如表3所示.结果显示,准二级动力学方程拟合效果最好,相关系数R2均在0.999以上,Elovich方程次之(R2=0.9764~0.9883),准一级动力学方程(R2=0.8658~0.9724)和IPD方程(R2=0.9317~0.9493)较差.准二级动力学方程计算得到的理论吸附容量qe,cal与实验所得到的结果值qe,exp十分吻合,说明此方程能很好反映Si-CHAP对Pb2+的吸附动力学行为.Elovich方程中,斜率值和截距分别反映吸附反应速度吸附能力大小,斜率越大说明反应速度越快;截距越大说明吸附能力越强,因此,从拟合的三个方程可以看出,Si-CHAP对Pb2+的吸附具有较强的能力,吸附速率也相对较快.IPD方程中的C不等于零,说明粒子内部扩散不是唯一的吸附速率控制步骤[26].

式中:qt为t时刻的吸附容量,mg/g;k1(min-1)和k2[g/(mg·min)]分别为拟一级、拟二级速率常数;αe为初始吸附速率常数,mg/(g·min);βe为脱附速率常数,g/mg;kd是内部颗粒扩散速率常数,mg/(g·min1/2);C是吸附过程的边界层常数,mg/g.
2.6 吸附热力学
参照Khan和Singh方法[27],分别完成293,303,313K的吸附实验,根据实验数据作ln(qe/Ce)作qe图,外推,得到相应的热力学常数Kd,作lnKd对1/T的线性回归如图6.

图6 lnKd与1/T的关系Fig.6 Relationship between lnKdand 1/T
计算lnKd对1/T函数关系的斜率与截距,得到熵变(△S0)和焓变(△H0),再根据 Van’t Hoff方程[式(12)][28],求得Si-CHAP对Pb2+吸附反应的吉布斯自由能△G0,结果如表4.


表3 不同温度下Si-CHAP吸附Pb2+的动力学参数Table 3 Kinetic parameters for the adsorption of Pb2+on Si-CHAP at different temperatures
从表4可见,△G0均为负值,说明Si-CHAP对Pb2+吸附反应为自发进行;焓变△H0为正值,表明该吸附反应是吸热反应,温度升高,Si-CHAP对Pb2+的吸附容量越大.焓变数值同时可用来判断吸附反应的类型,化学吸附过程焓变通常大于60kJ/mol,物理吸附的焓变一般小于 40kJ/mol,Si-CHAP对Pb2+吸附反应的焓变为1.477kJ/mol,说明此吸附主要以物理吸附为主.Si-CHAP对Pb2+吸附反应的熵变大于零,因为吸附过程的熵变主要取决于水合离子的解离和游离离子被吸附的两种作用,水合离子解离导致熵变增大,而游离态离子被吸附导致熵变减小,一个水合Pb2+解离会解离出多个水分子,所以水合离子解离下来的水分子多于被吸附的Pb2+导致吸附熵变为正值.

表4 不同温度下的吸附热力学常数Table 4 Thermodynamic parameters at different temperatures
3 结论
3.1 利用废弃蛋壳为钙源制备Si-CHAP,工艺流程简单,成本低廉,原材料丰富,符合绿色化学合成工艺要求.所制得Si-CHAP具有较大的比表面积、孔隙结构发育和吸附性能高等特点,有望作为重金属废水处理剂提供新的功能材料.
3.2 Si-CHAP对Pb2+的去除率和吸附容量随着pH值升高而增加,pH值大于6后基本达到吸附饱和,293,303,313K下的平衡吸附容量分别为149.19,149.23,149.26mg/g,体现了较强的吸附能力.
3.3 等温吸附方程中Langmuir方程能很好地描述Si-CHAP对Pb2+的吸附行为.对比准一级动力学方程、准二级动力学方程、Elovich方程和内部颗粒扩散方程,准二级动力学方程是最佳描述该吸附动力学模型,相关系数高于0.999.
3.4 Si-CHAP对Pb2+的吸附属于自发吸热反应,其吸附的机制主要为物理吸附.Pb2+在Si-CHAP表面覆盖率不是很高,说明通过再进一步深入研究,可以大幅度地提高Si-CHAP对Pb2+的吸附.
[1]Simsek S,Ulusoy U.Uranium and lead adsorption onto bentonite and zeolite modi fi ed with polyacrylamidoxime[J].J.Radioanal.Nucl.Chem.,2012,292:41-51.
[2]Saka C,Sahin O,Kucuk M M.Applicationson agricultural and forest waste adsorbents for the removal of lead(II)from contaminated waters[J].Int.J.Environ.Sci.Technol.,2012,9:379-394.
[3]Saleh T A,Gupta V K.Column with CNT/magnesium oxide composite for lead(II)removal from water[J].Environ.Sci.Pollut.Res.,2012,19:1224-1228.
[4]Rivas B L,Urbano B,Pooley S A,et al.Mercury and lead sorption properties of poly(ethyleneimine)coated onto silica gel[J].Polym.Bull.,2012,68:1577-1588.
[5] Shinzato M C,Montanheiro T J,Janasi V A,et al.Removal of Pb2+from aqueous solutions using two Brazilian rocks containing zeolites[J].Environ.Earth.Sci.,2012,66:363-370.
[6]Zhu Y H,Hua J,Wang J L.Competitive adsorption of Pb(II),Cu(II)and Zn(II)onto xanthate-modi fi ed magnetic chitosan[J].J.Hazard.Mater.,2012,(221/222):155-161.
[7] Machida M,Fotoohi B,Amamo Y,et al.Cadmium(II)and lead(II)adsorption onto hetero-atom functional mesoporous silica and activated carbon[J].Appl.Surf.Sci.,2012,258:7389-7394.
[8]Li X M,Zheng W,Wang D B,et al.Removal of Pb(Ⅱ)from aqueous solution by adsorption onto modified areca waste:Kinetic and thermodynamic studies[J].Desalination,2010,258:148-153.
[9]Xu H Y,Lei Y,Wang P,et al.Kinetic research on the sorption of aqueous lead by synthetic carbonate hydroxyapatite[J].J.Environ.Manage.,2008,86:319-328.
[10]Wu X W,Ma H W,Yang J,et al.Adsorption of Pb(II)from aqueous solution by a poly-elemental mesoporous adsorbent[J].Appl.Surf.Sci.,2012,258:5516-5521.
[11]Liao D X,Zheng W,Li X M,et al.Removal lead(Ⅱ)from aqueous solution using carbonate hydroxyapatite extracted from eggshell waste[J].J.Hazard.Mater.,2010,177:126-130.
[12]Fernane F,Mecherri M O,Sharrock P,et al.Sorption of cadmium and copper ions on natural and synthetic hydroxylapatite partices[J].Mater.Charact.,2008,59:554-559.
[13]Zheng W,Li X M,Yang Qi,et al.Adsorption of Cd(Ⅱ)and Cu(Ⅱ)from aqueous solution by carbonate hydroxyapatite derived from eggshell waste[J].J.Hazard.Mater.,2007,147:534-539.
[14]Rajabi-Zamani A H,Behnamghader A,Kazemzadeh A.synthesis of nanocrystalline carbonated hydroxyapatite power via nonalkoxide[J].Mater.Sci.Eng.,2008,28(8):1326-1329.
[15]Aminian A,Solati-Hashjin M,Samadikuchaksaraei A,et al.Synthesis of silicon-substituted hydroxyapatite by a hydrothermal method with two different phosphorous sources[J].Ceram.Int.,2011,37:1219-1229.
[16]郭 卓,袁 悦.介孔碳CMK-3对苯酚的吸附动力学和热力学研究 [J].高等学校化学学报,2007,28(2):289-292.
[17]Kaludjerovic-Radoicica T,Raicevicb S.Aqueous Pb sorption by synthetic and natural apatite:Kinetics,equilibrium and thermodynamic studies [J]. Chem. Eng. J.,2010,160:503-510.
[18]Naiya T K,Bhattacharya A K,Mandal S,et al.The sorption of lead(II)ions on rice husk ash[J].J.Hazard.Mater.,2009,163:1254-1264.
[19]Jang S H,Min B G,Jeong Y G,et al.Removal of lead ions in aqueous solution by hydroxyapatite/polyurethane composite foams[J].J.Hazard.Mater.,2008,152:1285-1292.
[20]Özcan A S,Gök Ö,Özcan A.Adsorption of lead(II)ions onto 8-hydroxy quinoline-immobilized bentonite[J].J.Hazard.Mater.,2009,161:499-509.
[21]Feng N C,Guo X Y.Characterization of adsorptive capacity and mechanisms on adsorption of copper,lead and zinc by modified orange peel[J].Trans.Nonferrous Met.Soc.China,2012,22:1224-1231.
[22]Li X L,Li Y F,Ye Z F.Preparation of macroporous bead adsorbents based on poly(vinylalcohol)/chitosan and their adsorption properties for heavy metals from aqueous solution[J].Chem.Eng.J.,2011,178:60-68.
[23]李雪梅,肖 平,江 韬,等.胡敏酸—针铁矿符合胶体对Pb2+的吸附特征 [J].中国环境科学,2012,32(7):1274-1279.
[24]吴光前,张 鑫,惠 慧,等.氧等离子体改性竹活性炭对苯胺的吸附特性 [J].中国环境科学,2012,32(7):1188-1195.
[25]Momčilović M,Purenović M,Bojić A,et al.Removal of lead(II)ions from aqueous solutions by adsorption onto pine cone activated carbon[J].Desalination,2011,276:53-59.
[26]Dogan M,Abak H,Alkan M.Adsorption of methylene blue onto hazelnut shell:kinetics,mechanism and activation parameters[J].J.Hazard.Mater.,2009,164(1):172-181.
[27]Lyubchik S I,Lyubhik A I,Galushko O L,et al.Kinetics and thermodynamics of the Cr(Ⅲ)adsorption on the activated carbon from co-mingled wastes [J]. Colloids Sur.A,2004,242:151-158.
[28]Sheng G D,Wang S W,Hu J,et al.Adsorption of Pb(Ⅱ)on diatomite as affected via aqueous solution chemistry and temperature[J].Colloids sur.A,2009,339:159-166.
致谢:本实验的完成得到功能有机金属材料湖南省高校重点实验室、湖南省重点建设学科资助项目的大力支持,在此表示感谢.

