阿奇霉素对沙眼衣原体感染后生殖道黏膜免疫反应的影响
王燕舞 黎 莉 孟运莲
(武汉大学基础医学院组织学与胚胎学教研室 湖北430071)
黏膜是机体与外界相隔的最大屏障,也是外源抗原进入机体的主要途径,黏膜免疫是免疫系统中一个特殊的组成部分。黏膜免疫主要由分布于消化道、呼吸道和泌尿生殖道的黏膜相关淋巴组织执行。女性生殖道的黏膜免疫和人体其它部分一样,抵御病原体的入侵,由于涉及到精子和胚胎的耐受,具有特殊性。因此研究女性生殖道的黏膜免疫对于进一步了解生殖过程有着重要的意义。
沙眼衣原体(Chlamydia trachomatis,Ct)是女性生殖道感染最常见的致病菌,因其症状隐匿性,常常被女性所忽视。然而,因沙眼衣原体感染导致的不孕不育、异位妊娠等严重并发症使其日益受医学界重视[1]。大量研究已证实生殖道黏膜免疫反应与沙眼衣原体感染造成机体组织损伤有重大关联[2]。沙眼衣原体感染常用阿奇霉素或多西环素治疗[3]。有研究表明,多种大环内酯类抗生素如红霉素、克拉霉素及阿奇霉素对免疫系统具有一定的调节活性,例如抑制中性粒细胞趋化、突发性氧化作用及单核细胞促炎症细胞因子的释放等[4]。而近年来研究发现,阿奇霉素也可在一定程度上抑制促炎症细胞因子的产生[5]。
鉴于此,对阿奇霉素治疗后生殖道沙眼衣原体感染的黏膜免疫状况进行研究,不仅能明确其对感染后黏膜免疫的影响,也可以指导临床用药、预测疾病的转归。
材料和方法
1.动物分组和沙眼衣原体感染模型构建
将沙眼衣原体E型株(武汉大学基础医学院保存),在hela细胞中培养扩增,收集细胞后,高速离心分离衣原体。
SPF级成年雌性BALB/c小鼠,由武汉大学动物实验中心出售。小鼠皮下注射黄体酮(浙江仙琚制药股份有限公司)2.5mg/只,连续7天,给足食、水,笼中喂养。7天后,38只建模小鼠用1ml的无菌注射器,通过阴道在子宫角接种沙眼衣原体(106IFU/ml,30ul);对照组6只小鼠,用不含衣原体的hela细胞培养液接种(30μl)。接种7天后取阴道拭子分离沙眼衣原体,检测感染的阳性率。
将建模成功的小鼠随机分为两组:生理盐水组和阿奇霉素组。阿奇霉素组给予阿奇霉素(希舒美,辉瑞制药有限公司)80mg/kg[6],灌胃,1 次。对照组和生理盐水组给予等量无菌生理盐水灌胃。
2.免疫学检测
2.1标本采集
给药当天、给药7天、14天、21天分别取小鼠阴道拭子进行沙眼衣原体的分离,检测沙眼衣原体的感染。给药第七天给药21天摘眼球取血,颈椎脱臼法处死小鼠,取出完整阴道和子宫。迅速放入4%多聚甲醛中固定24h,常规石蜡切片,用于HE染色、肥大细胞染色和免疫组化检测。
2.2肥大细胞染色
甲苯胺蓝染液配制:甲苯胺蓝(北京化学试剂公司)1g溶于100ml蒸馏水。石蜡切片脱蜡入水,1%甲苯胺蓝染液2min;自来水洗2次,去掉浮色;常规酒精脱水,二甲苯透明,封片。
2.3免疫组织化学染色
采用SABC染色法。用已知阳性片作为阳性对照,以PBS代替一抗作为阴性对照。实验使用兔多克隆抗体Anti-CD11c(树突状细胞标志物,购自北京博奥森生物技术公司),稀释度1∶100。SABC试剂盒和二氨基联苯(DAB)显色试剂盒购自武汉博士德生物工程有限公司。
2.4血清中IL-6和TNF-a浓度测定
酶联免疫吸附法(ELISA)测定三组小鼠血清中IL-6和TNF-a的浓度,小鼠ELISA试剂盒购自美国R&D system公司。按试剂盒说明书进行检测。
2.5统计学分析
各指标以均数±标准差表示,各组实验数据均用SPSS统计软件进行分析,以P<0.05为差异有显著性。
结 果
1.构建生殖道沙眼衣原体感染动物模型
建模小鼠外阴出现轻微感染症状,略显红肿,分泌物稍多,颜色清亮,部分小鼠出现毛发脱落;阿奇霉素治疗后,小鼠外阴基本正常,无分泌物。
2.小鼠生殖道沙眼衣原体感染率
阴道拭子分离培养结果显示,对照组阳性率为0,说明实验过程无污染。给药21天生理盐水组的自然转阴率约20%左右。给药7天,阿奇霉素组衣原体感染率降至最低,之后出现反弹,最终的感染率约17%(如图1),明显低于生理盐水组(P<0.05)。
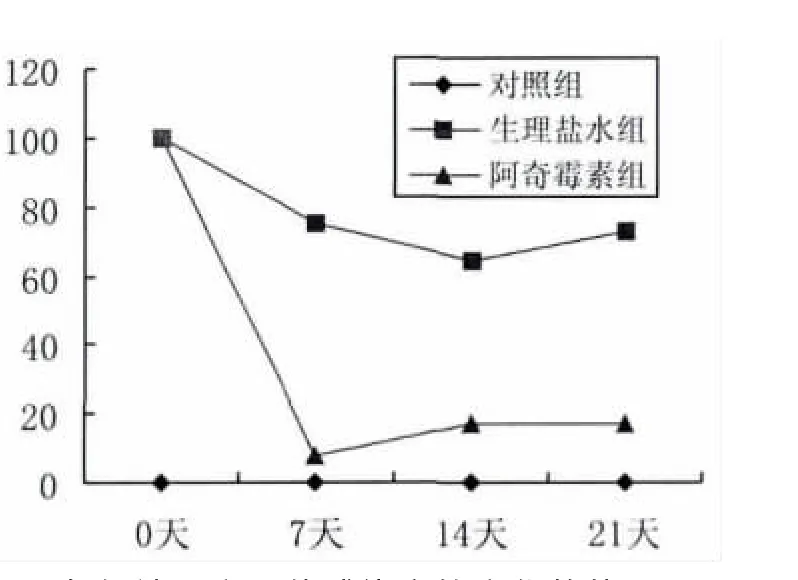
图1 各组沙眼衣原体感染率的变化趋势Fig.1The tendency of chlamydial trachomatis infection rate in different groups
3.小鼠生殖道组织病理改变
如图1所示,对照组子宫和阴道黏膜上皮细胞排列密集,形态正常,间质无充血水肿,腔内无渗出物(图3A和3D)。生理盐水组子宫黏膜上皮脱落,间质充血水肿,腔内可见少量渗出物,说明沙眼衣原体上行感染子宫(图3B);阴道黏膜存在明显的炎症表现,细胞形态紊乱,间质细胞增生、血管扩张,腔内有细胞渗出(图3E)。阿奇霉素组子宫黏膜结构正常(图3C);阴道黏膜上皮细胞染色较深,细胞体积较小,排列密集,间质未见血管扩张,腔内未见渗出物。黏膜内亦可见大量的未分化细胞(图3F)。
4.阴道和子宫颈黏膜肥大细胞和树突状细胞的分布
生殖道的黏膜免疫是重要的防御屏障,生理状态下,子宫和阴道黏膜内存在肥大细胞(图4A)和树突状细胞(图4D)。微生物的感染不仅会引起正常组织结构的破坏,也会造成黏膜微环境的改变。在生理盐水组的生殖道黏膜内,肥大细胞和树突状细胞的数量较对照组明显增加(表1;图4B和E)。阿奇霉素组黏膜内的肥大细胞数量与对照组无明显差异(表1;图4C);树突状细胞的数量较生理盐水组明显增加(表1;图4F)。水组比较,P<0.05。△:Compared with Control group,P<0.05.
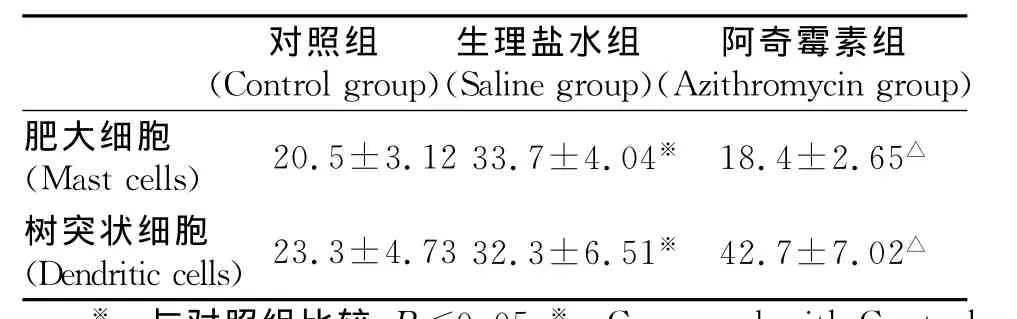
表1 阿奇霉素治疗后小鼠生殖道黏膜肥大细胞和树突状细胞数量Table 1 The amount of mast cells and dendritic cells in the mucosa of mice genital tract after azithromycin treatment(¯x±s)
5.血清免疫因子IL-6和TNF-α浓度
感染沙眼衣原体后,小鼠血清IL-6的浓度均较正常组升高;阿奇霉素治疗后,小鼠血清中高浓度的IL-6持续时间较生理盐水组长(P<0.05)(如图2)。TNF-α的浓度在阿奇霉素治疗组浓度较对照组和生理盐水组升高,且持续时间长。
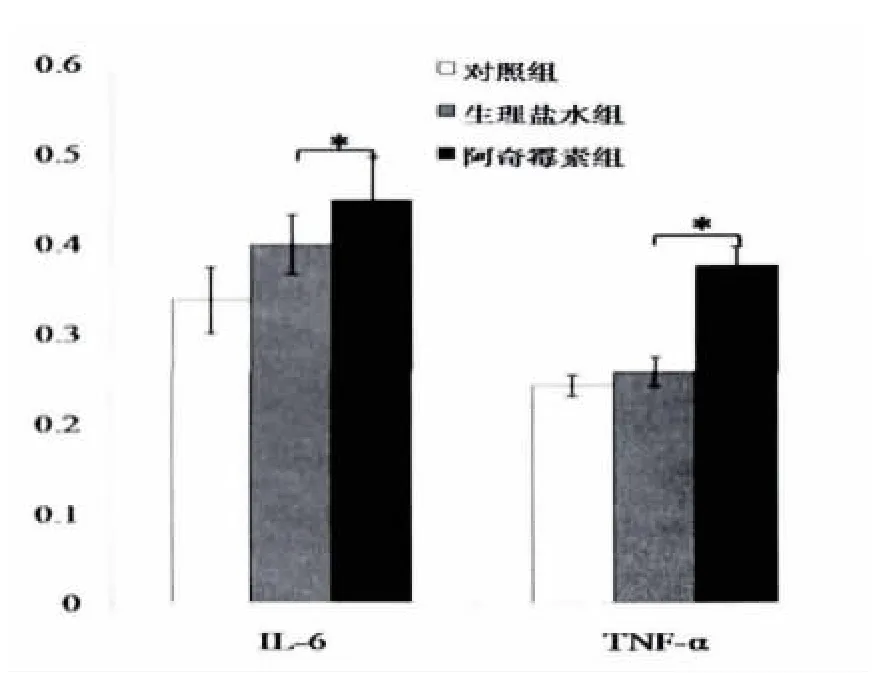
图2 阿奇霉素治疗后小鼠血清IL-6和TNF-α浓度(±s)Fig.2The concentration of serum IL-6and TNF-αafter azithromycin treatment.
讨 论
生殖道沙眼衣原体感染后机体所产生的免疫反应,包括由巨噬细胞、树突状细胞、中性粒细胞和肥大细胞等参与的非特异性免疫反应和由CD4+和CD8+细胞介导的黏膜免疫反应。目前认为,沙眼衣原体感染所产生的免疫病理反应是导致严重并发症的主要原因,而这种免疫病理反应的机制是Th1/Th2比例失调[7]:在清除机体沙眼衣原体感染时,CD4+T细胞和IFN-γ发挥了重要的作用;然而CD8+T细胞。
1.阿奇霉素对黏膜局部免疫细胞的影响
肥大细胞是机体抗感染免疫的第一线细胞。大多情况下,肥大细胞执行免疫防御的功能,但也可对宿主造成损伤。肥大细胞在沙眼衣原体感染后的生殖道持续增多,通过分泌细胞因子IL-4,诱导CD4+T淋巴细胞向Th2细胞方向转化,导致生殖道黏膜内Th1/Th2比例失调,加重黏膜免疫病理损伤[8]。给予阿奇霉素治疗后,生殖道黏膜的肥大细胞数量与对照组无显著性差异,提示黏膜局部的免疫病理损伤程度较轻。
生殖道黏膜内存在的CD11+的树突状细胞,不仅能提呈抗原,并与CD4+细胞发生抗原依赖性聚集,引发T、B细胞的增殖分化和一系列免疫反应。树突状细胞的数量和功能状态可一定程度反映机体免疫机能。阿奇霉素治疗组的小鼠,生殖道黏膜内的树突状细胞数量明显增加,势必激发Th1型免疫反应,有效的控制感染,减轻病理损伤[9]。
阿奇霉素治疗后,子宫和阴道黏膜形态基本正常;肥大细胞数量无明显变化;树突状细胞的数量增加,均说明生殖道黏膜内感染得到有效控制、免疫病理损伤减轻。
2.阿奇霉素对血清内细胞因子的影响
阴道、宫颈、输卵管上皮、子宫内膜上皮和基质细胞都有抗原提呈功能[10],并可以分泌多种生物活性物质和细胞因子参与和调节黏膜免疫反应,IL-6就是其中一种[11]。IL-6是 Th2细胞因子,可促进Th2细胞的增殖和分化[12]。TNF-α是Th1细胞因子,可以促进Th1型细胞的增殖和分化。本研究结果显示生理盐水组的小鼠,血清内IL-6浓度升高,TNF-α的浓度无明显改变,导致Th1/Th2比例失衡。阿奇霉素治疗后,血清IL-6浓度升高,同时,血清内TNF-α浓度亦升高,有助于维持Th1/Th2比例平衡。TNF-α在沙眼衣原体感染中的作用目前尚无定论。最近有研究报道TNF-α基因敲除的小鼠亦能顺利清除沙眼衣原体的感染,并且上行性感染的发生率较野生型小鼠降低。提示TNF-α在机体对抗沙眼衣原体的感染中,不仅不是必须的,而且有可能增加病理损伤[13]。本研究结果提示阿奇霉素治疗后TNF-α浓度升高,有助于治愈沙眼衣原体感染。因此,沙眼衣原体的清除是多种细胞和细胞因子协同作用的结果,尽管某种细胞因子的作用可能不是必须的,但是却不能否认其在感染过程中发挥的作用。
根据目前的研究结果,我们认为阿奇霉素使用后,能有效的清除病原体,同时通过影响细胞因子的分泌,诱导树突状细胞等抗原呈递细胞在生殖道黏膜聚集、合成与分泌细胞因子,减轻黏膜免疫病理损伤,保证了黏膜的完整性。阿奇霉素使用后,对黏膜内细胞结构和功能的影响机制,有待于我们进一步研究。
[1]World Health Organization.Prevention and control of sexually transmitted infections:draft global strategy.[http://www.who.int].WHO,2006
[2]Johnson RM.Murine oviduct epithelial cell cytokine responses to Chlamydia muridarum infection include interleukin-12-p70secretion.Infect Immun,2004,72(7):3951-3960
[3]Thomson NR,Clarke IN.Chlamydia trachomatis:small genome,big challenges.Future Microbiol,2010,5(4):555-561
[4]Srivastava P,Jha HC,Salhan IN,et al.Azithromycin treatment modulates cytokine production in Chlamydia trachomatis infected women.Basic Clin Pharmacol Toxicol,2009,104(6):478-482
[5]Peric A,Vojvodic D,Baletic N,et al.Influence of allergy on the immunomodulatory and clinical effects of long-term low-dose macrolide treatment of nasal polyposis.Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2010,154(4):327-333
[6]Tuffrey M,Woods C,Inman C,et al.The effect of a single oral dose of azithromycin on chlamydial infertility and oviduct infrastructure in mice.Journal of Antimicrobial Chemotherapy,1994,34,989-999
[7]O'Meara CP,Armitage CW,Harvie MC,et al.Immunization with a MOMP-Based Vaccine Protects Mice against a Pulmonary Chlamydia Challenge and Identifies a Disconnection between Infection and Pathology.PLoS ONE,2013,8(4):e61962
[8]王燕舞,孟运莲,罗善云等.肥大细胞在大鼠输卵管急性沙眼衣原体感染中的作用。中国组织化学与细胞化学杂志,2002,11(2):205-207
[9]LüH,Wang H,Zhao HM,et al.Dendritic cells(DCs)transfected with a recombinant adenovirus carrying chlamydial major outer membrane protein antigen elicit protective immune responses against genital tract challenge infection.Biochem Cell Biol,2010,88(4):757-765
[10]Ochiel DO,Rossoll RM,Schaefer TM,et al.Effect of oestradiol and pathogen ‐ associated molecular patterns on class II‐ mediated antigen presentation and immunomodulatory molecule expression in the mouse female reproductive tract.Immunology,2012,135(1):51-62
[11]Wira CR,Fahey JV,Ghosh M,et al.Sex Hormone Regulation of Innate Immunity in the Female Reproductive Tract:The Role of Epithelial Cells in Balancing Reproductive Potential with Protection against Sexually Transmitted Pathogens.American Journal of Reproductive Immunology,2010,63(6):544-565
[12]Sze HoL,He Q,Chen J,et al.Interaction between endometrial epithelial cells and blood leucocytes promotes cytokine release and epithelial barrier function in response to Chlamydia trachomatis lipopolysaccharide stimulation.Cell Biol Int.2010,34(9):951-958
[13]Kamalakaran S,Chaganty BK,Gupta R,et al.Vaginal chlamydial clearance following primary or secondary infection in mice occurs independently of TNF-α.Front Cell Infect Microbiol,2013,3:11
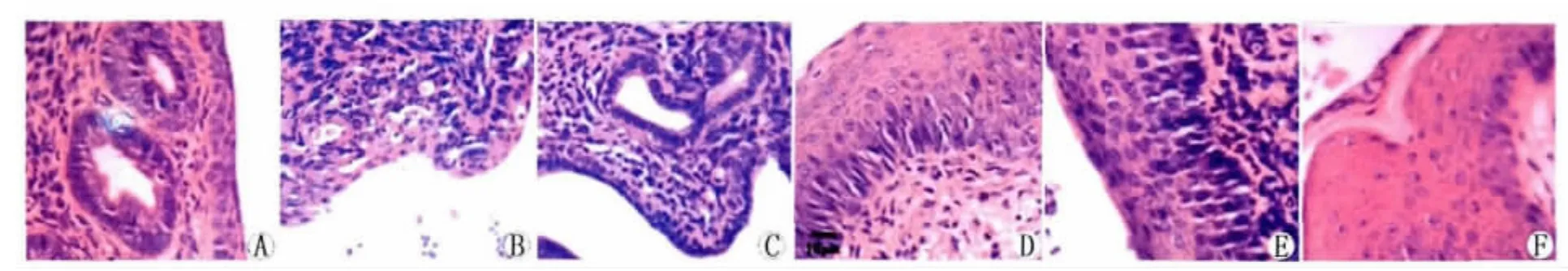
图3 阿奇霉素治疗后生殖道沙眼衣原体感染小鼠阴道和子宫组织病理变化.HE×400A:对照组小鼠子宫;B:生理盐水组小鼠子宫;C:阿奇霉素组小鼠子宫;D:对照组小鼠阴道;E:生理盐水组小鼠阴道;F:阿奇霉素组小鼠阴道Fig.3Histopathology of uteri and vaginae of mice infected with Chlamydial trachomatis following administration with azithromycin.HE×400A.Uterus of Control group;B.Uterus of Saline group;C.Uterus of Azithromycin group;D.Vaginal of Control group;E.Vaginal of Saline group;F.Vaginal of Azithromycin group

图4 阿奇霉素治疗后生殖道沙眼衣原体感染小鼠黏膜肥大细胞和树突状细胞的分布.SABC×200A:对照组肥大细胞;B:生理盐水组肥大细胞;C:阿奇霉素组肥大细胞;D:对照组树突状细胞;E:生理盐水组树突状细胞;F:阿奇霉素组树突状细胞Fig.4The distribution of mast cells and dendritic cells in the mucosa of the mouse genital tract after azithromycin treatment.SABC×200A.Mast Cells of Control group;B.Mast Cells of Saline group;C.Mast Cells of Azithromycin group;D.Dendritic cells of Control group;E.Dendritic cells of Saline group;F.Dendritic cells of Azithromycin group

