侧脑室注射硫化氢对大鼠血压和呼吸的调节作用
高 艳 宋 俊 殷 焦 李道坤 邵金辉 袁 杰
(1湖北文理学院形态学部 襄阳441053;2襄阳市中心医院骨外科 襄阳441021;3湖北医药学院生理教研室 十堰442000)
长期以来,硫化氢(hydrogen sulfide,H2S)一直被认为是一种污染环境的毒性气体,它可以损害中枢神经系统,抑制呼吸[1,2]。最近,机体内源性产生的H2S作为一种重要的生理调节分子引起学术界的重视。内源性H2S在体内由半胱氨酸在胱硫脒-β-合酶(cystathionine-β-synthase,CBS)和胱硫脒-γ-裂解酶(cystathionine-γ-1yase,CSE)作用下生成,可以调 节 神 经 元 兴 奋 性[3,4]。1995 年 Awata等[5]实验证实了内源性H2S的酶学产生机制,在6个不同的脑区中测定了CBS和CSE的活性。此后Abe和Kimura进一步用Northern印迹法分析证实了CBS在脑内的转录表达(海马、小脑、大脑皮层、脊髓脑内段),且CBS在海马高度表达而没有CSE mRNA的表达[6,7];CBS抑制剂降低了脑内 H2S的产生,而CBS激活剂增加了H2S的产生;进一步确定CBS是脑中产生H2S的主要酶。在生理情况下,脑组织 H2S的浓度是50-160μM[6]。生理浓度的H2S可以特异地增强N-甲基-D-天冬氨酸(NMDA)受体调节的神经系统反应,诱导海马长时程增强(LTP),使原代培养的神经元cAMP增加[7],调节垂体-肾上腺素轴功能及神经元兴奋性[8]。这些发现提示H2S在脑内作为内源性神经调节物的功能。前期的实验证实,内源性产生的H2S可以舒张血管平滑肌,降低血压;通过影响丝裂素活化蛋白激酶途径抑制平滑肌细胞增殖,抑制离体心肌收缩功能。静脉注射硫化氢供体可产生短暂负性肌力及降低中心静脉压的作用[5,9]。然而,中枢H2S对心血管和呼吸系统的影响尚不清楚,本实验拟观察中枢注射硫氢化钠(H2S的供体)对正常大鼠血压、心率和呼吸的影响,分析其中枢效应的可能机制,以探讨H2S在心血管及呼吸系统内稳态调节中的作用。
材料和方法
1.材料
所有动物实验均按照中华人民共和国卫生部动物实验标准执行(文件号:55,2001)。雄性SD大鼠(250-300g)由北京大学医学部实验动物中心提供。酚妥拉明(Phentolamine)、格列苯脲 (Glibenclamide)和吡那地尔(Pinacidil)购自Sigma公司(Sigma Co.,St.Louis),余为市售分析纯产品。
2.侧脑室套管的固定与给药
参照本人以前工作的方法[10],大鼠戊巴比妥钠(40mg/kg,i.p)麻醉后固定于定位仪上,切开头顶皮肤,暴露颅骨,按Kǒnig &klippel图谱,用牙科钻于前囟点向后0.8mm,向右旁开1.5mm交点处钻孔,向侧脑室(ICV)植入不锈钢同芯套管,外管插入深度2.5mm,用牙托粉和502胶固定。内管接塑料细管与微量注射器相连,内管较外管前端长1mm,故注射深度为3.5mm。实验大鼠随机分组,侧脑室内分别注射5ul下述不同药物(注射速度控制在30μl/min)。
2.1ICV一次性注射
(1)生理盐水(NS)组,注射生理盐水作为对照(n=8);(2)H2S组,分别注射4、40、400nmol/100g和1.0μmol/100g的饱和 H2S盐溶液(每个剂量组均n=8),以上各组均连续观察20min。
2.2ICV连续注射
ICV内微型注射泵分别连续注射NS(0.01μmol/min)和 H2S盐溶液(1nmol/min),连续观察120min。(每个剂量组均n=8)。
2.3K+-ATP通道干预组
(1)二甲基亚砜(DMSO)组,ICV 内注射1∶10000的等渗DMSO溶液;(2)H2S组,ICV内注射1μmol/100g的 H2S;(3)glibenclamide组,ICV 内注射10pmol/100g的 K+-ATP通道阻断剂glibenclamide;(4)Pinacidil组,ICV 内 注 射 10pmol/100g的 K+-ATP 通道开放剂 Pinacidil;(5)glibenclamide+H2S组,ICV内预先注射10pmol/100g的K+-ATP通道阻断剂glibenclamide,10min后再注射1μmol/100g的 H2S;(6)Pinacidil+H2S组,ICV内预先注射10pmol/100g的K+-ATP通道开放 剂 Pinacidil,10min 后 再 注 射 1μmol/100g 的H2S。以上各组连续观察20min。
2.4酚妥拉明干预组
(1)NS组,ICV内注射5μl的 NS;(2)H2S组,ICV内注射1μmol/100g的H2S;(3)酚妥拉明+NS组,股 静 脉 注 射 100μl的 含 10μg/kg 的 酚 妥 拉明[11],10min后再ICV 内注射5μl NS;(4)酚妥拉明+H2S组,股静脉注射酚妥拉明10min后,再ICV内注射1μmol/100g的H2S。以上各组观察20min。实验结束后注射5μl美蓝,以检测注射部位的准确性。
3.血压、心率测定
麻醉大鼠左股动脉插入含充盈肝素生理盐水的动脉插PE50管进入股动脉,经压力换能器(YH21型)连接四道生理记录仪(4SAustralia),术后稳定30min分别记录各组大鼠的平均动脉血压(MAP)和心率(HR),药物注射后连续观察相应时间后结束实验。
4.呼吸幅度和频率测定
麻醉大鼠气管插管后经压力换能器(HX101型)连接四道生理记录仪(4SAustralia),术后稳定30min分别记录各组大鼠的吸气、呼气幅度和呼吸率,药物注射后连续观察相应时间后结束实验。结果以变化的%表示。
5.统计学处理
实验结果以均数±标准差(¯x±s)表示,多组资料采用 one-way ANOVA 方法,组间用 Student-Newman-keuls法进行统计学处理。P<0.05为差异具有显著性。
结 果
1.ICV一次性注射H2S对大鼠心率和血压的影响。
ICV 注射5μl 4nmol/100g H2S盐溶液后,大鼠MAP迅速降低,而 HR没有变化;ICV注射5μl 40、400nmol/100g和1μmol/100g H2S,均能够剂量依赖性的导致大鼠MAP急剧的下降,而后又迅速的上升。其最大降低幅度分别是7.8±2.3、11.4±2.6和16.1±3.6mmHg,最大上升幅度分别是9.2±3.4、12.2±2.1和20.8±2.5mmHg,各组变化显著的各时间点统计学均有显著差异(P<0.001)。降压持续时间较短,而升压持续时间可达30min。ICV注 射 5μl 40nmol/100g H2S 对 HR 没 有 影 响,400nmol/100g和1μmol/100g H2S在注射后3min内可剂量和时间依赖性的减慢 HR,其中1μmol/100g H2S减慢心率的作用最显著,其最大值是34±6bpm。变化显著各组各时间点统计学均有显著差异(P<0.001),如图1,2所示。

图1 ICV不同浓度的H2S对MAP影响图2 CV不同浓度的H2S对心率的影响Fig.1The changes of mean arterial blood pressure by I.C.V.bonus injection different concentration hydrogen sulfide.Fig.2The changes of heart rate by I.C.V.bonus injection different concentration of hydrogen sulfide.
2.ICV一次性注射H2S对大鼠呼吸频率和深度的影响。
ICV 注射5μl 4nmol/100g H2S盐溶液后,大鼠呼吸频率和深度没有显著的变化;ICV注射5μl 40、400nmol/100g和1μmol/100g H2S,可剂量依赖性减慢呼吸频率,持续时间在10分钟左右,各组间均有统计学意义(P<0.001,图3),而后呼吸频率恢复正常;能够剂量依赖性的显著增加大鼠呼气和吸吸气深度,在前1分钟内变化最显著,各组间均有统计学意义(P均<0.001,图4A,B)。

图3 ICV不同浓度的H2S对呼吸频率的影响图4 ICV不同浓度的H2S对呼吸深度的影响(A:吸气深度,B:呼气深度)Fig.3The changes of respiratory frequence by I.C.V.bonus injection different concentration of hydrogen sulfide.Fig.4The changes of expiration amplitude by I.C.V.injection hydrogen sulfide.A:respiratory amplitude B:expiration amplitude.
3.ICV连续注射H2S对大鼠血压、心率和呼吸的影响。
ICV连续注射生理盐水,连续观察120min内大鼠血压和心率没有显著变化,连续注射H2S(1nmol/min)后,大鼠 MAP迅速的先降低后升高而后缓慢增加,在110min时达到最高值38±8.6 mmHg,观察期内血压没有下降。与对照组比较,各时间点差异均有统计学意义(P<0.001)。对心率和呼吸没有明显的影响(结果没有列出),如图5所示。
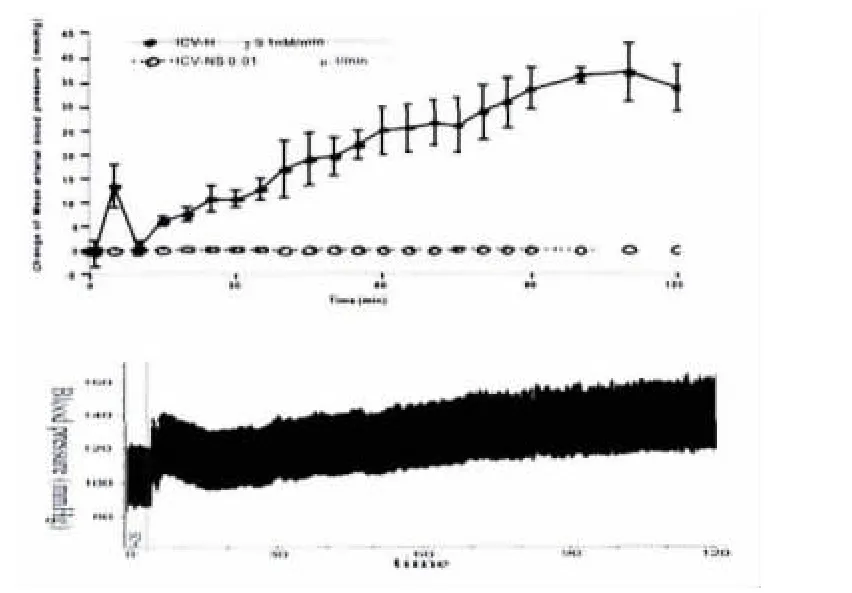
图5 ICV内连续注射H2S对MAP影响Fig.5The changes of mean arterial blood pressure by I.C.V.continuous infusion hydrogen sulfide(1nM/min).
4.K+-ATP通道调节剂对H2S升压的调节作用。
ICV 内给予1μmol/100g H2S,第10sMAP值是-9.87±2.34mmHg,此后迅速升高。DMSO溶剂和K+-ATP通道阻断剂Glibenclamide对血压和心率没有显著的影响;给予 K+-ATP通道开放剂Pinacidil可显著的降低血压,但心率没有显著变化。Glibenclamide可阻断H2S和K+-ATP通道开放剂Pinacidil的降压作用,但不能够阻断H2S的升压效应(结果没有列出),与H2S组比较,变化有显著差异(P<0.001),结果如图6所示。
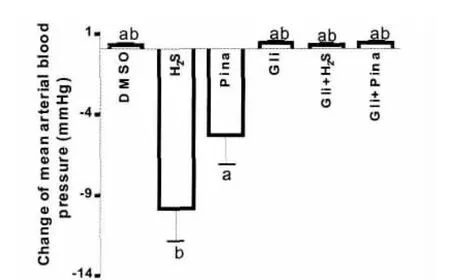
图6 ICV内注射K+-ATP通道调节剂对H2S作用的影响(a,b:P<0.001,与其它各组比较)Fig.6The effect of KATP channel blocker-glibenclamide on transient hypotension induced by I.C.V.hydrogen sulfide.(a,b:P<0.001versus other groups)
5.酚妥拉明对H2S升压的调节作用
外周给予酚妥拉明对血压没有显著的影响,但其可显著抑制脑室给予H2S的升高血压减慢心率效应(P<0.01),结果如图7所示。
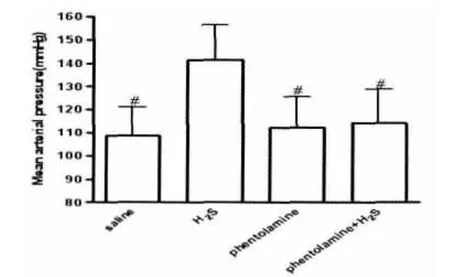
图7 静脉注射酚妥拉明后中枢H2S对MAP影响(#P<0.01,与H2S组比较)Fig.7Pretreatment with phentolamine by venous injection,then the alterations of MAP indeced by I.C.V.hydrogen sulfide.#P<0.01versus H2S.
讨 论
越来越多的科学证据表明,硫化氢(H2S)是继一氧化氮和一氧化碳后被确认的第三个气体信号分子。在过去的十年中,内源性H2S被发现在哺乳动物有广泛的生理和病理生理的调节作用,尤其是其在心血管系统和中枢神经系统的作用。越来越多的研究表明,中枢神经系统内源性H2S可作为一种新型功能性神经递质。最近的报告表明,侧脑室注射硫氢化钠可增加平均动脉血压,激活下丘脑CBS或诱导瞬时降血压的作用[12,13],表明中枢 H2S可能具有调节心血管系统功能的作用。
研究发现中枢H2S对MAP具有双相的调节作用。ICV注射H2S饱和气体缓冲液,可诱导瞬时降低血压的反应,随后血压和脉压以剂量依赖的方式急剧升高。但这种影响是短暂的,MAP可在20分钟内恢复正常水平。ICV内连续注射H2S,大鼠MAP迅速的先降低后升高而后缓慢增加,与中枢一次性给予H2S的作用一致。这些实验结果支持H2S作为一个内源性气体信号分子快速和瞬时生物作用的特征。在本研究中我们使用的H2S饱和气体缓冲液得到的结果,与Ufnal使用的硫氢化钠的研究是一致的[12]。H2S饱和气体缓冲液包括可溶性H2S气体和HS-,并可动态释放H2S气体;而硫氢化钠可以释放1/3左右的H2S气体,并且需要氢离子,这可能解释在Ufnal的工作中高浓度的硫氢化钠对血压影响很小的原因[12]。我们的研究中提供的气体形式H2S越多,越可以增加其向神经元细胞的转移速度,可能引起短暂性低血压效应,与下丘脑注入硫氢化钠诱导降低血压相符合[13]。Russo等证实,H2S可以选择性的抑制下丘脑中促肾上腺皮质激素释放激素(CRH)的释放[8],而中枢给予微量促肾上腺皮质激素可导致血压降低和心率减慢[14]。此外,我们发现中枢一次性给予H2S后,可导致动物急剧的深慢呼吸效应,但随后可保持平稳的呼吸运动。由于深慢呼吸能够影响血压,因此,本工作进一步观察了ICV H2S对呼吸的影响。我们的结果显示,中枢H2S对呼吸影响的持续时间基本与动脉血压降低的时间相对应,由此推测H2S导致的急剧呼吸深度的增加也可能是血压降低的原因。但目前尚不清楚中枢H2S对呼吸作用的确切机制。
K+-ATP通道参与了中枢神经系统介导的调节血压机制。研究使用不同K+-ATP通道的调节剂,结果表明K+-ATP通道阻断剂可阻断中枢H2S和中枢K+-ATP通道开放剂的降压作用,与Dawe等的研究结果一致[13]。但不能够阻断中枢H2S的升压效应,提示H2S升高血压还有其他机制。为明确H2S中枢升压是否与交感神经活化有关,本工作外周给予酚妥拉明后发现,酚妥拉明可抑制中枢H2S升高血压减慢心率效应。此外,已有的研究发现,生理浓度的H2S可以加强NMDA受体介导的兴奋性电流,增加神经元胞体内的腺苷酸环化酶水平,腺苷酸环化酶增加可以使背角、杏仁核和新纹状体NMDA电流增强[6]。而在大鼠孤束核的联合亚核 (commissural subnucleus of the NTS(comNTS))微量注射NMDA可剂量依赖性的升高血压,这个效应可被肾上腺素受体拮抗剂哌唑嗪阻断[15],由此推测H2S中枢升压效应可能通过NMDA受体介导,兴奋交感神经所致。交感神经激活与心动过速是密切相关,而我们目前的数据表明,H2S具有使心动过缓的作用,提示H2S对血流动力学的作用还包括其他机制。
研究发现中枢H2S对血压具有双相调节作用,其短暂的降低血压减慢心率效应可能是通过K+-ATP通道和影响呼吸所致;升高血压可能是由NMDA受体介导,兴奋中枢交感神经所致。目前,中枢H2S对呼吸的作用机制尚不清楚,值得深入研究。
[1]Guidotti TL,Hydrogen sulphide.Occupational medicine,1996,46:367-371
[2]Warenycia MW,Goodwin LR,Benishin CG,et al.A-cute hydrogen sulfide poisoning.Demonstration of selective uptake of sulfide by the brainstem by measure-ment of brain sulfide levels.Biochemical pharmacology,1989,38:973-981
[3]Stipanuk MH,Beck PW.Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat.The Biochemical journal,1982,206:267-277
[4]Swaroop M,Bradley K,Ohura T,et al.Rat cystathionine beta-synthase.Gene organization and alternative splicing.The Journal of biological chemistry,1992,267:11455-11461
[5]Awata S,Nakayama K,Suzuki I,et al.Changes in cystathionine gamma-lyase in various regions of rat brain during development.Biochemistry and molecular biology international,1995,35:1331-1338
[6]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator.The Journal of neuroscience:the official journal of the Society for Neuroscience,1996,16:1066-1071
[7]Kimura H.Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor.Biochemical and biophysical research communications,2000,267:129-233
[8]Dello Russo C,Tringali G,Ragazzoni E,et al.Evidence that hydrogen sulphide can modulate hypothalamo-pituitary-adrenal axis function:in vitro and in vivo studies in the rat.Journal of neuroendocrinology,2000,12:225-233
[9]Zhao W,Wang R.H(2)S-induced vasorelaxation and underlying cellular and molecular mechanisms.American journal of physiology Heart and circulatory physiology,2002,283:H474-480
[10]任永生,余正堂,刘青云等.脑室注射Intermedin1-53对大鼠血压和心率的调节作用.高血压杂志,2006,14:201-205
[11]Taylor MM,Bagley SL & Samson WK.Intermedin/adrenomedullin-2acts within central nervous system to elevate blood pressure and inhibit food and water intake.American journal of physiology Regulatory.integrative and comparative physiology,2005,288:R919-927
[12]Ufnal M,Sikora M & Dudek M.Exogenous hydrogen sulfide produces hemodynamic effects by triggering central neuroregulatory mechanisms.Acta neurobiologiae experimentalis,2008,68:382-388
[13]Dawe GS,Han SP,Bian JS,et al.Hydrogen sulphide in the hypothalamus causes an ATP-sensitive K+channel-dependent decrease in blood pressure in freely moving rats.Neuroscience,2008,152:169-177
[14]Brown S,Chitravanshi VC &Sapru HN.Cardiovascular actions of adrenocorticotropin microinjections into the nucleus tractus solitarius of the rat.Neuroscience,2006,143:863-874
[15]Almado CE,Machado BH.Respiratory and autonomic responses to microinjection of NMDA and AMPA into the commissural subnucleus of the NTS of awake rats.Brain research,2005,1063:59-68

