P53、PCNA、ki-67在大肠癌中的表达与临床意义
黄志伟 蔡雪彦
(广东省中山市人民医院病理科528403)
大肠癌是常见的恶性肿瘤之一,是多种致癌因素作用下发生的恶性病变。我国大肠癌发病率近些年以较快的速度增加,尤以城市为甚,我国年轻人直肠癌发病率有增高趋势,且预后较差。本研究应用免疫组织化学法检测P53(突变型)、PCNA、ki-67在53例大肠癌中的表达,研究其与大肠癌及临床病理因素的关系,旨在为大肠癌临床的诊疗提供一定的依据。
材料和方法
1.材料
标本来源于2008年2月至2010年12月广东中山市人民医院病理科大肠癌临床手术切除组织石蜡切片存档标本。标本经10%甲醛固定,常规石蜡包埋。大肠癌共53例,其中男29例,女24例;年龄18-82岁,≤55岁者13例,>55岁者40例;按肿瘤大小分:≥4cm肿瘤20例,<4cm肿瘤33例;按肿瘤所在部位分:肿瘤部位位于乙状结肠16例,位于直肠37例。28例正常对照组织标本为大肠粘膜。
2.主要试剂
鼠抗人P53、PCNA、ki-67单抗(上海长嘉生物公司);即用型超敏SP试剂盒(福州迈新生物公司);DAB显色试剂盒(福州迈新生物公司)。
3.方法
3.1具体步骤
每例石蜡标本连续切片(厚4μm)常规脱蜡入水;抗原修复;滴加3%过氧化氢阻断过氧化酶、正常山羊血清封闭液、一抗、二抗、链霉菌抗生物素-过氧化酶溶液后,经DAB显色,苏木素复染,梯度酒精脱水、二甲苯透明后中性树胶封片观察。空白对照试验:用PBS代替一抗作为阴性对照组。
3.2免疫组织化学结果判断
每一批免疫组化均设已知阳性对照和用PBS代替一抗的空白对照。P53、PCNA、ki-67阳性表达定位于细胞核内。以组织结构及背景清晰,细胞内有明显的棕黄色颗粒染色为阳性细胞。判定标准参照1996年全国免疫组织化学技术与诊断标准化专题研讨会意见,以连续观察10个高倍视野(10×40),免疫反应阳性细胞数超过25%作为组织阳性诊断标准。免疫反应阳性细胞数占总细胞数小于25%为 (-),25%-50% 为 (+),51%-75% 为 (++),大于75%为(+++)。
4.统计学处理
实验结果数据应用SPSS13.0统计软件进行统计分析,各蛋白表达与大肠癌临床病理关系采用四格表χ2检验或等级资料的秩和检验;各蛋白表达相关性分析采用Spearman分析;检验水准α=0.05,P<0.05为差异有统计学意义,P<0.01为差异有显著性统计学意义。
结 果
1.HE染色结果
大肠正常粘膜组织共28例,镜下可见肠腺体大小较一致,腺管细胞成整齐单层排列,细胞核浆比例正常,间质少量淋巴细胞、浆细胞及单核细胞浸润,胞核未见明显异型。
大肠癌标本共53例,镜下可见癌细胞聚集,排列紊乱,细胞异型明显。肿瘤侵及粘膜下层1例,侵及浅肌层3例,侵及深肌层13例,侵及全层35例,侵及浆膜外1例;伴淋巴结转移19例,无淋巴结转移34例。
2.免疫组化结果
2.1P53与大肠癌关系
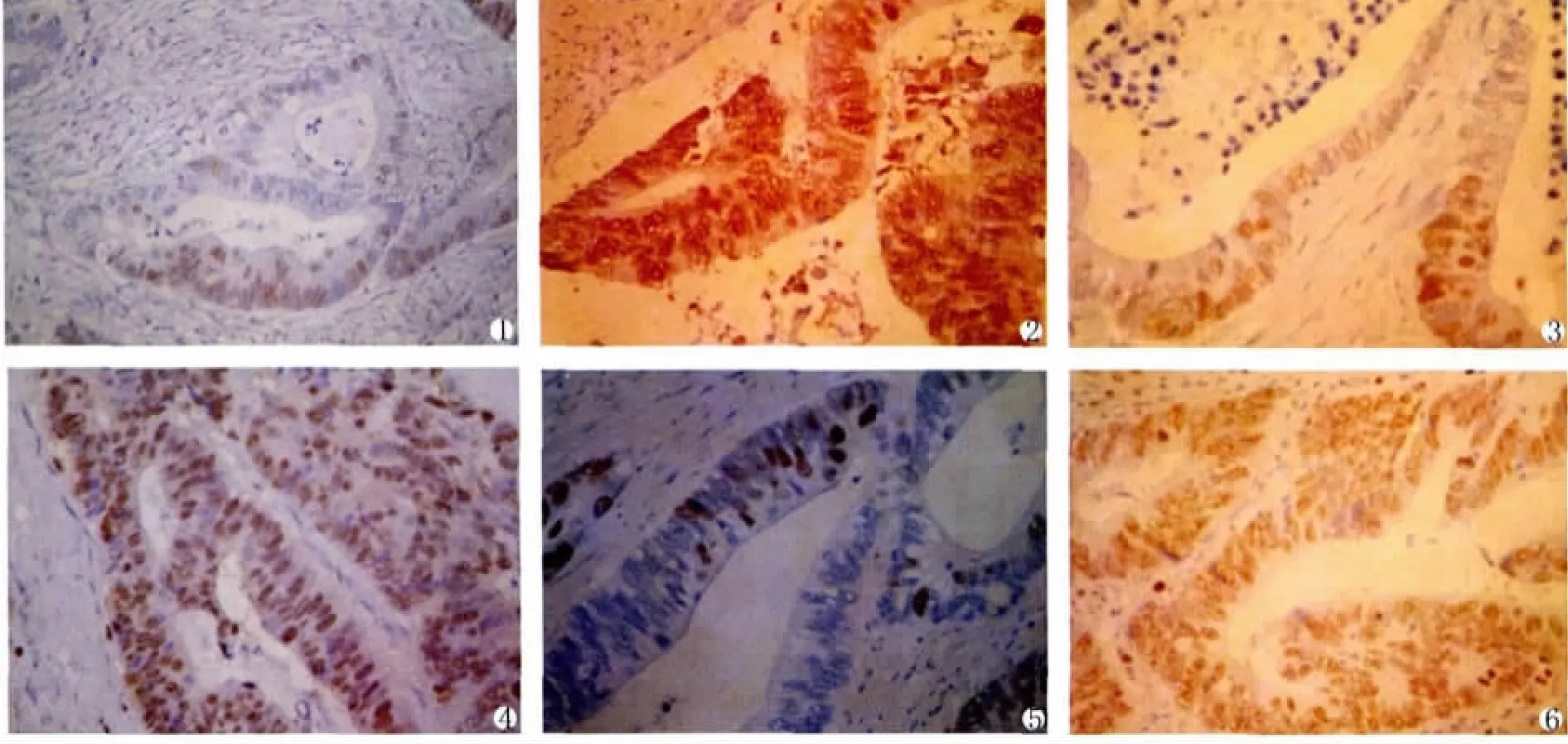
P53在大肠癌、正常肠粘膜的表达(见表1和图1-2)
P53蛋白阳性染色主要位于胞核,呈棕褐色或黄褐色细颗粒状。53例大肠癌组织中,P53阴性18例,阳性36例,阳性表达率为67.92%;28例正常大肠粘膜中,P53阴性、弱阳性和强阳性表达分别为28例、0例、0例,阳性表达率为0%;P53在大肠癌组织中的表达较在正常肠粘膜中表达明显增高。应用四格表χ2检验,组间蛋白表达差异有显著统计学意义(P<0.01)。
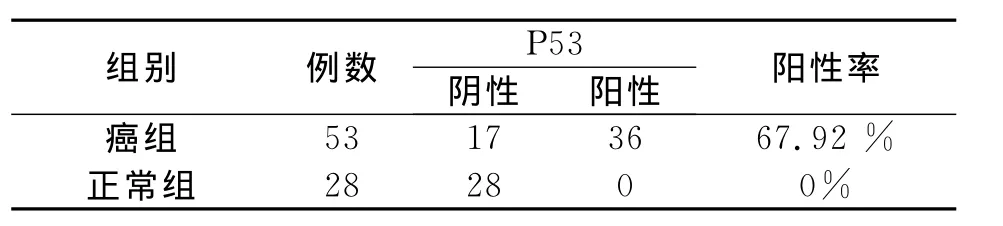
表1 P53在大肠癌、正常肠粘膜的表达Table 1 The expression of P53in the colorectal cancer and the normal colon mucosa
2.2PCNA与大肠癌关系
PCNA在大肠癌、正常肠粘膜的表达(见表2和图3-4)
PCNA蛋白阳性染色主要位于胞核,呈棕褐色或黄褐色细颗粒状。53例大肠癌组织中,PCNA阴性0例,阳性表达率为100%;28例正常大肠粘膜中,PCNA阴性26例,阳性2例,阳性表达率为7.14%;PCNA在大肠癌组织中的表达较在正常肠粘膜中表达明显增高。应用四格表χ2检验,组间蛋白表达差异有显著统计学意义(P<0.01)。
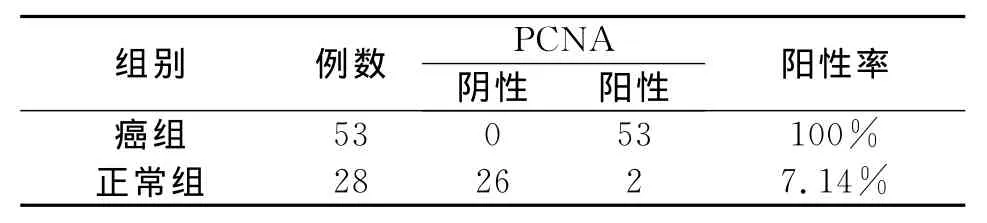
表2 PCNA在大肠癌、正常肠粘膜的表达Table 2 The expression of PCNA in the colorectal cancer and the normal colon mucosa
2.3Ki-67与大肠癌关系
Ki-67在大肠癌、正常肠粘膜的表达(见表3和图5-6)
Ki-67蛋白阳性染色主要位于胞核,呈棕褐色或黄褐色细颗粒状。53例大肠癌组织中,ki-67阴性、弱阳性和强阳性表达分别为7例、20例、26例,阳性表达率为86.79% ,28例正常大肠粘膜中,ki-67阴性、弱阳性和强阳性表达分别为25例、3例、0例,阳性表达率为10.71%;ki-67在大肠癌组织中的表达较在正常肠粘膜中表达明显增高。应用四格表χ2检验,组间蛋白表达差异有显著统计学意义(P<0.01)。

表3 ki-67在大肠癌、正常肠粘膜的表达Table 3 The expression of ki-67in the colorectal cancer and the normal colon mucosa
2.4大肠癌组织中P53、PCNA、ki-67表达的相互关系
⑴大肠癌组织中P53和PCNA表达的相关性分析
在大肠癌组织中,当PCNA表达≤50%时,p53蛋白表达≤50%和>50%分别为16例和2例,当PCNA表达>50%时,p53蛋白表达≤50%和>50%分别为24例和11例。采用Spearman秩相关分析,癌组织中P53和PCNA表达呈正相关,但无统计学意义(P>0.05,表4)。
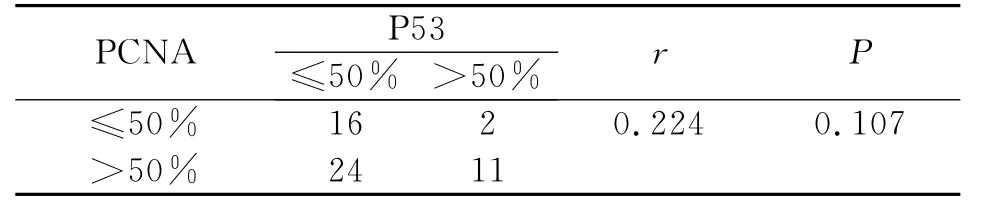
表4 大肠癌组织中P53与PCNA表达之间的关系Table 4 The corelation of P53and PCNA expressing in the colorectal carcinoma
⑵ 大肠癌组织中P53和ki-67表达的相关性分析
在大肠癌组织中,当ki-67表达≤50%时,p53蛋白表达≤50%和>50%分别为22例和5例,当ki-67表达>50%时,p53蛋白表达≤50%和>50%分别为18例和8例。采用Spearman秩相关分析,癌组织中P53和ki-67表达呈正相关,但无统计学意义(P>0.05)。

表5 大肠癌组织中P53与ki67表达之间的关系Table 5 The corelation of P53and ki-67 expressing in the colorectal carcinoma
⑶大肠癌组织中PCNA和ki-67表达的相关性分析
在大肠癌组织中,当ki-67表达≤50%时,PCNA蛋白表达≤50%和>50%分别为16例和11例,当ki-67表达>50%时,PCNA蛋白表达≤50%和>50%分别为2例和24例。采用Spearman秩相关分析,癌组织中ki-67和PCNA表达呈正相关,有显著统计学意义(P<0.01,表6)。
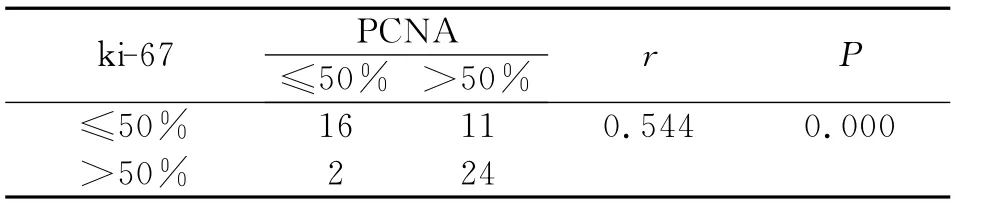
表6 大肠癌组织中ki67与PCNA表达之间的关系Table 6 The corelation of ki67and PCNA expressing in the colorectal carcinoma
讨 论
研究表明,P53基因在正常大肠组织未见表达,在大肠癌的阳性表达率为66.57%,与国内外文献报道的阳性率42%-70%结果一致[1]。组间比较有显著性差异(P<0.01)。提示P53蛋白主要在胞核发挥作用,与大肠癌的发生发展密切相关。
大量文献表明P53在大肠癌发生、发展中发挥重要作用[2-5],而且认为,在大肠癌的发生中可能存在两种发病机制:①经典的“染色体不稳定途径”即因为癌基因、抑癌基因突变引起染色体的不稳定,从而导致细胞恶变,其中,p53、K-ras、APC、DCC等基因的突变起重要的作用,而P53在大肠腺瘤癌变过程中被认为起关键作用[16、8];见于大部分的散发性大肠癌和家族性腺瘤性息肉病。②1993年Fishel等提出“错配修复途径”:即错配修复基因的突变导致错配修复功能缺陷,使细胞内的复制错误、DNA损伤积累,从而导致整个基因组的不稳定,引起肿瘤的易感,hMLH1和hMSH2基因的突变起重要作用;见于绝大多数的遗传性非息肉性大肠癌和部分散发性大肠癌。但目前有关散发性大肠癌中两种致癌途径之间的关系存在着争议,Park IJ[4]等研究认为,MMR系统功能缺陷可导致某些靶基因如TGFβRⅡ、BAX等发生突变,但与经典的染色体不稳定途径所涉及的靶基因(p53、K-ras、APC)突变无关,两种致癌途径并无关联;当MMR系统功能发生缺陷时,p53、APC等的突变率增加,从而导致染色体的不稳定性,两种致癌途径密切相关。
实验中P53表达与大肠癌的临床病理指标均无相关性。并未因抑癌基因P53的高表达,出现利于肿瘤进展的临床病理指标的相应改变。有研究表明P53基因突变参与大肠癌的进展,与大肠癌的多种生物学行为如大肠癌的分化程度、肿瘤浸润深度及淋巴结转移有明显相关性[8-10],检测大肠癌组织中是否存在P53基因突变有助于预测大肠癌的转移、判断大肠癌的恶性程度和患者的预后[11]。认为P53蛋白阳性表达对肿瘤生物学行为的判断、预后的估计有一定的指导意义,但并非一项独立的预后指标。P53基因突变与大肠癌的分化程度、浸润深度无明显关系。P53表达与大肠癌的年龄、性别、肿瘤部位、分化、Dukes分期、有无淋巴结转移等均无关。
免疫组化结果中,PCNA在正常大肠组织阳性表达率为7.14%,在大肠癌的阳性表达率为100%,组间比较有显著性差异(P<0.01),提示PCNA表达与大肠癌发生发展关系密切。
53例大肠癌患者的性别、年龄、肿物大小、肿瘤浸润深度、Dukes分期、有无淋巴结转移和病变部位等组间PCNA表达情况未见有明显规律,采用秩和检验统计分析,差异无统计学意义,显示PCNA表达与大肠癌的临床病理指标均无相关性。PCNA作为一种与DNA转录、合成、修复有关的核蛋白,是细胞增殖状态的理想标志物,其表达增强意味着细胞处于增殖期。本研究显示,大肠癌组织PCNA的表达与正常大肠黏膜虽然有非常显著性的差异,但其表达与肿瘤大小、Dukes分期、淋巴结转移、浸润深度无关。说明PCNA高表达仅代表瘤细胞的增殖异常增高,是肿瘤细胞动力学的一个相对独立指标,不能完全反映肿瘤的生物学行为。PCNA抗原表达的调控机制是复杂多变的,肿瘤细胞的增殖活性是决定肿瘤生物学行为的一个重要指标,其对于肿瘤的发生发展有密切关系,但其对肿瘤的进展转归影响尚存在其他关键因素参与,具体机制有待进一步探讨。或者受客观因素如所收集病例存在地域差异,致病条件不同,导致发病基础不同,进而体现为组织病理不同,由此理解研究结果的多样性。
Ki67正常大肠粘膜组织与大肠癌中的阳性表达率分别为10.71%和85.19%,组间统计有显著性差异,说明Ki67阳性率能可靠地反映正常和病变组织增殖活性,其直接反映的是肿瘤细胞的增殖活性。Ki67与患者年龄、肿物大小、肿瘤浸润深度、Dukes分期、有无淋巴结转移和病变部位等无相关性。而在不同性别组间表达差异有显著统计学意义(P<0.01)。提示不同性别患者其肿瘤细胞增殖机制可能不同。Ki-67抗原代表的增殖组分是肿瘤细胞动力学的一个相对独立指标,不能完全反映肿瘤的生物学行为。但是Ki-67抗原是典型的与细胞周期相关的核蛋白,是一种贯穿表达于增殖期细胞中的核抗原,在增殖细胞的G、S、G2和M期表达,在G0期缺失,与细胞的合成代谢有关,其表达水平能较全面客观地反映肿瘤细胞的增殖状态。
研究结果中发现P53与PCNA或ki-67表达之间均无明显相关性(P>0.05)。而PCNA和ki-67表达则成显著正相关(r=0.555,P<0.01)。
p53是大肠癌中最常变化的基因,在正常组织中对细胞的增殖和分化起负调控作用。有学者认为,P53和PCNA二者与肿瘤的恶性度和预后有关[12]。可能是癌基因被激活而抑癌基因失活同时发生时,加剧细胞生长的紊乱导致细胞过度增殖,肿瘤细胞的迅速增殖可使肿瘤内部压力增加,有利于其向周围组织扩散,从而影响肿瘤的恶性程度与预后评估。
在大肠癌的生长分化和侵袭转移中,Valera等[13]认为有多种(抑)癌基因和细胞因子参与,且不论何种原因导致细胞转化,其最终表现均为细胞周期失控、细胞分化受阻。其过程与p53、Ki-67关系密切。在本研究中ki-67在大肠癌不同性别患者间表达差异有统计学意义,而PCNA表达则无组间差异,提示ki-67在大肠癌不同性别患者间表达差异受ki-67不同于PCNA的细胞周期影响。
因此,突变型P53体现出在肿瘤组织中的高表达,PCNA和ki-67也不同比例的反映出肿瘤组织中细胞的高度增殖,但实验检验结果显示P53与PCNA和ki-67并不相关。提示P53作用的靶基因不是PCNA和ki-67,而通过其他环节作用于肿瘤组织,与PCNA和ki-67无直接关系,中间存在其他多基因、多步骤等因素影响,对大肠癌的影响机制相对独立;或许还存在双向作用的可能,即P53在大肠癌进展转归中所起作用,有可能受某一基因或某基因表达情况的影响,使大肠癌向不同方向演变。
图 版 说 明
图1 P53在大肠癌中的弱阳性表达(SP×400)
图2 P53在大肠癌中的强阳性表达(SP×400)
图3 PCNA在大肠癌中的弱阳性表达(SP×400)
图4 PCNA在大肠癌中的强阳性表达(SP×400)
图5 ki-67在大肠癌中的弱阳性表达(SP×400)
图6 ki-67在大肠癌中的强阳性表达(SP×400)
EXPLANATION OF FIGURES
Fig.1Weakly positive expression of p53in colorectal cancer(SP×400)
Fig.2Intensive expression of p53in colorectal cancer(SP×400)
Fig.3Weakly positive expression of PCNA in colorectal cancer(SP×400)
Fig.4Intensive expression of PCNA in colorectal cancer(SP×400)
Fig.5Weakly positive expression of ki-67in colorectal cancer(SP×400)
Fig.6Intensive expression of ki-67in colorectal cancer(SP×400)
[1]Croner RS,Guenther K,Foertsch T,et al.Tissue preparation for gene expression profiling of colorectal carcinoma:three alternatives to laser microdissection with preamplificantion.J Lab Clin Med,2004,143(6):344-351
[2]Ghavam-Nasiri MR,Rezaei F,Ghafarzadegank,et al.Expression of P53in colorectal carcinoma:correlation with clinicopathologic features.Arch Iran Med,2007,10(1):38-42
[3]Sulkowska M,Famulski W,Guzinska-Ustymowiczk,et al.Study of P53protein expression in colorectal cancer.Folia Histochem Cytobiol,2001,39(2):157-158
[4]Park IJ,Kim HC,et al.Correlation between hMLH1/hMSH2and p53protein expression in sporadic colorectal cancer.Hepatogastroenterology,2005,52(62):450-454
[5]Ongusaha PP,Kim HG,Boswell SA,et al.RhoE is a pro-survival p53target gene that inhibits ROCK 1-mediated apoptosis in response to genotoxic stress.Curr Biol,2006,16(24):2466-2472
[6]Eric R,Fearon,Bert Vogelstein.A genetic model for colorectal tumorigensis.Cell,1990,61:759-767
[7]Sheikh RA,Min BH,Yasmeen S,et al.Correlation of Ki-67,p53,and Adnab-9immunohistochemical staining and ploidy with clinical and histopathologic features of severely dysplastic colorectal adenomas.Dig Dis Sci,2003,48:223-229
[8]Nagaoka S,Shiraishi J,Utsuyama M,et al.Poor prognosis of colorectal cancer in patients over 80years old id associated with down-regulation of tumor suppressor genes.J Clin Gastroenterol,2003,37(1):48-54
[9]Makino M,Yamane N,Taniguchi T,et al.P53as an indicator of lymph node metastasesin invasive early colorectal cancer.Anti Cancer Res,2000,20(3B):2055
[10]Gallego MG.Prognostic influence of P53nuclear overexpression in colorectal carcinoma.Dis Colon Rectum,2000,43(7):971
[11]Tang R,Ko MC,Wang YJ,et al Humoral response to P53in human colorectal tumors.Int J Cancer,2001,94(6):859-863
[12]Yamaguchi A,Kurosaka Y,Fushida S,et al.Expression of p53protein in colorectal cancerand its relationship to short-term prognosis.Cancer,1992,70(12):2778-2784
[13]Valera VA,Walter BA,Yokoyama N,et al Prognostic groups in colorectal carcinoma patients based on tumor cell proliferation and classification and regression tree(CART)survival analysis.Ann Surg Oncol,2007,14(1):34-40

