龙葵素中毒及检测的研究进展
董晓茹,沈 敏,刘 伟
(1.司法部司法鉴定科学技术研究所 上海市法医学重点实验室,上海200063;2.苏州大学 材料与化学化工学部,江苏 苏州 215123)
龙葵素中毒及检测的研究进展
董晓茹1,2,沈 敏1,刘 伟1
(1.司法部司法鉴定科学技术研究所 上海市法医学重点实验室,上海200063;2.苏州大学 材料与化学化工学部,江苏 苏州 215123)
龙葵素(Solanen)是存在于茄科植物马铃薯中的有毒甾体类糖苷生物碱。成熟的马铃薯中,龙葵素的含量一般为7~10mg/100 g,食用是安全的。当马铃薯由于贮存不当而变绿或发芽时,会产生大量的龙葵素,当龙葵素的含量超过20mg/100 g时,人服用后可能会导致中毒甚至死亡,相关中毒案件时有报道。结合近年来关于马铃薯中有毒成分龙葵素的研究作一综述,总结了龙葵素毒理学、药理学、药代动力学及检测方法,为法医毒理学工作者提供参考。
龙葵素;马铃薯糖苷生物碱;中毒;检测
茄科植物马铃薯(Solanum tuberosumL.),是主要的粮食作物之一。马铃薯植株及其块茎中含有一类有毒糖苷生物碱龙葵素(Solanen),主要是以茄啶(Solanidine)为糖苷配基构成的茄碱和卡茄碱共计6种不同的糖苷生物碱,结构式见图1。α-茄碱(αsolanine)和 α-卡茄碱(α-chaconine)是马铃薯糖苷生物碱的主要形式,含量占马铃薯总糖苷生物碱的95%。β-茄碱和γ-茄碱是α-茄碱三糖的部分水解产物,β-卡茄碱和γ-卡茄碱是α-卡茄碱三糖的部分水解产物[1]。若马铃薯中含有较多的龙葵素,人在食用时会感觉到明显的苦味,随后喉咙会有持续的灼烧感。龙葵素在去皮煮熟的马铃薯中的量达200~400mg时,受试者表述可以通过“苦味”来判断[2]。
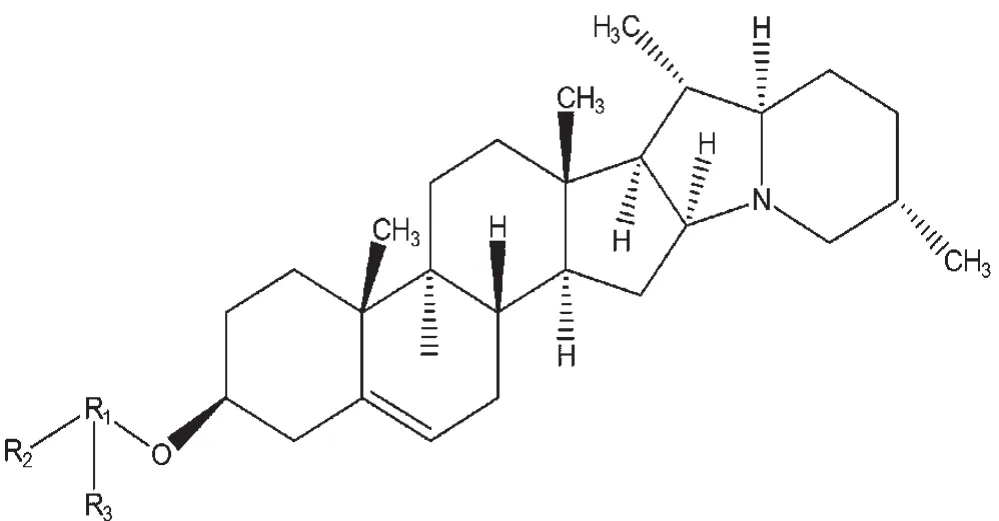
图1 龙葵素的化学结构式
糖苷生物碱在制药工业中是重要的医药原料,与其他甾体类药物一样,具有治疗风湿病、平喘等多方面的医疗作用,也有文献报道龙葵素具抗癌活性,曾被民间用于治疗癌症[3-5]。近年来,马铃薯切片在护理领域被用于治疗静脉炎及切口愈合[6-9]。非洲曾利用马铃薯中的茄碱及卡茄碱能降低胆碱酯酶活性的特性治疗人类免疫缺陷病毒感染(human immunodeficiency virus infections, HIV)[10]。
有关龙葵素中毒的案(事)件时有发生,较多地发生在农村、学校、建筑工地等地方,一般为集体中毒事件,多为食用了发芽、变绿的马铃薯后引发的中毒[11-17]。中毒症状多见以下三类,一为消化系统症状:表现为食后咽喉部及口腔有灼烧感、恶心呕吐、腹痛、腹泻或口干舌燥等,剧烈吐泻可致脱水、电解质失衡、血压下降等。二为神经系统症状:表现为耳鸣、畏光、头痛、眩晕、发热、瞳孔散大、呼吸困难、颜面青紫、口唇及四肢末端呈黑色。严重者可昏迷抽搐,最后可因呼吸中枢麻痹死亡。三为胃肠道系统症状:会引起长源性青紫病[3]。
1 龙葵素在马铃薯中分布及含量
从可能的生物合成途径来看,龙葵素是植物呼吸作用过程中的次生代谢产物,故凡是促进呼吸作用的因素,均能促进糖苷生物碱的合成,而糖苷生物碱也更易于蓄积在呼吸作用旺盛的部位[1]。马铃薯植株的所有部位,叶、花、表皮以及高代谢活性部位(芽眼、绿皮、芽、茎)都存在高浓度的龙葵素,块茎中龙葵素的含量较少。不同品种及收获后不同的储存环境下(如:光照、机械损伤、湿度等)的马铃薯糖苷生物碱的含量差异较大[10]。
1.1 不同品种的马铃薯中龙葵素的含量
不同品种的马铃薯中龙葵素的含量也有差别。美国威斯康辛州的32个品种块茎中糖苷生物碱含量范围为 2~13mg/100g FW(Fresh Weight,鲜重,即新鲜马铃薯采集后立刻测出的重量),乌克兰的17个品种为6~18mg/100g FW,白俄罗斯的品种为 5~10mg/100g FW,哈萨克的品种植株中为16~40mg/100g FW[1]。有文献报道市售的马铃薯中总糖苷生物碱含量一般不超过10mg/100g[10],美国食品和药物管理局(US Food and Drug Administration,FDA)规定马铃薯中的总糖苷生物碱含量应小于20mg/100g。因此许多栽培品种由于龙葵素含量过高而被淘汰。
1.2 马铃薯不同组织中龙葵素的分布
马铃薯皮中龙葵素的含量往往高于块茎。α-卡茄碱和α-茄碱在块茎中含量的典型比例为60∶40[10]。一项关于墨西哥马铃薯糖苷生物碱含量的调查显示,马铃薯皮中总糖苷生物碱的含量高于其块茎,且α-卡茄碱占总糖苷生物碱的65%~71%。马铃薯叶中的糖苷生物碱也高于块茎,尤其是α-卡茄碱[18]。关于英国马铃薯的调查显示,马铃薯叶中含有0.06~55.7mg/100g的α-卡茄碱和0.64~22.6mg/100g的α-茄碱。未加工过的马铃薯块茎中α-卡茄碱及α-茄碱的含量分别为0.3~0.63mg/100g 和 0.05~0.65mg/100g[10]。 美国缅因州一项关于20种马铃薯食品的调查表明,在水煮马铃薯罐装食品中α-卡茄碱和α-茄碱的含量最低,分别为 0.04~0.08mg/100g 与 0.04~0.06mg/100g;在油炸马铃薯皮中α-卡茄碱和α-茄碱含量最高,含量分别为 93.1~97.9mg/100g 和 46.1~48.0mg/100g[19]。
一般而言,常见的家庭烹饪过程(如:烘烤、煮沸、油炸、微波等)对马铃薯中糖苷生物碱的含量影响不大[20]。煮沸使马铃薯的糖苷生物碱的含量仅减少约3.5%,微波加热使糖苷生物碱含量减少15%。将马铃薯在210℃条件下加热10min,可使α-卡茄碱及α-茄碱含量降低40%[10]。
2 环境对龙葵素形成的影响
马铃薯收获后的储藏条件(如:光照、湿度、时间等)对龙葵素的含量有较大影响。一般在高温、干旱和氮元素过多,磷元素、钾元素不足的栽培条件下,易促进龙葵素的形成和蓄积;在清爽、湿润、昼夜温差较大的环境中,龙葵素的含量最低。提前收获未充分成熟的块茎,其含量往往偏高;受损、染病和腐烂的块茎中龙葵素的蓄积也增加。块茎随着储藏期的延长,特别是储藏期间见光薯皮变绿和春季块茎结束休眠开始发芽时,萌发芽和绿化薯皮中龙葵素明显蓄积。萌发芽和薯皮中的龙葵素是本身合成的,不向芽眼周围的块茎和组织转移[1]。
马铃薯储藏过程中会产生叶绿素而发生绿化现象。有研究表明,光下叶绿素的合成与糖苷生物碱的蓄积有明显的同步增长趋势。同一品种绿化薯皮中龙葵素的含量为38mg/100g FW,未绿化薯皮中的含量则为22mg/100g FW。有国外学者通过实验探讨不同温度条件下光对绿化的影响,叶绿素和龙葵素之间量的关系,以及马铃薯在部分受光情况下,光对叶绿素及龙葵素含量的影响。研究结果表明,在一定的光照条件下,叶绿素的生成和温度有一定的关系,温度越高绿化的速度越快,叶绿素也越多,且在黑暗的条件下没有绿化现象即没有叶绿素生成。而龙葵素在一定的光照条件下,不同温度对龙葵素消长的影响与叶绿素的变化是一致的,且在1℃和5℃条件下几乎没有变化,但在10℃和15℃条件下与叶绿素同步增加,特别是在15℃条件下茄碱的增加非常明显,所以在光照条件下龙葵素的增加在10℃以上是随温度而变化的[21]。
吴耕红等[22]采用乙醇-乙酸法提取不同储藏条件下马铃薯渣中的龙葵素,通过HPLC-UV法测定其含量,考察了光照、储藏温度及储藏时间对马铃薯渣中龙葵素含量的影响。结果表明马铃薯渣中的龙葵素含量与储藏时间及储藏温度呈正相关关系,且光照条件对龙葵素含量的影响显著,变化趋势如图2所示。在无光照的条件下,马铃薯渣中龙葵素的含量随着储藏温度的升高逐渐增加。当储藏温度低于10℃时,其增加的趋势较缓慢,但高于10℃时,龙葵素的含量会随着温度的升高而迅速增加;在无光照的条件下,马铃薯渣中的龙葵素含量随着储藏时间的延长呈线性增加;在相同的储藏温度及储藏时间的条件下,光照可以促进马铃薯渣中龙葵素的快速合成,含量约为无光照时的2倍。
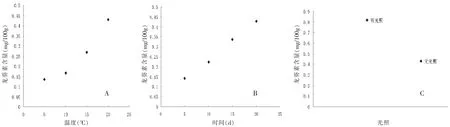
图2 储藏条件对马铃薯中龙葵素含量的影响
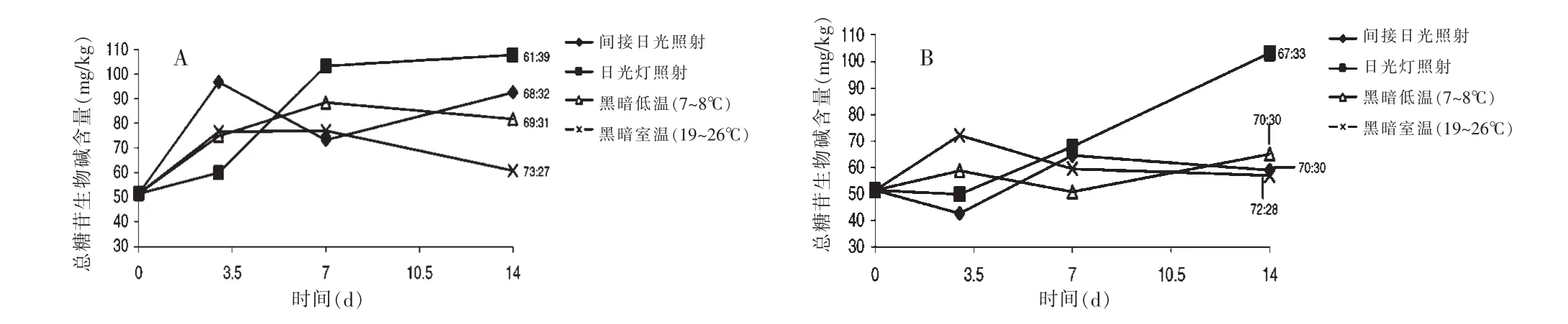
图3 马铃薯在4种储藏条件下的龙葵素含量
Machado等[20]将马铃薯按重量分为小号、中号两组,通过HPLC-UV检测在4种储藏条件a.间接日光照射;b.日光灯照射;c.黑暗低温(7~8℃);d.黑暗室温(19~26℃)下马铃薯中糖苷生物碱的含量,探讨了光照和温度对马铃薯中龙葵素形成的影响。实验结果表明,相同的储藏条件下,较小体积的马铃薯中龙葵素的含量较高(相对于初始含量),此结果与 Papathanasiou等[23]实验结果一致。4种储藏条件下,只有储藏于日光灯照射下的马铃薯中龙葵素含量是持续增长的,而另3种条件下储藏的马铃薯,龙葵素的变化呈波动状态,在日光灯照射下马铃薯储藏14d后龙葵素的含量是初始含量的2倍(含量变化见图3)。储藏在日光照射或日光灯照射条件下的小号马铃薯中龙葵素的含量约为黑暗室温条件下的4~6倍。在黑暗低温条件下储藏的马铃薯中龙葵素的含量较黑暗室温的高。Griffiths等[24]也发现马铃薯储藏在低温(4~10℃)条件下有利于龙葵素的蓄积,但这种作用与马铃薯的种类有关。Machado等[20]通过实验还发现日光灯照射下马铃薯中α-茄碱增长的幅度较α-卡茄碱增长的幅度大,两者从最初的含量比72∶28变化为67∶33。Friedman等[25-26]通过龙葵素对青蛙胚胎致畸实验表明α-卡茄碱是龙葵素中主要的致毒成分,毒效是α-茄碱的3~10倍,从而推测在中毒案件中α-卡茄碱可能是主要的致毒物质。进一步说明α-茄碱和α-卡茄碱的相对比例影响龙葵素的毒性,间接地影响马铃薯总糖苷生物碱的食品安全限的规定值。
3 龙葵素毒性评价及药代动力学研究
Patil等[27]通过实验研究了龙葵素的毒性。小鼠实验结果表明,对小鼠腹腔注射剂量为50mg/kg α-茄碱时,小鼠在1~3h死亡。腹腔注射后,小鼠约1min出现兴奋,继而出现安静、昏昏欲睡、冷漠等症状,呼吸轻微并开始腹泻,随后后腿无力、呼吸困难,死亡前出现持久的无意识症状。但注射剂量为10mg/kg时仅出现一些中毒症状而没有出现死亡现象。通过计算小鼠腹腔注射α-茄碱的LD50为32.3mg/kg。Nishie等[28]对小鼠腹腔注射α-茄碱的LD50为42±1.8mg/kg,两者研究结果相似。在Patil等的研究中,对兔子腹腔注射20mg/kg α-茄碱,24h内基本死亡,且表现出特异性和非特异性的弱到中度的抑制抗胆碱的症状;在给小鼠注射40mg/kg α-茄碱前,先注射2mg阿托品,发现小鼠死亡率明显降低,提示阿托品可以抵消α-茄碱的毒性,但安非他命和巴吉林并未发现有同样的药效。
Slanina等[2]总结了马铃薯中龙葵素相关毒理学性质。通过已有的动物实验可知,不同动物种属的毒理学性质差别较大。小鼠和大鼠胃肠道对马铃薯龙葵素的吸收很差,且排泄迅速(主要以原体从粪便中排出)。此结果可以解释小鼠茄碱毒性实验中,口服中毒量(LD50≥1000mg/kg)远大于腹腔注射的中毒量(LD50≥30mg/kg)的原因。而仓鼠对龙葵素可经胃肠道快速吸收,且α-卡茄碱会被大量吸收并滞留在组织中,另有数据表明α-茄碱的吸收和滞留随着给药量的增加而增加。此外,α-卡茄碱和α-茄碱在动物实验中表现出抑制胆碱酯酶活性的特性,且高剂量的龙葵素有细胞溶血作用[29]。李盛钰等[30]报道龙葵素的两种主要成分α-茄碱和α-卡茄碱在对细胞溶解作用中可说明两者的协同作用很可能与其毒性有关,且协同作用与两者浓度比有关,当两者的比例接近1∶1时协同作用最强,故适合于单种马铃薯糖苷生物碱的LC50值,对于各种成分混合在一起的马铃薯糖苷生物碱来说可能会失去作用。龙葵素中毒的症状无特异性,与肠胃炎症状相似,因此临床上会被误诊而耽误治疗[31]。临床观察发现,龙葵素中毒的潜伏期为2~20h,一般症状为胃肠道失调如:呕吐、腹泻以及剧烈的腹痛等;严重者有神经系统症状包括冷漠、意识不清、视力模糊等。Slanina等[2]报道了龙葵素对人的中毒量为2~5mg/kg,致死量为3~6mg/kg,且中毒可能与个体的身体健康状况有关,对龙葵素吸收的敏感程度可能存在较大的个体差异。
Nishie等[28]动物实验结果表明:不同动物种属对α-茄碱的敏感性不同,小鼠腹腔注射LD50为42±1.8mg/kg,而口服则毒性明显很弱,小鼠口服剂量为1000g/kg时仍没有明显中毒症状;茄碱糖苷配基茄啶对小鼠腹腔注射剂量为500mg/kg时没有明显毒性;兔腹腔注射α-茄碱20mg/kg时,过夜出现死亡,注射剂量为30mg/kg时6.25h出现死亡。Nishie等还总结了α-茄碱毒性研究的相关数据:大鼠口服LD50为590mg/kg,腹腔注射 LD50为 75mg/kg;人口服 200mg(相当于2.8mg/kg)会出现过敏、困倦、呼吸困难、颈部发痒等症状,服用更高剂量会出现呕吐、腹泻等症状;羊口服剂量为225mg/kg时未见致死现象,但出现血质不调等症状。Nishie等还通过给大鼠灌服氚标记茄碱的体内分布研究发现(1)胃肠道对茄碱的吸收较差。(2)进入体内会快速通过尿液和粪便排泄;(3)单次口服给药5mg/kg在各组织中12h茄碱含量达到峰值,含量由高到低的组织依次为:脾、肾、肝、肺、脂肪、心脏、脑和血液,各组织中氚标记茄碱药-时变化图(见图4)。对大鼠腹腔注射5~15mg/kg茄碱时粪便和尿液中的药物含量相近,但当腹腔注射剂量达25mg/kg时,粪便和尿液中药物的含量有显著的降低,同时肝、脾、肾、肠中药物的含量增加,给药剂量在5~25mg/kg范围内时,肺、心、脑等组织及血液中的含量没有成比例变化。Nishie等因此认为大鼠口服茄碱毒性较弱的原因:(1)胃肠道对茄碱的吸收较差(2)茄碱通过尿液和粪便快速排泄(3)茄碱在胃肠道中被水解成毒性较弱的茄啶。
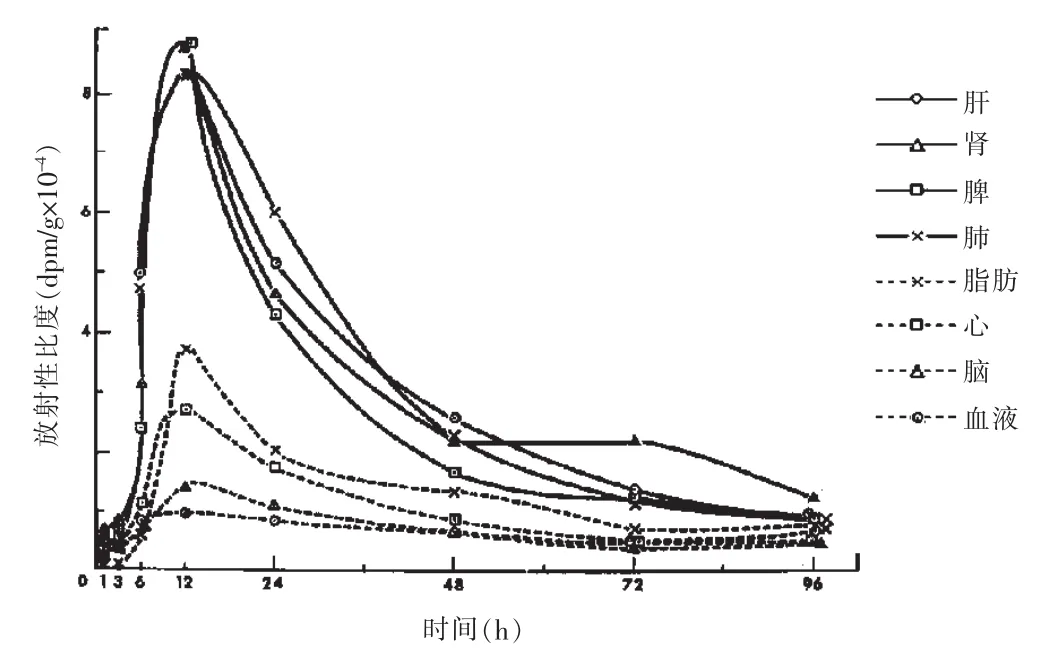
图4 单次口服给药5mg/kg,大鼠各组织中氚标记茄碱含量
相对于其他哺乳动物而言,人对龙葵素的毒性更为敏感[32],动物实验的毒理学数据不能为人体中毒提供充分的指导信息。Hellenäs等[33]最先通过人体志愿者实验研究了龙葵素的药代动力学的相关内容。给人体志愿者服用含龙葵素的土豆泥,单次给药剂量为1mg/kg(α-茄碱和 α-卡茄碱的给药比例为 4∶6),检测给药后25h的血药浓度,研究发现血清中α-茄碱及α-卡茄碱的药峰质量浓度分别为7.7ng/mL和14.4ng/mL,消除半衰期分别为11h和 19h。Mensinga等[31]在Hellenäs的基础上将受试者分为几组考察了6个剂量的龙葵素对人的毒性作用,且考察了给药后96h的血药浓度,研究发现α-茄碱及α-卡茄碱的半衰期分别为21h和44h,说明龙葵素在体内清除需要的时间多于24h,所以一天中多次服用的马铃薯其龙葵素会在体内累积而产生毒性。实验中仅有服用高剂量1.25mg/kg的受试者有毒性反应,在给药4h后出现恶心、呕吐等症状。这一结果与Hellenäs的实验中一名受试者服用1mg/kg的龙葵素后出现腹泻症状结果相似。两者的研究发现药物到达药峰浓度的时间均在4~8h。Mensinga等的研究还表明,每个人对龙葵素毒性的敏感程度不同,实验中出现胃肠道症状的剂量与一些文献报道的2mg/kg的中毒剂量相比相对较低,一些人可能在服用一定剂量的龙葵素后比其他人更易发生毒副作用。
4 龙葵素提取及检测
4.1 马铃薯中龙葵素的提取
马铃薯糖苷生物碱有多种活性,具有潜在的药用价值,目前已有关于糖苷生物碱能抗肿瘤、抗疟疾、抗病原微生物、降低血浆低密度脂蛋白和降低胆固醇等报道[3,29-30],龙葵素能抑制消化道肿瘤细胞的增殖,对胃癌、直肠癌的抑制效果更佳,因而具有开发价值。近年来国内外对于马铃薯中龙葵素的提取研究较为广泛,并取得了一定的成果。
马铃薯中龙葵素的提取方法主要有单溶剂提取法、双溶剂提取法、混合溶剂提取法及微波辅助提取法。段光明等[34]、张薇等[35]通过实验比较了单溶剂、双溶剂、混合溶剂提取法,发现单溶剂提取法提取率较低、龙葵素提取不完全,混合溶剂法则需用的溶剂价格昂贵、成本过高,而双溶剂提取法可以获得较好的提取效率,可做为提取龙葵素的较佳方法。为改进龙葵素的提取方法、提高提取效率,张薇等[36]又在双溶剂提取法的基础上建立了微波辅助提取法,提取效率有较大提高。
4.2 龙葵素的检测
马铃薯作为主要的粮食作物之一,是很多加工食品的制作原料,如:土豆泥、薯条等。若马铃薯因储藏不当等原因致食品中含大量龙葵素时,食品安全受到极大威胁,人一旦服用则会发生中毒甚至死亡的案件。因此在食品安全领域和法医毒物学领域,龙葵素的检测已受到研究人员的关注。目前针对龙葵素的检测主要包括两大领域:(1)在食品安全检测领域,通过一定的提取方法,检测马铃薯或马铃薯食品中的龙葵素含量是否符合安全标准,含量是否在人服用的安全限量下;(2)在法医毒物学领域,人服用含有龙葵素的马铃薯及相关食品后,龙葵素在人或动物体内的吸收、分布、代谢情况,给马铃薯中龙葵素中毒的鉴定提供一定的指导意义。
4.2.1马铃薯及其制品中龙葵素的检测方法
马铃薯及其食品中龙葵素的检测方法主要有紫外分光光度法(UV)[22,37]、薄层色谱法(TLC)[38]、高效液相色谱法(HPLC)[18,20,39-40]、液相色谱-质谱联用法(LC-MS)[41]及基质辅助激光解析电离质谱分子成像技术(MALDI-MSI)等。通过分析马铃薯及其制品中龙葵素的含量或马铃薯各组织中龙葵素的分布,为食品安全监控提供参考依据。

表1 马铃薯及其制品中龙葵素的前处理及检测方法
紫外分光光度法及薄层色谱法不能对马铃薯中的龙葵素进行准确的定性、定量分析且灵敏度较低。液相色谱法在马铃薯及其制品中龙葵素的检测中应用较为广泛,通过对马铃薯或马铃薯制品进行一定的前处理,再进行检测。前处理方法一般是将马铃薯或其制品通过溶剂提取后再进行固相萃取净化。分析方法见表1。
因马铃薯及其制品(如:炸薯条,土豆泥等)成分较为复杂,故前处理条件较为复杂,尤其对于马铃薯的油炸食品在固相萃取前需先用有机溶剂除去脂类[41]。 Va¨a¨na¨nen 等[40]通过实验比较了不同填料的固相萃取小柱对马铃薯中龙葵素的提取效果的影响,结果表明用Oasis HLB小柱进行萃取可获得较高的回收率,而SCX小柱的选择性最强,对于去除马铃薯提取物中的杂质最为有效。
LC-MS方法与HPLC法相比具有更高的灵敏度,Distl等[41]将在线固相萃取-液相色谱-质谱联用法用于检测马铃薯及马铃薯制品中的龙葵素含量,方法检测限可低至0.3ng/mL,检测时间仅为5min。
Ha等[42]用MALDI-MSI分析比较了马铃薯各组织中龙葵素的含量及不同品种马铃薯中龙葵素的含量。与传统的HPLC法比较,MALDI-MSI不需要对马铃薯进行前处理即可对龙葵素的含量进行分析,避免了复杂的前处理过程,且与传统方法不同的是传统方法所检测的龙葵素含量为部分组织的平均含量,而MALDI-MSI则可提供足够的龙葵素分布空间信息。如Ha等实验发现马铃薯中龙葵素是集中在土豆表皮以下1.5~3mm的组织中。
4.2.2生物检材中龙葵素的检测
生物检材中龙葵素的检测可为中毒判断提供依据,目前对体内龙葵素的检测方法主要有放射免疫分析法(RIA)[43],高效液相色谱法(HPLC)[31,33]和液相色谱-质谱联用法(LC-MS)[32]。其中,应用最为广泛的是HPLC法,Hellenäs等[33]最早将HPLC-UV法应用于人血清中龙葵素的检测,通过用C2小柱固相萃取法从血清中提取出药物,用氰丙基柱对固相萃取提取物进行分离,手动收集馏分后再用硅胶色谱柱进行分析定量,该方法LOD可达到0.3ng/mL。Mensinga等[31]研究龙葵素剂量对人毒性实验中也通过用固相萃取法提取血清中的龙葵素,再经过两步过柱的方法来检测人血清中的α-茄碱及α-卡茄碱,该方法与Hellenäs的方法相似,且进行了方法验证,其线性范围为0.5~50ng/mL,α-茄碱及α-卡茄碱的LLOQ分别为0.50ng/mL及0.25ng/mL。
Langkilde等[32]研究龙葵素对仓鼠的毒性实验中,用LC-MS法检测仓鼠血浆、尿液及组织中的α-茄碱及α-卡茄碱,通过用氯仿、甲醇和水的混合溶剂提取方法对仓鼠体液及组织中的药物进行提取,再进行LC-MS分析,方法的线性范围是3.2~833.3ng/mL,α-茄碱及α-卡茄碱LOD均为0.3ng/mL。
5 进一步研究方向
虽对生物检材中检测龙葵素的方法已有一些报道,但这些方法中的前处理方法较为复杂且耗时,一般需要经过固相萃取后,用液相柱进行分离富集再进行检测,检材均为血清、血浆等,且方法大多未进行全面的方法学验证。在法医毒物分析领域,龙葵素中毒后需要及时取材并进行快速准确的分析,对于不同检材:如血液、尿液及组织中龙葵素的分析均较为重要,这就需要建立一个简单、快速、准确的方法为龙葵素中毒的法医学鉴定提供依据。液相色谱-质谱联用法[LC-(MS)n]将 HPLC 的高分离能力和 MS的高分辨能力相结合,已经在药物及毒物分析方面得到了广泛的应用,对体内痕量药物的检测有一定的优势,为满足法医毒物分析和临床毒物分析的需要,建立有效的生物体液及组织中龙葵素检测的LC-MS/MS方法,对龙葵素中毒案件中痕量药物的分析尤为重要。
龙葵素毒理学的相关内容已有报道,主要是以人作为研究对象研究低剂量条件下龙葵素在人体的吸收、分布、代谢、排泄的药代动力学过程,而在法医毒物分析领域,毒物动力学研究具有一定的指导意义,在药物的毒性剂量下药物在体内的吸收、消除过程会有所改变。因此,建立适当的动物模型,研究龙葵素在动物体内的毒物动力学过程,能为法医学鉴定中龙葵素中毒案件的取材及检测结果的评价提供更多的参考信息。
此外,在已报道的研究中,对于龙葵素代谢物的研究还较少,文献报道的主要代谢物为茄啶,代谢物信息可增强对实验结果的进一步确证,通过高分辨质谱的应用来探索可能存在的代谢物,可为法医毒物学分析结果的评价提供更多的的指导信息。
[1]段光明,冯彩萍.马铃薯糖苷生物碱[J].植物生理学报,1992,28(6):457-461.
[2]Slanina P.Solanine (glcoalkaloids) in potatos: toxicological evaluation[J].Food Chem Toxic,1990,28 (11):759-761.
[3]巩江,倪士峰,丘莉惠,等.龙葵素的药理·毒理及药用研究[J].安徽农业科学,2009,37(9):4108-4109.
[4]四川医学院.中草药学[M].北京:人民卫生出版社,1976:335.
[5]周金黄,王筠默.中药药理学[M].上海:上海科学技术出版社,1986:291.
[6]邢红英.山莨菪碱与马铃薯片在老年病人静脉穿刺中应用的研究[J].中国临床研究,2011,3(11):86-88.
[7]张彩云.冰敷配合马铃薯片外敷治疗留置针致静脉炎疗效观察[J].中国误诊学杂志,2012,12(7):1575.
[8]张振霞,刘合营.马铃薯联合肝素封管液外敷预防化疗性静脉炎 38 例效果观察[J].齐鲁护理杂志,2012,18(2):124-125.
[9]邱红,吴建华,王红果,等.马铃薯片外敷促进会阴切口愈合的效果观察[J].护理学杂志,2012,27(4):39-40.
[10]Barceloux D G.Potatos, tomatos, and solanine toxicity(Solanum tuberosumL.,Solanum lycopersicumL.)[J].Dis Mon, 2009,55(6):391-402.
[11]淮瑾,吴永胜,王芳健.40例发芽马铃薯中毒抢救[J].西北国防医学杂志, 2001,22(3):280.
[12]高伟艳.发芽马铃薯引起食物中毒的22例调查报告[J].中国煤炭工业医学杂志, 2006,9(8):884.
[13]彭德本,李永祥.龙葵素急性中毒2例[J].中国乡村医药,1999, 6(10):18-19.
[14]任志远.一起马铃薯龙葵素引起的食物中毒[J].疾病监测,2008, 23(5):267.
[15]周兴,林党柒,杨汝松,等.一起小学生龙葵素中毒流行病学调查[J].中国学校卫生, 2007, 28(9):849-850.
[16]仇日火.一起食用发芽马铃薯所致人畜集体中毒[J].解放军预防医学杂志,1999,5(17):375.
[17]Phillips B J,Hughes J A,Phillips J C,et al.A study of the toxic hazard that might be associated with the consumption of green potato tops[J].Food Chem Toxic,1996, 34: 439-448.
[18]Sotelo A,Serrano B.High-performance liquid chromatographic determination of the glycoalkaloids α-solanine and α-chaconine in 12 commercial varieties of Mexican potato[J].J Agric Food Chem, 2000, 48(6):2472-2475.
[19]Bushway RJ, Ponnampalam R.α-Chaconine and α-solanine content of potato products and their stability during several modes of cooking[J].J Agric Food Chem, 1981,29:814-817.[20]Machado R M D,Toledo M C F,Garcia L C.Effect of light and temperature on the formation of glycoalkaloids in potato tubers[J].Food Control, 2007, 18: 503-508.
[21]李春禄.光照与温度对马铃薯绿化及龙葵素含量的影响[J].马铃薯杂志,1994,2(8):124-125.
[22]吴耘红,江成英,王拓一.储藏条件对马铃薯渣中龙葵素含量影响的研究[J].农产品加工学刊,2008,7:144-6.
[23]Papathanasiou F,Mitchell S H,Harvey BMR.Variation in glycoalkaloid concentration of potato tubers harvested from mature plants[J].J Sci Food Agric,1999,79(1):32-36.
[24]Griffiths D W,Bain H,Dale M F B.Effect of storage temperature on potato (Solanum tuberosum L.) tuber glycoalkaloids content and the subsequent accumulation of glycoalkaloids and chlorophyll in response to light exposure[J].J Agric Food Chem,1998,46(12):5262-5268.
[25]Friedman M,Rayburn JR,Bantle JA.Developmental toxicology of potato alkaloids in the frog embryo teratogenesis assay—Xenopus (FETAX)[J].Food Chem Toxicol, 1991,29(8):537-547.
[26]Friedman M,Roitman JN,Kozukue N.Glycoalkaloids and calystegine contents of eight potato cultivars[J].J Agric Food Chem, 2003,51(10):2964-2973.
[27]Patil BC, Sharma RP, Salunkhe DK,et al.Evaluation of solanine toxicity[J].Food Cosmet Toxicol, 1972, 10(3):395-398.
[28]Nishie K,Gumbmann MR,Keyl AC.Pharmacology of solanine[J].Toxicol Appl Pharmacol, 1971,19:81-92.
[29]季宇彬,吴盼,郎朗.龙葵碱的毒理学研究进展[J].中草药,2009(40):29-31.
[30]李盛钰,赵雪松,何大俊,等.茄科植物糖苷生物碱的药物活性研究进展[J].中草药, 2007,38(1):147-150.
[31]Mensinga T T, Sips A J, Rompelberg C J, et al.Potato glycoalkaloids and adverse effects in humans:an ascending dose study[J].Regul Toxicol Pharmacol, 2005, 41(1):66-72.
[32]Langkilde S, Schrøder M,Stewart D, et al.Acute toxicity of high dose of the glycoalkaloids,alpha-solanine and alphachaconine,in the Syrian golden hamster[J].J Agric Food Chem, 2008, 56(18): 8753-8760.
[33]Hellenäs KE,Nyman A,Slanina P,et al.Determination of potato glycoalkaloids and their aglycone in blood serum by high-performance liquid chromatography.Application to pharmacokinetic studies in humans[J].J Chromatoqr,1992,573(1):69-78.
[34]段光明,宗会.不同溶剂系统对马铃薯糖苷生物碱的提取效果[J].植物生理学通讯,1993,29(5):365-368.
[35]张薇,熊兴耀,李霞.马铃薯中龙葵素的提取方法[J].湖南农业大学学报,2006,6(32):665-667.
[36]张薇,文雄,潘双银,等.微波辅助提取马铃薯龙葵素[J].园艺学报, 2008,35(9):1393-1396.
[37]钱天寿,康孟利,凌建刚,等.洋芋中龙葵素的提取工艺研究[J].中国农学通报,2012,28(15):264-267.
[38]段光明,冯育林,叶荩.马铃薯糖苷生物碱的薄层层析及扫描测定[J].生物化学杂志,1995,11(3):368-369.
[39]Friedman M,Dao L.Distribution of glycoalkaloids in potato plants and commercial potato products[J].J Agric Food Chem,1992,40:419-423.
[40]Va¨a¨na¨nen T, Kuronen P, Pehu E.Comparison of commercial solid-phase extraction sorbents for the sample preparation of potato glycoalkaloids[J].J Chromatogr A,2000,869:301-305.
[41]Distl M,Sibum M,Wink M.Combination of on-line solidphase extraction with LC-MS for the determination of potentially hazardous glycoalkaloids in potato products[J].Potato Research, 2009, 52:39-56.
[42]Ha M,Kwak J H,Kim Y,et al.Direct analysis for the distribution of toxic glycoalkaloids in potato tuber tissue using matrix-assisted laser desorption/ionization mass spectrometric imaging[J].Food Chem, 2012,4(133):1155-1162.
[43]Matthew JA,Morgan MR,McNerney R,et al.Determination of solanidine in human plasma by radioimmunoassay[J].Food Chem Toxicol, 1983,21(5):637-640.
Advances in Research on Solanen Poisoning and Analysis
DONG Xiao-ru1,2,SHEN Min1,LIU Wei1,
(1.Shanghai Key Laboratory of Forensic Medicine,Institute of Forensic Science,Ministry of Justice,Shanghai 200063,China;2.College of Chemistry,Chemical Engineering and Materials Science,Soochow University,Suzhou 215123,China)
Solanen, toxic steroidal glycoalkaloid, exists in solanaceous plants such as potato plant.Mature potatos containing 7-10 mg solanen/100g potato is safe for human consumption.Solanen can be rapidly stimulated when potato turns green and sprouted by improper storage.Solanen has been estimated to be toxic in human at doses greater than 20 mg/100g potato.This paper summarizes the current researches on solanen in potato, the toxicology, pharmacology, pharmacokinetics and determination of solanen,provides the reference for forensic toxicology workers.
solanen; potato glycoalkaloids; poisoning; detection
DF795.1
A
10.3969/j.issn.1671-2072.2013.02.009
1671-2072-(2013)02-0035-07
2012-12-12
上海市科委资助项目(072512019);上海市法医学重点实验室(11DZ2271500)
董晓茹(1988—),女,硕士研究生,主要从事法医毒物学研究。 E-mail:rainny0601@126.com。
刘伟(1963—),女,主任法医师,硕士研究生导师,主要从事法医毒物学研究。E-mail:liuw@ssfjd.cn。
卓先义)
鉴定实践Forensic Practice

