表皮葡萄球菌生物膜感染动物模型的建立
刘华勇,武有聪,何年安,胡健,许涛,龚婷,韩海燕,吴旸,瞿涤
1. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032; 2. 大理学院基础医学院病原生物学综合实验室,大理 671000; 3. 安徽医科大学附属安徽省立医院,合肥 230001
随着医疗技术不断发展,各种高分子生物材料(如静脉导管、心瓣膜支架和人工关节等)在临床上越来越广泛应用,由此引起的医院内感染也日益增多。表皮葡萄球(Staphylococcusepidermidis)是医院内感染的主要病原菌之一,其致病性与生物膜[1](biofilm)密切相关。生物膜是由胞外聚合物(extracellular polymeric substance, EPS)包裹的、附着于某些介质表面而形成的膜状细菌群体,以整体方式对抗外界环境压力(如抵抗抗生素作用);同时,不断向外释放细菌,引起持续性感染。目前尚无有效清除细菌生物膜的药物。有研究表明,成熟生物膜内细菌的耐药性比浮游菌高500~5 000倍[1, 2]。
与金黄色葡萄球菌相比,表皮葡萄球菌侵袭力较弱(不产生毒素及侵袭性酶),因此用于研究其感染的动物模型不同于金黄色葡萄球菌。目前已建立的表皮葡萄球菌生物膜感染动物模型有小鼠中心静脉导管(central venous catheter, CVC)插管模型[3]、大鼠CVC插管模型[4]、兔皮下埋植支架模型[5]、小鼠皮下埋植导管模型等[6]。CVC相关动物模型技术要求高、操作繁琐、耗时长,易引起其他细菌感染而被迫终止;兔皮下埋植支架模型是将培养成熟的生物膜植入皮下,操作方便,技术要求不高,不易引起动物全身感染,但不能反映细菌生物膜在体内的形成过程;小鼠皮下埋植导管模型是将一定浓度的菌液注入动物皮下,模拟体内生物膜的形成过程,但菌液与导管内壁接触困难,形成生物膜所需时间长,动物体积小,不能平行比较多组间的差异。因此,至今尚无理想的研究表皮葡萄球菌生物膜感染的动物模型[7-10],还缺乏评估药物对体内生物膜作用效果的动物模型。
本研究通过体外检测各种动物血清对表皮葡萄球菌生物膜形成的抑制情况,筛选出新西兰白兔,建立表皮葡萄球菌生物膜感染模型,通过局部注射万古霉素观察其对体内生物膜形成的抑制作用。结果提示,该模型可用于研究表皮葡萄球菌在体内形成生物膜的能力及评价药物抗生物膜作用的效果。
1 材料与方法
1.1 材料
表皮葡萄球菌标准菌株ATCC RP62A(生物膜阳性菌株)购自美国标准生物品收藏中心(American Type Culture Collection,ATCC)。扫描电子显微镜(SEM, JSM-6700F)为日本JEOL公司产品,激光共聚焦电子显微镜(CLSM, TCS SP5)为德国Leica公司产品。FluoroDish购自WPI公司,96孔细胞培养板(Costar2592)购自美国Corning公司,胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基购自英国Oxiod公司。
1.2 方法
1.2.1不同动物血清抗表皮葡萄球菌生物膜的作用樱桃谷鸭和豚鼠购自上海畜牧研究所,新西兰白兔、C57小鼠、BALB/c小鼠和Sprague-Dawley (SD)大鼠购自上海斯莱克实验动物有限公司,测试抗生物膜作用的动物血清均为本实验室新鲜制备。表皮葡萄球菌过夜培养物经1∶200稀释后加入96孔板(200 μl/孔),37 ℃孵育2 h、4 h和6 h后,分别加入上述新鲜动物血清(按1∶50、 1∶100、 1∶200、 1∶500、1∶1 000和1∶2 000稀释),以不加动物血清组为阴性对照,每组3个复孔。孵育24 h后弃上清液,用磷酸缓冲液(phosphate buffered saline,PBS)洗3次,甲醇固定15 min后烘干,2%结晶紫染色8 min。570 nm处检测光密度(optical density,OD),选择血清抑制生物膜作用较弱的动物建立模型。
1.2.2表皮葡萄球菌生物膜感染动物模型的建立首先制备生物膜附着介质。取平底96孔聚乙烯细胞培养板的圆形孔底(小盘外径8 mm,内径6 mm,高2 mm),作为表皮葡萄球菌生物膜生长介质,小盘清洗后经环氧乙烷灭菌备用。然后采用2种方法建立新西兰白兔感染模型。①皮下埋植法:采用盐酸氯胺酮(35 μg/kg)和地西泮(安定)(5 μg/kg)肌内注射麻醉,俯卧位固定后,剃去脊柱中段两侧体毛,消毒后手术。在距脊柱约2 cm处切开皮肤,分离出约2 cm×3 cm的腔隙,埋植小盘(3个/切口),注入一定量菌液(见后),缝合包扎(图1)。手术后72 h处死动物,无菌操作取出小盘进行菌落计数,并在光学显微镜、扫描电子显微镜及激光共聚焦显微镜下观察。②腹腔埋植法:术前处理同上,切开腹膜后在两侧各埋植3个小盘,并注入菌液,分层缝合手术切口,其余处理同皮下埋植法。同时,摸索建立感染动物模型所需的接种菌量及体积,分为2组:一组动物用相同菌量不同体积的菌液感染,即将2 000、1 000、500、100 μl PBS重悬109菌落形成单位(colony-forming unit, CFU)表皮葡萄球菌,注入同一动物的不同切口中;另一组注入相同体积不同数量的菌液,即将1 000 μl浓度为109、108、107和106CFU/ml的菌液分别注入同一动物的不同切口中。
图1新西兰白兔皮下植盘生物膜感染示意图
Fig.1SchematicdiagramofsubcutaneousforeignbodyinfectionmodelsinNewZealandwhiterabbits
1.2.3表皮葡萄球菌生物膜感染动物模型的检测指标(1)血培养检测:动物处死前0 h和24 h分别取耳缘静脉血1.5 ml涂板,每个胰蛋白胨大豆琼脂(tryptic soy agar,TSA)平皿200 μl,每只动物涂6个平皿,37 ℃培养24~48 h后观察结果,1周无生长判为阴性。(2)体内生物膜的CFU检测:无菌操作取出小盘,PBS洗去表面分泌物,加入TSB培养基,刮取生物膜,4 000 r/min离心5 min;弃上清液,加入胰蛋白酶(0.25%)后充分混匀,37 ℃孵育30 min,离心弃上清液;用TSB重悬后行系列稀释,涂板(100 μl/平皿,每个浓度涂3个平皿),37 ℃孵育24 h后进行菌落计数(30~300个为有效范围)。CFU计数后,取常用对数(log10CFU)为纵坐标,重复3次。(3)体内形成生物膜的形态观察:①激光共聚焦显微镜观察:用PBS清洗FluoroDish 3次,加入600 μl Live/Dead染液(SYTO9将所有细胞染为绿色,碘化丙啶将死细菌染为红色。当2种染料同时染上一个细菌时,碘化丙啶可淬灭SYTO9的绿色荧光,因此活细菌染成绿色,而死细菌染成红色),室温放置20 min后于激光共聚焦显微镜下观察。②扫描电子显微镜观察:小盘经PBS洗涤后,用2%戊二醛固定2 h,真空干燥72 h,镀金,场发射扫描电子显微镜下观察。同时,以体外培养12 h的生物膜作为对照,比较该动物模型中生物膜与体外生物膜的形态差异。
1.2.4万古霉素在感染动物模型中抑制生物膜的作用在新西兰白兔皮下植入小盘后接种细菌,于术后24 h和48 h分别局部皮下注射万古霉素(1 ml,8 μg/ml),在另一侧切口中注入等量PBS(24 h和48 h)作对照。72 h后处死动物,取出小盘进行生物膜形态观察及CFU计数,以观察万古霉素体内抗生物膜的作用效果。
1.3 统计学分析
使用SPSS16.0统计学软件进行数据处理,数据以mean±SD表示,两组间比较采用t检验,多组独立样本比较采用单因素方差分析,P<0.05时为差异具有统计学意义。
2 结果
2.1 不同动物血清对表皮葡萄球菌体外生物膜形成的抑制作用
将分离自新西兰白兔、樱桃谷鸭、豚鼠、C57小鼠、BALB/c小鼠和SD大鼠的血清,分别于接种细菌后2 h、4 h和6 h按不同比例加入96孔板中,检测不同浓度动物血清在不同时间点对表皮葡萄球菌生物膜形成的影响。结果显示,所有动物血清对表皮葡萄球菌生物膜的形成均有抑制作用,在1∶50、1∶100和1∶200稀释时均具有较强抑制作用(OD570 nm<0.5),而对照组(未加血清)生物膜形成较强(OD570 nm>3.84)。1∶1 000以上稀释时对生物膜抑制作用均明显减弱 (樱桃谷鸭血清的抑制作用最弱,OD570 nm>3.0)。然而,在1∶500稀释时不同动物血清的抑制作用差异较大,新西兰白兔(OD570 nm=2.54)、樱桃谷鸭(OD570 nm=2.25)和C57小鼠 (OD570 nm=2.11)血清对生物膜的抑制作用低于豚鼠(OD570 nm= 1.89)、 BALB/c小鼠(OD570 nm= 1.16)和SD大鼠(OD570 nm=1.51)血清的抑制作用(图2)。因此,选用新西兰白兔进行表皮葡萄球菌生物膜的体内实验。
2.2 表皮葡萄球菌感染新西兰白兔模型的建立
为建立新西兰白兔皮下植盘生物膜感染模型,首先探索相同菌量不同体积的感染条件,在埋植小盘后分别将109CFU/2 000 μl、109CFU/1 000 μl、109CFU/500 μl或109CFU /100 μl的表皮葡萄球菌悬液(PBS稀释)注入皮下(同一动物,不同切口),72 h后取出肉眼观察,发现不同体积组的小盘表面均被稠密的脓液包裹(图3A)。经胰蛋白酶消化、结晶紫染色后,2 000 μl组和1 000 μl组小盘均能看到膜状物,但前者较稀薄;而500 μl组和100 μl组经胰蛋白酶处理后膜状物大多脱落 (图 3B)。 结果提示,采用1 000 μl PBS将109CFU表皮葡萄球菌重悬后接种形成生物膜的效果较理想。然后,将1 ml浓度为109CFU/ml、108CFU/ml、107CFU/ml和106CFU/ml的菌液分别注入兔皮下,结果发现在相同体积条件下,109CFU/ml浓度组在体内形成生物膜的能力最强(结果未显示)。

Overnight cultures ofS.epidermidisATCC RP62A were inoculated at a ratio of 1∶200 in a 96-well plate and incubated at 37 °C for 4 h, then different animal sera were added at the dilutions of 1∶50, 1∶100, 1∶200, 1∶500, 1∶1 000,1∶1 500 and 1∶2 000 respectively and incubated for another 24 h at 37 °C. The biofilm was stained with 2% crystal violet andOD570 nmwas measured.
图2体外动物血清对生物膜形成的抑制作用
Fig.2Theinhibitoryeffectsofdifferentanimalseraonbiofilmformation

Sterile polyethylene dishes were implanted subcutaneously in New Zealand white rabbits and 109CFU bacterial cells suspended at different volume fractions (2 000 μl, 1 000 μl, 500 μl, 100 μl) were inoculated. The morphology of biofilms examined by macroscopy (A) and light microscopy after being stained with crystal violet (B) was shown.
图3接种体积对表皮葡萄球菌感染新西兰白兔模型中生物膜形成的影响
Fig.3EffectsofinoculationvolumeonbiofilmformationinNewZealandwhiterabbits
然后,利用激光共聚焦显微镜观察表皮葡萄球菌在新西兰白兔体内植盘中所形成的生物膜(Live/Dead染液染色):A为体外生物膜形成组(体外培养12 h,植入兔皮下);B为1 000 μl菌液体内生物膜形成组(兔皮下植盘后注入1 000 μl 109CFU/ml 菌液); C为100 μl菌液体内生物膜形成组(兔皮下植盘后注入100 μl 109CFU/ml菌液)。植入小盘均于72 h后取出。A组和B组小盘中均可观察到细菌生物膜,并有大量活菌存在;而C组未观察到明显生物膜形成(图4)。扫描电子显微镜观察结果显示, A组和B组小盘表面有大量的分泌物覆盖,可见细菌聚集,与体外培养的表皮葡萄球菌生物膜相似;C组仅见散在细菌团块和部分分泌物(图5)。
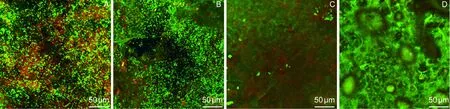
A: Polyethylene dishes covered with 12 h-biofilm were implanted subcutaneously in New Zealand white rabbits, and removed after 72 h for observation under confocal laser scanning microscope. B: Sterile dishes were implanted subcutaneously, then followed by 1 000 μl (109CFU/ml) inocula, and were visualized after 72 h. C: Sterile dishes were implanted subcutaneously, then followed by 100 μl (109CFU/ml) inocula. D: B was treated with vancomycin at 24 h and 48 h.
图4激光共聚焦显微镜观察新西兰白兔皮下植盘中生物膜形态
Fig.4ThemorphologyofbiofilmformedinNewZealandwhiterabbitsunderconfocallaserscanningmicroscope

A: Polyethylene dishes covered with 12 h-biofilm were implanted subcutaneously in New Zealand white rabbits, and removed after 72 h for observation under scanning electron microscope. B: Sterile dishes were implanted subcutaneously, then followed by 1 000 μl inocula (109CFU/ml). C: Sterile dishes were implanted subcutaneously, then followed by 100 μl (109CFU/ml) inocula. D: B was treated with vancomycin at 24 h and 48 h.Invitrobiofilm (12 h) as a control.
图5扫描电子显微镜下观察新西兰白兔模型内形成的生物膜形态
Fig.5ThemorphologyofbiofilmformedinNewZealandwhiterabbitsunderscanningelectronmicroscope
最后,刮取感染动物植入小盘表面的生物膜进行菌落计数,A、B、C组的log10CFU计数分别为5.18±0.25、5.02±0.5、4.35±0.44。经统计学分析,A组与B组的活菌数无显著性差异(P>0.05),B组与C组的活菌数具有显著性差异(P<0.01),提示接种不同体积的菌液(相同菌液浓度)可影响新西兰白兔体内生物膜的形成(图6)。
2.3 用新西兰白兔感染模型评估万古霉素的抗表皮葡萄球菌生物膜活性
为研究万古霉素体内抗生物膜的效果,在植入小盘后注入1 000 μl (109CFU/ml)菌液,分别于24 h和48 h局部注射1 ml万古霉素 (8 μg/ml),72 h后取出小盘观察。激光共聚焦显微镜和扫描电子显微镜均未观察到明显的生物膜形成,仅见散在的细菌和大量分泌物(图4D、5D)。刮取小盘上的生物膜计数活菌数,未处理组的log10CFU值为 5.02±0.5,万古霉素处理组减少4 log10CFU(1.08±0.26),具有显著性差异(P<0.01)(图6)。

Bacterial cells were collected from the implanted dishes in the rabbit model after digestion with trypsin (0.25%), and bacterial counts were determined. A: Polyethylene dishes covered with 12 h-biofilm were implanted subcutaneously in New Zealand white rabbits, CFU value was detected after 72 h. B: Sterile dishes were implanted subcutaneously, then followed by 1 000 μl (109CFU/ml) inocula. C: Sterile dishes were implanted subcutaneously, then followed by 100 μl (109CFU/ml) inocula. D: B was treated with vancomycin at 24 h and 48 h. The log10CFU/ml value was used for evaluation of viable cells in the biofilm ofS.epidermidis.**P<0.01.
图6新西兰白兔模型中生物膜内活菌量计数
Fig.6Viablecells(CFU)inbiofilmofNewZealandwhiterabbitmodel
3 讨论
表皮葡萄球菌为寄生于人体体表及与外界相通腔道中的常见条件致病菌之一,通常在植入性医疗材料表面形成生物膜而引起医院内感染。细菌生物膜感染引起的耐药性及持续性问题是治疗失败的主要原因,研究生物膜形成机制及影响因素成为解决上述问题的关键。生物膜感染动物模型的建立,对研究生物膜的体内形成过程、药物对体内生物膜的作用效果,以及生物膜耐药的相关机制具有重要意义[11]。但目前尚无理想的表皮葡萄球菌生物膜感染动物模型。
2004年Carmen等[9]选取新西兰白兔建立了表皮葡萄球菌生物膜感染的动物模型,应用该模型证明了万古霉素联合超声技术可增强药物对体内生物膜的作用效果。本实验室也利用这一动物模型验证了超声靶向微泡可增强万古霉素的抗生物膜作用[12]。该模型是将体外培养成熟的生物膜植入动物皮下,用物理手段联合药物来观察其对生物膜的体内作用,但不能切实反映生物膜在体内的形成过程,存在一定的局限性。另有文献报道采用导管插管或心室放置支架等方法建立体内生物膜感染模型,通过静脉注入一定量的菌液后观察支架上生物膜的形成过程[13-16]。这些方法能较好地模拟临床中生物膜感染的自然形成过程,但由于条件要求高、技术难度大、易受机体免疫细胞和体液因子影响(重复性差)、观察时间长、易引起败血症或脓毒血症,所以实验动物不能耐受或死亡,不利于广泛应用[17-20]。
本研究从筛选模型动物入手,发现新西兰白兔、樱桃谷鸭和C57小鼠血清对表皮葡萄球菌生物膜形成的抑制作用较弱,可作为生物膜感染模型的候选动物。从操作的简便性、可多点埋植等因素考虑,选择新西兰白兔作为候选动物,探索腹腔埋植法、皮下埋植法和合适的切口部位。结果显示,皮下埋植组3只动物内埋植的小盘均可形成细菌生物膜。而腹腔埋植组的1只动物在术后60 h死亡(血培养阴性);72 h麻醉处死其余2只动物,解剖发现腹腔埋植的小盘被大网膜包裹,炎性渗出液较多,取出小盘肉眼未见生物膜形成,提示腹腔埋植法不宜用于观察表皮葡萄球菌生物膜的体内形成。
本研究进一步探索了建立生物膜形成动物模型所需的合适接种菌量和体积。为减少动物之间的个体差异,在同一动物背部皮下4个点埋植聚乙烯小盘(每点3个盘),比较不同菌量和接种体积对体内生物膜形成的影响。结果发现,接种一定菌量(109CFU/ml)和体积(1 000 μl)的细菌后可形成明显的生物膜,并可通过普通光学显微镜、激光共聚焦显微镜和电子显微镜观察细菌在体内形成的生物膜形态。皮下埋植法模型中体内形成的表皮葡萄球菌生物膜与体外培养的生物膜,在形态、厚度及生物膜内活菌量方面均相似,说明该模型可用于表皮葡萄球菌生物膜相关的体内实验研究。且与鼠动物模型[14, 21]相比,新西兰白兔体形较大,可在同一动物体内观察多组处理因素,以降低动物个体差异对处理因素的影响。本模型一定程度上模拟了体内生物膜的自然形成过程,避免了体外培养后植入的局限性,与导管插管[14, 15]等动物模型相比,操作简单、手术难度不高、结果稳定。
利用新西兰白兔皮下埋植法观察了万古霉素对表皮葡萄球菌生物膜的作用效果。在注入菌液后24 h和48 h局部给予万古霉素,72 h后取出埋植盘,万古霉素处理组基本不形成生物膜。生物膜内的活菌数,万古霉素处理组明显低于未处理组,提示万古霉素通过抑菌活性而抑制表皮葡萄球菌在体内形成生物膜。该动物模型可用于评价局部药物抗生物膜的作用效果。
总之,本研究建立的新西兰白兔感染模型为体内研究生物膜提供了一种比较有效的方法,可用于研究表皮葡萄球菌生物膜体内形成情况,检测葡萄球菌临床株生物膜对药物的敏感性[18],以及评价体内药物抗生物膜的作用效果,对指导临床用药具有一定的应用价值。
[1] Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections [J]. Science,1999,284(5418):1318-1322.
[2] Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms [J]. Lancet,2001,358(9276):135-138.
[3] Li H, Xu L, Wang J, Wen Y, Vuong C, Otto M, Gao Q. Conversion of Staphylococcus epidermidis strains from commensal to invasive by expression of the ica locus encoding production of biofilm exopolysaccharide [J]. Infect Immun,2005,73(5):3188-3191.
[4] Coenye T, Nelis HJ. In vitro and in vivo model systems to study microbial biofilm formation [J]. J Microbiol Methods,2010,83(2):89-105.
[5] 储诚兵,黎檀实,沈定霞,王慧,曹敬荣,王继芳. 内植物感染生物被膜动物模型的建立与评价[J]. 中华医院感染学杂志,2009(7):738-741.
[6] Liu Q, Fan J, Niu C, Wang D, Wang J, Wang X, Villaruz AE, Li M, Otto M, Gao Q. The eukaryotic-type serine/threonine protein kinase Stk is required for biofilm formation and virulence in Staphylococcus epidermidis [J]. PLoS One,2011,6(9):e25380.
[7] Costerton JW, Stewart PS. Battling biofilms [ J]. Sci Am,2001,285(1):74-81.
[8] del Pozo JL, Patel R. The challenge of treating biofilm-associated bacterial infections [J]. Clin Pharmacol Ther,2007,82(2):204-209.
[9] Carmen JC, Roeder BL, Nelson JL, Beckstead BL, Runyan CM, Schaalje GB, Robison RA, Pitt WG. Ultrasonically enhanced vancomycin activity against Staphylococcus epidermidis biofilms in vivo [J]. J Biomater Appl,2004,18(4):237-245.
[10] 储诚兵,黎檀实,沈定霞,罗燕萍,郝立波,王继芳. 4种内植物材料影响表皮葡萄球菌形成生物被膜的体外研究[J]. 中华医院感染学杂志,2008,18(7):924-927.
[11] Fey PD, Olson ME. Current concepts in biofilm formation of Staphylococcus epidermidis [J]. Future Microbiol,2010,5(6):917-933.
[12] He N, Hu J, Liu H, Zhu T, Huang B, Wang X, Wu Y, Wang W, Qu D. Enhancement of vancomycin activity against biofilms by using ultrasound-targeted microbubble destruction [J]. Antimicrob Agents Chemother,2011,55(11):5331-5337.
[13] Nair PN, Brundin M, Sundqvist G, Sjögren U. Building biofilms in vital host tissues: a survival strategy of Actinomyces radicidentis [J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2008,106(4):595-603.
[14] Kristian S A, Golda T, Ferracin F, Cramton SE, Neumeister B, Peschel A, Götz F, Landmann R. The ability of biofilm formation does not influence virulence of Staphylococcus aureus and host response in a mouse tissue cage infection model [J]. Microb Pathog,2004,36(5):237-245.
[15] Cirioni O, Giacometti A, Ghiselli R, Bergnach C, Orlando F, Mocchegiani F, Silvestri C, Licci A, Skerlavaj B, Zanetti M, Saba V, Scalise G. Pre-treatment of central venous catheters with the cathelicidin BMAP-28 enhances the efficacy of antistaphylococcal agents in the treatment of experimental catheter-related infection [J]. Peptides,2006,27(9):2104-2110.
[16] Rediske AM, Roeder BL, Brown MK, Nelson JL, Robison RL, Draper DO, Schaalje GB, Robison RA, Pitt WG. Ultrasonic enhancement of antibiotic action on Escherichia coli biofilms: an in vivo model [J]. Antimicrob Agents Chemother,1999,43(5):1211-1214.
[17] Fluckiger U, Ulrich M, Steinhuber A, Döring G, Mack D, Landmann R, Goerke C, Wolz C. Biofilm formation, icaADBC transcription, and polysaccharide intercellular adhesin synthesis by staphylococci in a device-related infection model [J]. Infect Immun,2005,73(3):1811-1819.
[18] Fernández-Hidalgo N, Gavaldà J, Almirante B, Martín MT, Onrubia PL, Gomis X, Pahissa A. Evaluation of linezolid, vancomycin, gentamicin and ciprofloxacin in a rabbit model of antibiotic-lock technique for Staphylococcus aureus catheter-related infection [J]. J Antimicrob Chemother,2010,65(3):525-530.
[19] Hengzhuang W, Wu H, Ciofu O, Song Z, Høiby N. In vivo pharmacokinetics/pharmacodynamics of colistin and imipenem in Pseudomonas aeruginosa biofilm infection [J]. Antimicrob Agents Chemother, 2012, 56(5):2683-2690.
[20] Seth AK, Geringer MR, Gurjala AN, Hong SJ, Galiano RD, Leung KP, Mustoe TA. Treatment of Pseudomonas aeruginosa biofilm-infected wounds with clinical wound care strategies: a quantitative study using an in vivo rabbit ear model [J]. Plast Reconstr Surg,2012,129(2):262e-274e.
[21] Kukavica-Ibrulj I, Bragonzi A, Paroni M, Winstanley C, Sanschagrin F, O’Toole GA, Levesque RC. In vivo growth of Pseudomonas aeruginosa strains PAO1 and PA14 and the hypervirulent strain LESB58 in a rat model of chronic lung infection [J]. J Bacteriol,2008,190(8):2804-2813.

