类鼻疽的研究进展及诊疗现状
方静,方瑶
1. 湖北省黄冈市罗田县第一人民医院综合科,黄冈 438600; 2. 第三军医大学临床微生物及免疫学教研室,重庆 400038
类鼻疽(melioidosis)是由类鼻疽伯克霍尔德菌(Burkholderiapseudomallei)感染引起的一种新发传染病,属热带疾病。临床常表现为肺部症状(肺部影像常见多发性脓肿、空洞),易引发脓毒血症、脏器脓肿,病情可急剧恶化,病死率达20%~60%。也可有一过性感染或隐性感染,临床症状不典型,极易误诊。类鼻疽疫区主要分布在热带及亚热带地区,包括澳大利亚北部、东南亚等,其他地区也有散发病例报道[1]。我国的类鼻疽流行区域主要集中在海南、广东等地,其流行的严峻性并不为人们警觉[2]。
类鼻疽伯克霍尔德菌革兰染色阴性,两端钝圆,两极浓染(形似回形针),无芽胞,有鞭毛和菌毛[3]。它还是一种具有微生态稳定性的细菌,在恶劣气候(如暴雨、台风、海啸)破坏其生态环境后,病原菌的微生态平衡会被打破,导致疾病散发,甚至暴发流行。人群对类鼻疽伯克霍尔德菌普遍易感,发病与否及临床转归与感染菌量、病原体毒力和宿主的免疫状态有关。类鼻疽伯克霍尔德菌感染的高危人群主要是与疫区环境有过密切接触的人。虽然对疫区居民的调查发现人群中的抗体阳性率很高,但并没有保护作用[4]。
1 类鼻疽的致病机制
1.1 感染途径
类鼻疽伯克霍尔德菌以气溶胶或带菌液体的形式通过黏膜黏附和创伤面直接感染机体。细菌进入机体后虽可被天然免疫细胞(如巨噬细胞、中性粒细胞)吞噬,却能通过一系列的逃逸机制(如形成肌动蛋白尾结构)阻止内吞体与溶酶体融合,降低胞质免疫压力,从而将巨噬细胞、中性粒细胞等宿主细胞作为复制、生存的生态环境和营养来源[5]。如果一次感染机体的菌量足够大(或以气溶胶形式感染),可能导致急性类鼻疽;如果免疫状态低下、菌量少,则倾向于二次菌血症,导致慢性感染。临床观察,慢性类鼻疽患者的脾脏显著增大,推测脾脏是类鼻疽伯克霍尔德菌的储存器官[6]。
1.2 毒力因子
毒力是病原菌侵入机体导致发病的重要因素。类鼻疽临床进展急骤的原因可能是由于病原体毒力很强。但关于类鼻疽伯克霍尔德菌毒力因子的研究国内较少,基于临床致病株的毒力分析更是空白。国外研究[7]对其毒力因子的关注点如表1所示。
最近研究发现,类鼻疽伯克霍尔德菌也能分泌外毒素,这可能更好解释其极易造成脓毒血症、皮下脓肿等类似革兰阳性菌所致症状的原因。
1.3 机体免疫
类鼻疽伯克霍尔德菌一般不致健康人感染,可视为一种机会致病菌。患者的免疫状态会直接影响疾病的感染和临床转归,这也是为何将糖尿病(尤其是2型糖尿病)、酗酒、慢性肺病、慢性肾病和类固醇依赖等列为类鼻疽高危因素的原因[1],但具体机制不清楚,可能与该状况下机体中性粒细胞功能低下有关。虽然机体的天然免疫、体液免疫和细胞免疫对细菌都有一定的抑制作用,但效果不明显。针对各菌结构成分的抗体保护作用也不确定,一些细胞因子还会加重病情[8]。
表1类鼻疽伯克霍尔德菌主要毒力因子
Tab.1ThemainvirulencefactorsofBurkholderiapseudomallei
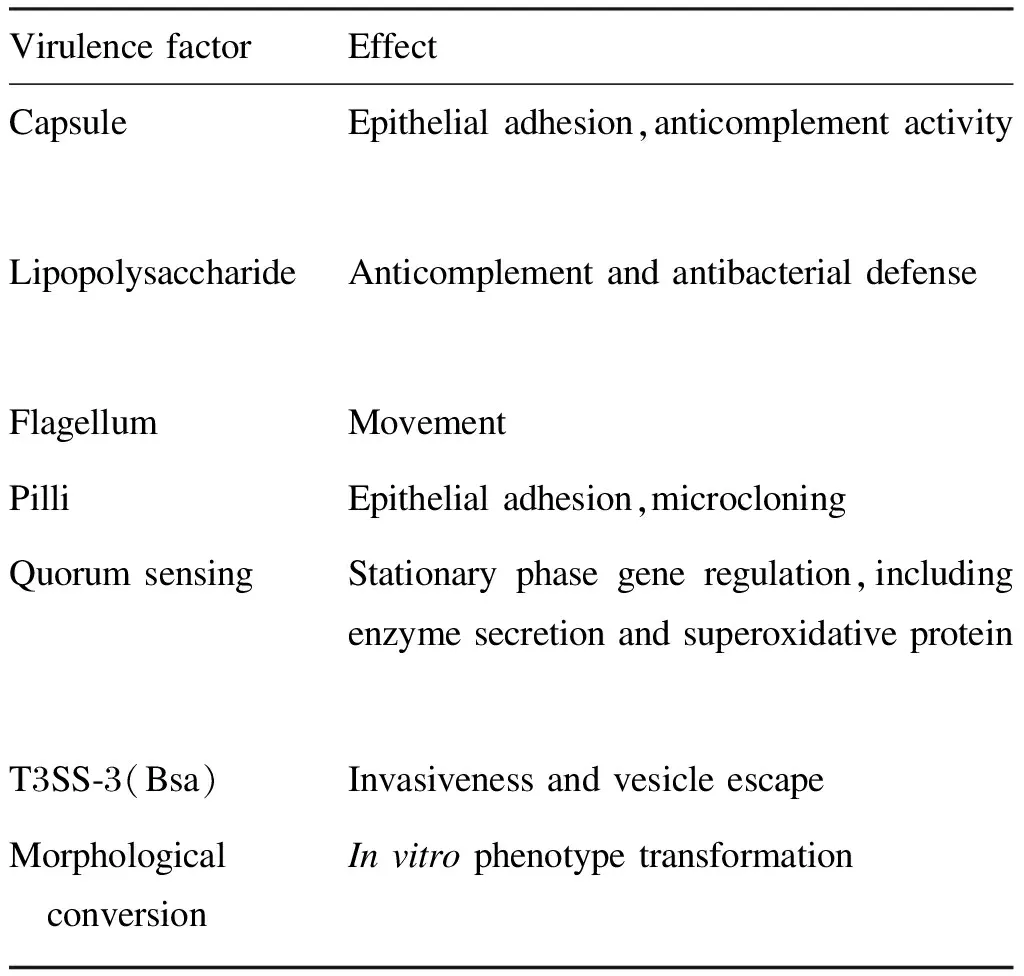
Virulence factorEffectCapsuleEpithelial adhesion,anticomplement activity LipopolysaccharideAnticomplement and antibacterial defenseFlagellumMovementPilliEpithelial adhesion,microcloningQuorum sensingStationary phase gene regulation,including enzyme secretion and superoxidative proteinT3SS-3(Bsa)Invasiveness and vesicle escapeMorphological conversionIn vitro phenotype transformation
2 类鼻疽的临床表现及诊断
类鼻疽的临床症状多变,病变几乎涉及所有器官(眶、面、中枢神经系统、腮腺、头颈皮下、肺、腹腔、肝、脾、肾、前列腺、骨等),肺部症状最为常见。不同流行区域的类鼻疽临床表现和易累及的器官组织也不相同,如澳大利亚类鼻疽病例中前列腺脓肿较泰国多;而在后者,中枢神经系统、腮腺受累的患者较多[3]。中国海南地区类鼻疽的临床表现以肺部症状为主,也最能引起当地医务人员的注意,因为其肺部影像资料更具特点(如肺部的多发性小脓肿或空洞),但有待进一步深入的临床调研[9]。
类鼻疽有多种临床表现,包括隐性感染、急性感染、慢性感染和潜伏性感染。疫区居民的抗体背景很高,这可能是长期暴露于类鼻疽伯克霍尔德菌的环境导致机会感染而留下的印记。有外伤史、旅游史(对于非疫区人员)的患者往往更能引起医务人员的注意。但急性感染患者的病原菌接触史有时并不明显,部分患者入院就表现出急性或重症肺炎,无法主诉,数日内死亡。这种急骤病程的病例占死亡病例的绝大部分,最终确诊也必须通过尸检才能完成,这也是困扰疫区临床医师的很大问题。慢性感染很容易与其他疾病相混淆,如针对肺部慢性厚壁空洞的影像资料,即使疫区的临床医师也会初诊为结核病或其他炎症性疾病,除了组织活检其他方法无法完全确诊。因此,这些易混淆的病例极容易被误诊,增加患者痛苦,也浪费资源。对类鼻疽伯克霍尔德菌的潜伏和复发机制一直不清楚,体内菌的储存或潜伏位置也不明,唯有通过规范化治疗和随访才能降低其发生率。
细菌分离培养是诊断类鼻疽的“金标准”,但这种方法受人为因素和环境因素的影响很大。分子生物学方法,如普通聚合酶链反应(polymerase chain reaction,PCR)、实时PCR等直接用于检测临床标本时效果并不理想[10,11]。血清学诊断在疾病流行区域往往没有太大的诊断意义,而且在类鼻疽急性病程的早期往往检测不到血液中的抗体。我国海南地区类鼻疽的诊断主要还是依靠临床医师的诊疗经验。影像学在类鼻疽诊断中也发挥重要作用,但即使如此,误诊和漏诊的病例仍难估计。
3 类鼻疽的治疗、预防及展望
本文参考了澳大利亚和东南亚一些国家的类鼻疽治疗方案(澳大利亚标准[1]),该方案分为初期强化治疗和后期病原菌清除治疗。初期强化治疗的一线药物至少包含头孢他啶(或亚胺培南、美罗培南等),而β-内酰胺酶抑制剂(阿莫西林-克拉维酸盐)则作为二线药物,静脉用药1~2周。如果有化脓性感染并发症,则延长至6周。病原菌清除治疗可采用口服方案,包括甲氧苄啶-磺胺甲唑和阿莫西林-棒酸,治疗周期一般为3~6个月。也有尝试在治疗中辅助应用细胞因子如γ干扰素,被证明有一定效果。临床研究显示,高水平γ干扰素与病死率有一定关联,由此被当做临床类鼻疽的“死亡因子”,但对其治疗类鼻疽的临床疗效及安全性还没有定论[1]。即使进行了规范化的抗生素治疗,类鼻疽的复发率仍在20%左右,这可能与类鼻疽伯克霍尔德菌的耐药性有关,具体机制还不清楚。
目前我国还没有类鼻疽规范化治疗方案。大部分临床医师常规使用广谱抗生素,再就是根据影像学资料提示的病灶变化情况来指导用药[12];一般没有做病原菌清除治疗。已有研究表明,类鼻疽伯克霍尔德菌慢性感染者能持续向环境中排放病菌,机体的免疫压力促使病菌发生遗传变异,使环境中的病菌拥有更强的适应力和毒力。随着全球变暖的趋势和国际交往的增加,类鼻疽伯克霍尔德菌的播散范围会越来越广,影响也会越来越大。不同地区类鼻疽个案病例报道的增加已印证了这一点。因此,规范化的临床治疗方案和切实的临床研究亟待解决。
目前为止,预防类鼻疽还缺乏可用的疫苗。预防性使用抗生素对短暂与病原接触时的预防有一定作用。国际社会已在警示去疫区出游的人们关注这种不可预测的急性热带感染性疾病,同时建议政府能在民众出游指南中对在疫源地如何预防类鼻疽伯克霍尔德菌感染给予一定指导[13]。类鼻疽伯克霍尔德菌基因组全长7.14 Mb,抗原结构复杂,生物学行为多样,给疫苗研究带来很多困难。但随着对其致病机制研究的深入及基因组学和蛋白质组学的发展[14],研究者已筛选出具有更好免疫原性和保护力的靶抗原,在动物实验中显示出较好的保护效果。也许在不久的将来,如果去类鼻疽疫源地旅游,一支类鼻疽疫苗会让旅程更安心。
[1] Wiersinga WJ, Currie BJ, Peacock SJ. Melioidosis [J]. N Engl J Med, 2012,367(11): 1035-1044.
[2] 毛旭虎. 加强类鼻疽的研究[J]. 第三军医大学学报, 2011, 33(13): 1315-1317.
[3] Cheng AC,Currie BJ. Melioidosis: Epidemiology, pathophysiology, and management [J]. Clin Microbiol Rev, 2005, 18(2): 383-416.
[4] Wiersinga WJ, van der Poll T, White NJ, Day NP, Peacock SJ. Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei [J]. Nat Rev Microbiol, 2006, 4(4): 272-282.
[5] Kespichayawattana W, Rattanachetkul S, Wanun T, Utaisincharoen P, Sirisinha S. Burkholderia pseudomallei induces cell fusion and actin-associated membrane protrusion: a possible mechanism for cell-to-cell spreading [J]. Infect Immun, 2000, 68(9): 5377-5384.
[6] Pilatz S, Breitbach K, Hein N, Fehlhaber B, Schulze J, Brenneke B, Eberl L, Steinmetz I. Identification of Burkholderia pseudomallei genes required for the intracellular life cycle and in vivo virulence [J]. Infect Immun, 2006, 74(6): 3576-3586.
[7] Lazar Adler NR, Govan B, Cullinane M, Harper M, Adler B, Boyce JD. The molecular and cellular basis of pathogenesis in melioidosis: how does Burkholderia pseudomallei cause disease [J]?FEMS Microbiol Rev, 2009, 33(6): 1079-1099.
[8] Lauw FN, Simpson AJ, Prins JM, van Deventer SJ, Chaowagul W, White NJ, van der Poll T. The CXC chemokines gamma interferon(IFN-gamma)-inducible protein 10 and monokine induced by IFN-gamma are released during severe melioidosis [J]. Infect Immun, 2000, 68(7): 3888-3893.
[9] 杨小敏,陈海. 耐药类鼻疽伯克霍尔德菌感染的临床分析[J]. 南方医科大学学报, 2008, 28(10): 1933-1934.
[11] 杨小敏, 方瑶, 顾江, 陈海, 王海光, 毛旭虎. 特异引物PCR鉴定类鼻疽伯克霍尔德菌方法的建立和优化[J]. 第三军医大学学报, 2011, 33(14): 1427-1431.
[12] 林容,谢灿茂,陈海,黄奕江. 类鼻疽病122 例临床特征及耐药性分析[J].广东医学, 2011, 32(17): 2303-2304.
[13] Bondi SK, Goldberg JB. Strategies toward vaccines against Burkholderia mallei and Burkholderia pseudomallei [J]. Expert Rev Vaccines, 2008, 7(9):1357-1365.
[14] Ou K, Ong C, Koh SY, Rodrigues F, Sim SH, Wong D, Ooi CH, Ng KC, Jikuya H, Yau CC, Soon SY, Kesuma D, Lee MA, Tan P. Integrative genomic, transcriptional, and proteomic diversity in natural isolates of the human pathogen Burkholderia pseudomallei [J]. J Bacteriol, 2005, 187(12):4276-4285.

