人支架蛋白IQGAP1-shRNA慢病毒载体的构建及鉴定*
张 芮 王一兵 林 莉 王法刚 李 强 曹永倩
(1.山东医学高等专科学校病理教研室,山东 济南 250002;2. 山东大学附属省立医院烧伤整形美容外科, 山东 济南 250021)
作为一种细胞骨架蛋白,支架蛋白IQGAP1在细胞的多种生物学行为中发挥重要功能,通过调节多种信号传导途径在肿瘤细胞迁移、侵袭和增殖中扮演重要的角色;并与多种恶性肿瘤的发展、转移和预后密切相关。为探讨IQGAP1在肿瘤细胞转移侵袭中的作用机制,我们构建针对IQGAP1基因的RNA干扰(RNAi)的慢病毒载体,高效、特异、稳定地抑制IQGAP1基因的表达。
1 材料与方法
1.1材料
PCR用试剂primer(生工生物工程上海有限公司),Positive clone测序(Invitrogen公司),Taq polymerase(NEB公司),DMEM+ 10% 胎牛血清(GIBICO公司),高纯度质粒抽提试剂盒(QIAGEN公司),DNA ladder、EcoR I、T4 DNA ligase(Fermentas公司)。
1.2慢病毒干扰载体的构建
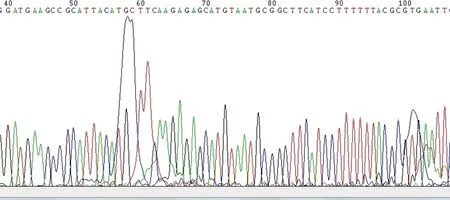
针对目的基因靶基因序列,根据Genbank中人IQGAP1(NM_003870)的基本信息,设计4个RNA 干扰靶点序列,分别为No.1: CAGTAATCTACATTTCCAT, No.2: CATCCACTTACCAGGATAT, No.3:GGATGAAGCCGCATTACATGC, No.4:GCCCAGCAATATCAGAGAAGA。经BLAST检索,确认除IQGAP1基因以外的已知基因无同源性,分别设计并合成4对shRNA寡聚单链DNA,退火成双链后插入到慢病毒载体中,构建4 个shRNA慢病毒重组质粒。shRNA经退火、酶切、回收后与引物连接,把连接产物全部加入感受态细胞中进行转化。过夜培养后,挑取若干个单菌落,测序鉴定阳性克隆。
1.3慢病毒载体沉默效果的验证
用QIAGEN高纯度质粒抽提试剂盒制备构建4条shRNA慢病毒载体质粒,将状态良好,处于对数生长期的空白细胞293T细胞,按照每孔5×105个细胞接种于3.5 cm 培养皿,24 h细胞覆盖70%~80%左右进行转染,48 h收集细胞抽提蛋白,采用Western blot检测目的蛋白的表达情况,进而判断shRNA慢病毒载体对不同靶点的干扰效果。
1.4慢病毒的包装和病毒滴度的测定
抽取shRNA载体及其辅助包装原件载体质粒,使用HG transgene reagent 将构建好的慢病毒shRNA载体及其辅助包装原件载体质粒共转染进293T 细胞,转染10~12 h 后加Enhancing buffer,接着8 h 后更换新鲜培养基,继续培养48 h 后,收集富含慢病毒颗粒的细胞上清液,在293T 细胞中测定病毒滴度。
2 结 果
2.1阳性克隆测序结果
经过比对,重组克隆中插入片段序列与设计的oligo序列完全一致,因此IQGAP1-shRNA 慢病毒载体构建成功(图1,2)。

图1 pGMLV-SB1RNAi 慢病毒载体图谱

IQGAP1-shRNA1

IQGAP1-shRNA2
IQGAP1-shRNA3

IQGAP1-shRNA4
2.2Western blot 方法检测转染后IQGAP1基因的表达水平
以β-actin作为内参对照,Western blot检测转染后IQGAP1蛋白表达条带。可见实验组IQGAP1蛋白表达量减少,IQGAP1-shRNA3沉默效果明显,为有效靶点(图3),以此进行病毒包装。
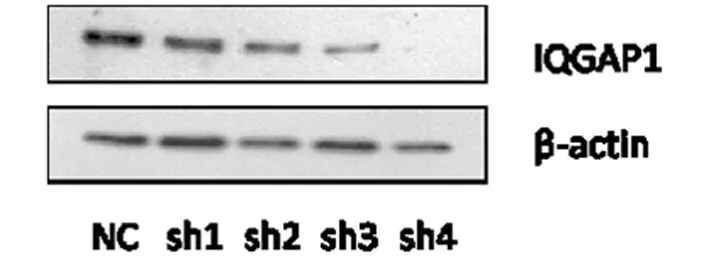
图3 转染后IQGAP1基因的表达水平
2.3慢病毒shRNA感染细胞96 h后部分孔的荧光照片 如图4。


图4 慢病毒shRNA感染细胞96 h后荧光照片
A为含有10×10-9ml的慢病毒原液,B为含有10×10-10ml的慢病毒原液
IQGAP1-shRNA3 病毒感染293T细胞,B号孔中观察表达绿色荧光的细胞至少为20个,则病毒的滴度为:20TU/10×10-10ml =2×1010TU/ml,可以作为贮存液用于后续的研究。
3 讨 论
近年来IQGAP1蛋白在恶性肿瘤中的研究是肿瘤侵袭转移领域的一大热点,高表达的IQGAPl蛋白能够破坏细胞间的粘附连接,降低细胞间的粘附力,并且显著增强细胞运动能力[1],而这二者在肿瘤细胞的侵袭转移中处于核心地位。IQGAP1作为Rac1/Cdc42信号通路和肌动蛋白动力的调节者[2],被认为是细胞迁移的重要调节者[3-5]。同时通过影响E-cadherin介导的上皮细胞间的粘附连接,降低细胞间的粘附性[6]。细胞间粘附力降低,可以使肿瘤细胞更容易从细胞集落中脱落下来,进入血流和周围组织。
IQGAP1 在结肠癌、乳腺癌、肺癌、前列腺癌等多种恶性肿瘤组织中表达明显增高[7-8],并且在恶性胶质瘤病人中已作为判断预后的重要标志之一。在侵袭性高的卵巢腺癌组织中IQGAP1的表达比在腺瘤或交界性瘤组织中的表达明显增高[9]。在胃癌病人中,IQGAP1的低表达提示预后良好[10]。Jun J等[11]利用免疫组化的方法观察鼻窦内翻性乳头状瘤(IP)、鼻窦鳞状细胞癌(SCC)及二者兼有的标本(IPcSCC),发现SCC和IPcSCC组织中IQGAP1的表达量比IP组织和非肿瘤性疾病中明显增高;在SCC病人中,IQGAP1的表达与局部复发和远处转移密切相关。因此通过各种手段沉默敲除或下调IQGAP1的表达,研究其对肿瘤转移侵袭能力的影响是倍受重视的研究思路。但目前关于应用RNA干扰手段沉默表达IQGAP1的报道还比较少见,因此我们构建了IQGAP1-RNAi的慢病毒载体系统,用于转染IQGAP1表达较高的肿瘤细胞,观察其对肿瘤细胞转移侵袭能力的影响。
RNA干扰是由双链RNA(dsRNA)转化成小分子干扰RNA(siRNA)所介导的一种基因沉默的过程[12],小片段的siRNA可以诱导高效的基因沉默。因此利用RNAi来阻断目的基因的表达,是目前基因治疗和基因功能研究的热点之一[13-14]。
细胞基因修饰的常用载体有非病毒转移载体和基因修饰病毒载体,前者包括质粒、寡核苷酸等,但存在转移效率低、细胞膜损伤等缺点。病毒载体包括逆转录病毒、腺病毒和慢病毒等,完全缺失致病基因的慢病毒(lentivirus)载体具有很高的安全性[15],对于分裂或非分裂细胞均有较高的感染能力,能够使目的基因整合到宿主的基因组,为靶基因的沉默稳定、持久提供了有力保障[16-17]。可显著提高RNAi的抑制效率,慢病毒载体作为新一代高效表达载体推进了肿瘤的基因治疗。
本实验设计出GC含量在32%~48%的4个shRNA序列,连接慢病毒载体pGMLV-SB1,测序鉴定后,将构建重组的载体和慢病毒包装质粒共同转染293T细胞,通过Western blot证明在293T细胞中成功抑制了IQGAP1的表达,并在293T细胞中成功包装出entivirus-IQGAP1-shRNA病毒,测定病毒滴度达2×1010TU/ml;为RNAi用于靶向IQGAP1的基因治疗提供了有效的siRNA序列,为肿瘤的基因诊断和治疗开启了一扇窗。
[1] Noritake J, Watanabe T,Wang S,et al.IQGAP1: a key regulator of adhesion and migration[J].J Cell Sci,2005,118(Pt10):2085-2092.
[2] Briggs MW, Sacks DB. IQGAP1 as signal integrator: Ca2+, calmodulin, Cdc42 and the cytoskeleton[J].FEBS Lett,2003,542(1-3):7-11.
[3] Mataraza JM, Briggs MW,Li Z, et al. IQGAP1 promotes cell motility and invasion[J].J Biol Chem,2003,278(42):41237-41245.
[4] Kholmanskikh SS, Koeller HB, WynshawBA, et al. Calcium dependent interaction of Lis1 with IQGAP1 and Cdc42 promotes neuronal motility[J].Nat Neurosci,2006,9(1):50-57.
[5] Brandt DT, Marion S, Griffiths G, et al. Dia1 and IQGAP1 interact in cell migration and phagocytic cup formation[J].J Cell Biol,2007,178(2):193-200.
[6] Kuroda S, Fukata M, Nakagawa M, et al. Role of IQGAP1, a target of the small GTPases Cdc42 and Rac1, in regulation of E-cadherin- mediated cell-cell adhesion[J]. Science,1998,281(5378):832-835.
[7] Bertucci F, Salas S, Eysteries S, et al. Gene expression profiling of colon cancer by DNA microarrays and correlation with histoclinical parameters[J].Oncogene, 2004,23(7):1377-1391.
[8] Ouyang X, Jessen WJ, Al-Ahmadie H, et al. Activator protein-1 transcription factors are associated with progression and recurrence of prostate cancer[J].Cancer Res,2008,68(7):2132-2144.
[9] Dong PX, Jia N, Xu ZJ, et al. Silencing of IQGAP1 by shRNA inhibits the invasion of ovarian carcinoma HO-8910PM cells in vitro[J].J Exp Clin Cancer Res,2008,27:77.
[10] Walch A, Seidl S,Hermannstadter C, et al. Combined analysis of Rac1, IQGAP1, Tiam1 and E-cadherin expression in gastric cancer[J].Mod Pathol,2008,21(5):544-552.
[11] Jin J, Lee JW, Rha KS, et al. Expression pattern of IQGAP1 in sinonasal inverted papillomas and squamous cell carcinomas[J].Laryngoscope,2012, 25:23541.
[12] Rana TM. Illuminating the silence: understanding the structure and function of small RNAs[J]. Nat Rev Mol Cell Biol,2007,8(1):23-36.
[13] Merritt WM, Bar-Eli M, Sood AK. The Dicey Role of Dicer: Implications for RNAi therapy[J]. Cancer Res,2010,70(7): 2571-2574.
[14] Chen J, Xie J. Progress on RNAi-based molecular medicines[J].Int J Nanomedicine,2012,7: 3971-3980.
[15] 沈建红,王小飞,高宜录,等.表达IL-1ra的慢病毒载体的构建与鉴定[J].中华神经外科杂志, 2011, 27(10):1059-1062.
[16] Beronja S, Livshits G, Williams S, et al. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos [J]. Nat Med,2010,16(7): 821-827.
[17] Llano M, Gaznick N, Poeschla EM. Rapid, controlled and intensive lentiviral vector-based RNAi[J].Methods Mol Biol,2009,485: 257-270.

