植体负载在种植体周围炎治疗过程中的影响
张 群 张古泉
( 1.淄博口腔医院,山东 淄博 255000;2.泰山医学院口腔医学院,山东 泰安 271000 )
种植体周围炎是种植义齿修复后最常见的并发症 ,也是种植义齿修复后失败的最主要原因[1]。种植体周围炎的治疗原则包括去除菌斑、 控制感染、 消除种植体周围袋、制止骨丧失、诱导骨再生。治疗方法包括局部清创、药物、手术治疗以及去负载治疗,可单独或联合应用。咬合负载过重是种植体周围炎发病的重要促进因素。它导致种植体-骨界面产生微小骨折,形成垂直骨吸收,继而有上皮和结缔组织向根方增殖移行,包绕种植体。软组织移行速度取决于种植体负载大小和叠加的细菌感染程度。负载过重并同时伴有细菌感染时,疾病进展会大大加速。本实验通过设立实验组和对照组通过观察菌斑指数、探诊深度、龈沟出血指数和骨高度的测定来研究未负载对种植体周围炎治疗的影响。
1 病例资料
1.1病例来源 淄博口腔医院种植中心,种植修复完成1年以上,复查时诊断为种植体周围炎患者28例。
28例患者(30枚种植体),男性16例,女性12例。平均42岁。30枚种植体的牙位分布见表1。
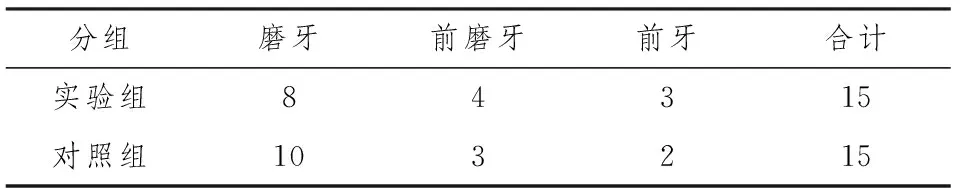
表1 30枚种植体周围炎的牙位分布 (枚)
1.2材 料
手工碳纤维洁治器(universal implant scalers,福克斯公司,北京);盐酸二甲胺四环素(SUNSTAR株式会社,日本)。
1.3处理方法
实验组拆除牙冠及基台,安放愈合帽,种植体周围碳纤维洁治头洁治、局部刮治去除种植体周围炎性肉芽组织,用生理盐水冲洗并吹干,然后将盐酸二甲胺四环素软膏置入牙周袋内,嘱患者用药后0.5h内不喝水、不漱口,1h后可以进食,每周给药1次,连续给药3周,分别在用药前、用药后1周、3周和6周时记录临床指数。对照组不拆除牙冠及基台,其他处理方式同实验组。
1.4检查目的和方法
1.4.1菌斑指数:0:无菌斑;1:探针尖轻划种植体表面即可发现菌斑;2:肉眼可见菌斑;3:大量菌斑。
1.4.2探诊深度:用压力控制塑料探针,以0.2N的力量探测龈缘到牙周袋底的距离。
1.4.3龈沟出血指数 用压力控制塑料探针沿种植体龈缘以0.2N力探针,0:探针无出血;1:点状出血;2:出血在龈沟内呈线状;3:重度出血。
1.4.4放射学检查 在用药前、用药后6个月拍摄平行或分角投照根尖片,检测骨高度的变化。具体方法:有游标卡尺在2倍放大镜下测量从种植体-基台结合部至骨与种植体接触点之间的距离,测量3次,计算均值。
1.5统计与分析
各项临床指数均以种植体为观察单位,计算植体去负载在种植体周围炎治疗过程中的显效率、有效率及无效率。用SPSS10.0统计软件分析用药前后骨高度变化差异有无统计学意义。
2 结 果
2.1菌斑指数变化显示,实验组较对照组相比处理后1周未见明显的差异,但是处理后3周菌斑指数出现统计学差异,此差异在处理后6周更为明显。实验组中处理后1、3、6周与基线期相比菌斑指数明显的下降并呈低水平状态,而对照组菌斑指数增加,在6周后接近基线期水平。见表2。

表2 菌斑指数的变化
注:处理后3、6周实验组和对照组出现统计学差异(*表示);处理后与基线期之间出现统计学差异(#表示)。
2.2牙周袋深度检测显示,实验组与对照组相比在处理后1周未见明显的统计学差异,但是处理后3周可见统计学差异,处理后6周更为明显。实验组中处理后1、3、6周与基线期牙周袋深度逐渐的减小,而对照组未见明显的减小。见表3。

表3 牙周袋深度 (mm)
注:处理后与基线期之间出现统计学差异(#表示)
2.3龈沟出血指数检测显示,实验组与对照组相比在处理后1、3、6周未见明显的统计学差异,但是其两组处理后较基线期出血指数都具有统计学差异。见表4
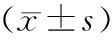
表4 龈沟出血指数
注:处理后3、6周实验组和对照组出现统计学差异(*表示);处理后与基线期之间出现统计学差异(#表示)
2.4骨高度的变化
实验组治疗前种植体-基台结合部至骨与种植体接触点之间的距离为(3.42±0.39)mm,治疗6个月后为(2.14±0.46)mm,前后有统计学差异(P<0.05);对照组治疗前种植体-基台结合部至骨与种植体接触点之间的距离为(3.53±0.22)mm,治疗6个月后为(3.81±0.50)mm,前后无统计学差异(P>0.05)。
3 讨 论
种植体周围炎是种植义齿修复后最为常见也是导致种植失败的并发症,对于种植体周围炎的治疗原则包括去除菌斑、控制感染、消除种植体周围袋、制止骨丧失、诱导骨再生。在治疗的过程中植体去负载起到重要的作用。Tawil等[2]发现种植体过载可以引起种植体周围骨丧失,引起种植体周围炎症,从而导致种植修复的失败。Kozlovsky A等[3]在种植体过载对种植周围炎症的影响的研究中发现:过载可以明显增加BIC率(P<0.05),造成轻微的骨边缘性吸收,加重菌斑所致的骨吸收,而从导致种植体周围炎的产生。因此,种植过程中如果发现种植体过载,要及时调整,减少种植体的负荷和不当应力。我们的实验结果发现在植体去负载之后可以降低种植体周围菌斑等生成,控制了局部的感染,降低了过负荷造成的骨吸收,有利于诱导种植体周围的骨再生。Miyata等[4]实验研究表明种植义齿的过高负载过大即使在没有炎症的情况下也可能造成过负荷性的骨吸收。在外力作用下狗的矿化骨与种植体接触百分率增加,Frost认为起初先造成周围骨组织表面的微破坏,继而进行重塑性修复,重塑发生在微损伤处,但是只要在负荷范围之内就可以发生重塑,否则将会形成种植体周围炎。我们推断在种植体周围炎的治疗过程中去负载可以有效的去除种植体的负荷,使种植体周围进行重塑性的修复进而有利于种植体周围炎的恢复。同时去除了由种植体周围炎造成的种植体周骨组织吸收,支持骨高度降低,继发性种植体负荷相对过重的恶性循环,因此在治疗过程中必须进行去负载。
口腔环境中的基质、细菌及其代谢产物在种植体表面形成的菌斑是种植体周围炎的主要病因,除患者自行实行菌斑控制外,最常用的方法是洁治术,研究[5]发现碳纤维工作头在清除种植体表面的菌斑牙石时,不会像金属洁治器那样损伤种植体表面和造成种植体金属污染。在我们的实验中发现在种植体周围炎碳纤维洁治头治疗后观察菌斑的变化,去负载后可以明显的降低种植体周围菌斑的再沉积,去除种植体周围炎的使动因子。在治疗过程中保留牙冠等负载物会影响菌斑的治疗效果,不利于周围炎的愈合。
我们的研究发现在治疗后6月拍片测量发现种植体在去除负载后可以诱导骨质的再生,消除了种植体周围骨破坏的使动因子。大量研究[6-13]发现机械力与骨的形成和破坏有着密切的生物学联系,机械力可诱导成骨细胞分泌一些细胞因子,这些细胞因子有多功能性,可通过自分泌和旁分泌调控骨的形成和吸收。骨组织受到长期应力作用时会出现疲劳,在骨组织内出现微裂,当积累到一定程度时正常的骨组织丧失,引起种植体微运动从而达到了种植体松动的临界点。
综上所述,种植体的受力在种植体周围炎的治疗过程中起到了重要的作用,治疗中去负载不仅可以消除菌斑沉积的局部促进因素,而且去负载后种植体受力的阈值减低同时促进了种植体周围骨组织的修复和重建过程,但这中效应的具体的分子机制还不十分明确,有待于进一步的研究。
[1] Adell R, Eriksson B, Lekholm U, et al.Long-term follow-up study of osseointegrated implants in the treatment of totally edentulous jaws[J].Int J Oral Maxillofac Implants, 1990, 5: 3472-3591.
[2] Tawil G.Peri-implant bone loss eaused by occlusal overload:repair of the peri-implant defect following correction of the traumatic occlusion[J].A case report.Int J Oral Maxillofac Implants,2008,23(1):153-157.
[3] Kozlovsky A,Tal H,Laufer BZ,et al. Impact of implant overloading on the peri-implant bone in inflamed and non-inflamed peri-implant mucosa[J].Clin Oral Implants Res,2007,18(5):601-610.
[4] Miyata-T, Kobayashi-Y, Araki-H, et al. The influence of controlled occlusal overload on peri-implant tissue[J].Part 3: A histologic study in monkeys[J]. Int J Oral Maxillofac Implants, 2000,15(3):425-431.
[5] 李晓军 ,沙月琴 ,于春泾 ,等.不同洁治器械对钛种植体基台表面的影响[J] .现代口腔医学杂志 ,2000 ,14 (1) :26 - 27.
[6] Klein-Nulend J, Semmeins CM, Ajubi NE. Pulsating fluid flow increaes nitric oxide synthesis by osteocytes but not periosteal fibroblast-correlation with prostaglandin upregulation[J]. Biochem Biophys Res Commun,1995,217:640-648.
[7] Rubin-J, Fan-X, Biskobing-DM, et al. Osteoclastogenesis is repressed by mechanical strain in an in vitro model[J].J-Orthop-Res, 1999,17(50):639-645.
[8] Rubin-J,Murphy-T,Nanes-MS,et al. Mechanical strain inhibits expression of osteoclast differentiation factor by murine stromal cells[J]. A-J-Physiol-Cell-Physiol, 2000,278(6):C1126-1132.
[9] McAllister-TN,Du-T,Frangos-JA. Fluid shear stress stimulates prostaglandin and nitric oxide release in bone marrow-derived preosteoclast-like cells[J]. Biochem Biophys.Res Commun, 2000,270(2):643-648.
[10] Sakai-K,Mothai-M,Shida-J,et al. Fluid shear stress increase interleukin-11 expression in human osteoblastlike cells:its role in osteoclast induction[J].J-Bone-Miner-Res,1999,14(12):2089-2098.
[11] F ermor-B, Gundle-R,Evans-M,et al. Primary human osteoblast proliferation and prostaglandin E2 release in response to mechanical strain in vitro[J]. Bone,1998,22(6):637-643.
[12] Cillo-JE Jr,Gassner-R,Koepsel-RR,et al. Growth factor and cytokine gene expression in mechanically strained human osteoblast-like cells:implications for distraction osteogenesis[J].Oral-Surg-Oral-Med-Oral -Pathol-Oral-Radiol-Endod, 2000,90(2):147-154.
[13] Zhang R, Supowit SC, Klein GL, et al. Rat tail suspension reduces messenger RNA level for growth factors and osteopontin and decreases the osteoblastic differentiation of bone marrow stromal cells[J].J Bone Miner Res, 1995,10(3):415-423.

